RP-HPLC法同时测定布渣叶中牡荆苷和异牡荆苷的含量Δ
孙冬梅,谭志灿,毕晓黎,罗文汇(.广东省中医研究所,广州50095;.广州中医药大学,广州50405)
布渣叶为椴树科植物破布叶Microcos paniculata L.的干燥叶[1],产于广东、广西、海南、云南等地,印度、印度尼西亚亦有分布;在我国,尤以两广地区资源丰富,其中广东的阳西、湛江为主产地,均以野生为主。本品味微酸,性凉,无毒,具有清热利湿、健胃消滞的功效,用于治疗感冒发热、黄疸、食欲不振、消化不良、脘腹胀痛、泄泻、疮疡、蜈蚣咬伤等[2-4]。布渣叶的药用历史最早见于清·何克谏所著的岭南本草书籍《生草药性备要》,载曰:“味酸,性平,无毒,解一切蛊胀,清黄气,消热毒。作茶饮,去食积。又名布渣”。
布渣叶主要含有黄酮、生物碱、有机酸、挥发油、鞣质、酚类等成分[5-11]。其中的黄酮苷类具有多方面的生物活性,如抗脂质过氧化、抗衰老、清除自由基、降低血脂及血胆固醇、抗菌消炎、抗病毒、增强免疫功能等。牡荆苷和异牡荆苷是含量较高的黄酮碳苷,具有降血压、止痉挛、抗感染、抗肿瘤、抗菌、辐射保护以及清除自由基的作用[12-15],故可以作为布渣叶药材的质量控制指标。牡荆苷和异牡荆苷分子中含有许多酚羟基,极性较大,并且是同分异构体,极性相似,不易分离。目前,采用高效液相色谱(HPLC)法同时测定布渣叶中牡荆苷和异牡荆苷的研究未见报道,现行版《中国药典》也仅以牡荆苷作为布渣叶含量测定的指标。因此,本试验建立了布渣叶药材中牡荆苷和异牡荆苷的HPLC含量测定方法,并对不同产地、不同采收期布渣叶中牡荆苷和异牡荆苷进行含量分析,为有效控制药材质量及合理利用植物资源提供参考依据。
1 材料
1.1 仪器
1100型HPLC仪,含二极管阵列检测器(DAD)、四元梯度泵、G2170 AA数据处理软件系统(美国Agilent公司);KQ5200 DE型数控超声波清洗器(昆山市超声仪器有限公司);XS205 DU型电子分析天平(瑞士Mettler Toledo公司)。
1.2 药材
布渣叶(样品来源见表1),经广东省中医研究所刘法锦教授鉴定为椴树科植物破布叶M.paniculata L.的干燥叶。

表1 布渣叶样品来源Tab 1 Sample source of M.paniculata
1.3 试剂
牡荆苷对照品(中国食品药品检定研究院,批号:111687-200602);异牡荆苷对照品(成都瑞芬思生物科技有限公司,批号:Y-127-110705,纯度≥98%);甲醇为色谱纯,水为屈臣氏蒸馏水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:SHISEIDO Capcell pak MG C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.4%甲酸溶液(30∶70,V/V);检测波长:339 nm;流速:1.0 ml/min;柱温:30℃。
2.2 对照品溶液的制备
取牡荆苷和异牡荆苷对照品各适量,精密称定,加70%甲醇溶解并制成质量浓度分别为133.40、184.70µg/ml的混合对照品溶液,即得。
2.3 供试品溶液的制备
取本品粉末(过三号筛)约2.5 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50 ml,密塞,称定质量,超声处理(功率:200 W,频率:40 kHz)1 h,放冷,再称定质量,用70%甲醇补足失质量,摇匀,滤过,取续滤液,即得。
2.4 线性关系考察
精密量取混合对照品溶液1、5、10、15、20、25ml,分别置25 ml量瓶中,加入70%甲醇溶解并稀释至刻度,得牡荆苷质量浓度分别为5.34、26.68、53.36、80.04、106.72、133.40µg/ml和异牡荆苷质量浓度分别为7.39、36.94、73.88、110.82、147.76、184.70µg/ml的系列溶液。精密吸取上述系列溶液各10 μl注入液相色谱仪,按“2.1”项下色谱条件进行测定。以峰面积积分值(y)为纵坐标,进样量(x,ng)为横坐标,进行线性回归,得回归方程为y牡荆苷=2.6418 x+3.0268(r=0.9999,n=6)、y异牡荆苷=2.6962 x-5.1328(r=0.9999,n=6)。结果表明,牡荆苷和异牡荆苷的进样量分别在53.40~1334.00、73.90~1847.00ng范围内与各自峰面积积分值呈良好线性关系。
2.5 精密度试验
精密吸取同一混合对照品溶液(牡荆苷20.40µg/ml、异牡荆苷20.10µg/ml)10µl,注入液相色谱仪,按“2.1”项下色谱条件重复进样6次,记录色谱图。结果,牡荆苷和异牡荆苷峰面积的RSD分别为0.29%和0.47%(n均为6),表明仪器精密度良好。
2.6 稳定性试验
精密吸取同一供试品溶液(S7)10µl,分别于0、1、2、4、8、12、24 h进样测定,记录峰面积。结果,牡荆苷和异牡荆苷质量分数的RSD分别为0.41%和0.37%(n均为7),表明供试品溶液在24 h内稳定性良好。
2.7 重复性试验
精密称取同一批布渣叶样品(S30)适量,共6份,分别按“2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积,计算样品中牡荆苷和异牡荆苷的质量分数。结果,牡荆苷的平均质量分数为0.068%,RSD=0.89%(n=6);异牡荆苷的平均质量分数为0.141%,RSD=0.92%(n=6),表明本方法重复性良好。
2.8 加样回收率试验
取同一批已知质量分数(牡荆苷为0.068%,异牡荆苷为0.141%)的布渣叶样品(S30)9份,每份约1.25 g,精密称定,分别精密加入一定质量浓度的牡荆苷和异牡荆苷混合对照品溶液50 ml,按“2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,计算加样回收率,结果分别见表2、表3。
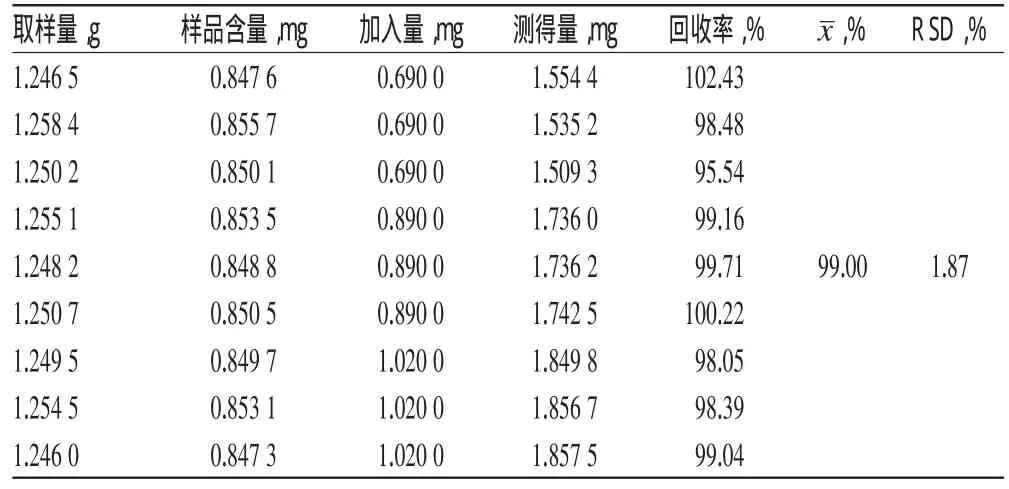
表2 牡荆苷的加样回收率试验结果(n=9)Tab 2 Results of recovery test of vitexin(n=9)

表3 异牡荆苷的加样回收率试验结果(n=9)Tab 3 Results of recovery test of isovitexin(n=9)
2.9 样品含量测定
取不同来源的布渣叶样品适量,分别按“2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件测定样品中牡荆苷和异牡荆苷的质量分数,结果见表4;色谱见图1。
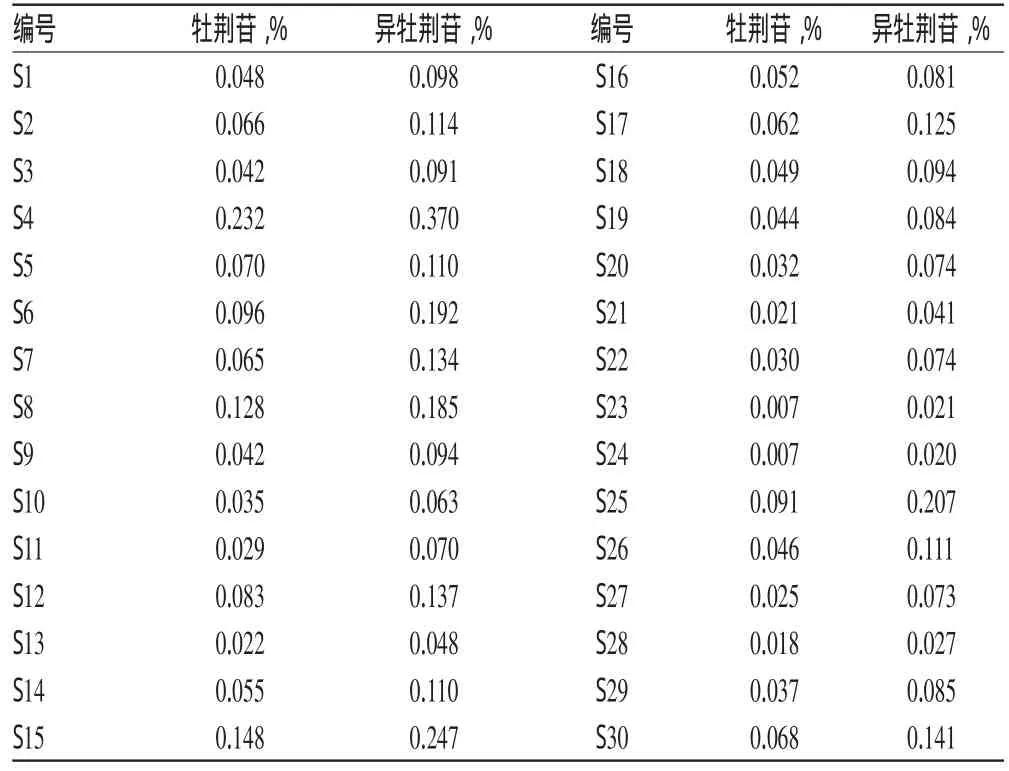
表4 样品含量测定结果Tab 4 Results of content determination of sample
3 讨论
3.1 供试品溶液的制备

图1 高效液相色谱图Fig 1 HPLC chromatograms
试验比较了以50%、70%、100%甲醇及70%乙醇4种不同溶剂对布渣叶药材进行超声处理后所得牡荆苷和异牡荆苷的质量分数。结果表明,采用70%甲醇提取效果较好,而且能很好地减少布渣叶中叶绿素等杂质对色谱柱的污染。在此基础上比较了回流提取和超声处理的效率,结果显示2种提取方法无显著性差异,因此选择操作较方便的超声提取法。另外,比较了超声时间和固液比对提取效果的影响,结果显示超声处理1 h、固液比为1∶20(m/V)时,牡荆苷和异牡荆苷基本能够提取完全。
3.2 检测波长的选择
采用DAD进行全波长扫描,发现牡荆苷和异牡荆苷均在339 nm波长附近有最大吸收,因此选定339 nm为检测波长。
3.3 流动相的选择[16-19]
试验比较了甲醇-甲酸、甲醇-乙酸、甲醇-磷酸3种流动相系统,以及不同的流动相比例,并考察了不同甲酸浓度对牡荆苷和异牡荆苷色谱行为的影响。结果表明,以甲醇-0.4%甲酸溶液(30∶70,V/V)作为流动相为佳,此时牡荆苷和异牡荆苷均能达到基线分离,且峰形对称。
3.4 色谱柱的考察
试验分别考察了不同厂家的色谱柱[Waters XbridgeTMC18(250 mm×4.6 mm,5 μm)、SHISEIDO Capcell pak MG C18(250 mm×4.6mm,5μm)、Merck Hibar Purospher Star RP-18 e(250 mm×4.6 mm,5 μm)、Agilent TC C18(250 mm×4.6 mm,5 μm)、Agela Venusil ASB C18(250 mm×4.6 mm,5 μm)]对牡荆苷和异牡荆苷的分离效果。结果表明,在“2.1”项下色谱条件下,SHISEIDO Capcell pak MG C18(250mm×4.6mm,5μm)和Merck Hibar Purospher Star RP-18 e(250 mm×4.6 mm,5 μm)均能使牡荆苷和异牡荆苷色谱峰达到基线分离。由于采用Merck色谱柱时牡荆苷和异牡荆苷出峰时间延迟,因此选用SHISEIDO Capcell pak MG C18(250mm×4.6mm,5μm)色谱柱。
3.5 质量分析
布渣叶中牡荆苷和异牡荆苷2种黄酮碳苷均具有较强的生物活性,因此以牡荆苷和异牡荆苷为指标,结合药材的外观性状、产量及当地自然环境条件建立药材的质量评价标准,对其进行质量控制与评价,更具科学性。
研究结果表明,布渣叶中牡荆苷质量分数较高的样品,异牡荆苷的质量分数也相对较高;同一样品的2种黄酮碳苷中,以异牡荆苷的质量分数较高。
不同产地布渣叶中2种黄酮碳苷的质量分数存在差异,其中以广东阳西古井、肇庆鼎湖山和雷州等产地的布渣叶牡荆苷和异牡荆苷的质量分数较高,而广东博罗等地的质量分数较低。市场流通的布渣叶饮片中牡荆苷质量分数最高可达到0.259%,最低为0.025%;异牡荆苷质量分数最高可达到0.421%,最低为0.054%,其中牡荆苷的质量分数大部分能达到现行《中国药典》标准。影响2种黄酮碳苷质量分数的因素可能与药材生长的环境(光照、气候、土壤等)有关,同时药材采收的时节、干燥的方法、贮藏和养护的条件等因素也可能对此有影响。
综上,本方法重复性好、操作简便、结果准确可靠,可为布渣叶的质量评价和资源利用提供试验依据。
[1]国家药典委员会.中华人民共和国药典:一部[S].2010年版.北京:中国医药科技出版社,2010:88.
[2]广东省食品药品监督管理局.广东省中药材标准:第一册[S].广州:广东科技出版社,2004:66.
[3]江苏新医学院.中药大词典:下册[M].上海:上海科学技术出版社,1986:1824.
[4]《中药商品知识》编写组.中药商品知识:中册[M].广州:广东科技出版社,1989:129.
[5]石玲艳.破布叶的化学鉴别方法[J].广西中医药,1993,16(2):40.
[6]曾聪彦,吴惠妃,郭展荣.布渣叶化学成分定性鉴别的实验研究[J].世界中西医结合杂志,2009,4(3):175.
[7]罗集鹏.布渣叶黄酮类成分的研究[J].中草药,1993,24(9):455.
[8]Bandara KA,Kumar V,Jacobsson U,et al.Insecticidal piperidine alkaloid from Microcos paniculata stem bark[J].Phytochemistry,2000,54(1):29.
[9]冯世秀,刘梅芳,魏孝义,等.布渣叶中三萜和黄酮类成分的研究[J].热带亚热带植物学报,2008,16(1):51.
[10]毕和平,韩长日,王芳,等.破布叶叶片中挥发油的化学成分研究[J].林产化学与工业,2006,27(3):124.
[11]罗集鹏,张丽萍,杨世林,等.布渣叶的生物碱类成分研究[J].药学学报,2009,44(2):150.
[12]Agnese AM,Pérez C,Cabrera JL.Adesmia aegiceras:antimicrobial activity and chemical study[J].Phytomedicine,2001,8(5):389.
[13]Picerno P,Mencherini T,Lauro MR,et al.Phenolic constituents and antioxidant properties of Xanthosoma violaceum leaves[J].J Agric Food Chem,2003,51(22):6423.
[14]Bramati L,Aquilano F,Pietta P.Unfermented rooibos tea:quantitative characterization of flavonoids by HPLCUV and determination of the total antioxidant activity[J].J Agric Food Chem,2003,51(25):7472.
[15]Hien TV,Huong NB,Hung PM,et al.Radioprotective effects of vitexin for breast cancer patients undergoing radiotherapy with cobalt-60[J].Integr Cancer Ther,2002,1(1):38.
[16]佟美鸿,刘威,付玉杰.HPLC法测定木豆中牡荆苷和异牡荆苷含量[J].林产化学与工业,2008,28(6):34.
[17]李坤平,潘天玲,高崇凯.HPLC法测定布渣叶中牡荆苷和异鼠李素-3-O-β-D-芸香糖苷的含量[J].药物分析杂志,2010,30(9):1746.
[18]笔雪艳,刘晓凤,张清波.HPLC法测定清开灵泡腾片中栀子苷的含量[J].中国药房,2011,22(3):240.
[19]黄其春,涂文升.RP-HPLC法测定甘露扶正口服液中黄芩苷的含量[J].中国药房,2011,22(3):253.

