宫颈微偏腺癌16例临床、影像与病理分析
吴建磊,孙寒雪,常爽,接智慧,王敏
(中国医科大学附属盛京医院1.妇产科;2.病理科,沈阳 110004)
宫颈微偏腺癌(minimal deviation adenocarcinoma of cervix,MDA)是一种罕见的宫颈腺癌,由于其临床表现缺乏特异性,病理组织学改变轻微,常易漏诊及误诊,使大多数患者错过最佳治疗时机,预后不佳。因此,本研究收集了我院自2006年1月至2012年6月间16例MDA患者的临床病理资料,现结合文献总结分析如下:
1 材料与方法
1.1 一般资料
2006年1月至2012年6月我院共收治16例MDA患者,发病年龄37~64岁,平均45.1岁。主诉:白带增多明显,呈稀黏液状12例,其中伴不规则阴道流血5例,病程1个月~5年;接触性阴道流血3例,下腹疼痛1例。妇科检查:宫颈显著增大11例,直径4~8 cm,其中5例宫颈表面光滑,6例伴宫颈表面轻至中度糜烂,3例伴乳头状或息肉状增生,1例宫颈呈溃疡状改变;4例有接触性出血,宫旁组织增厚5例,其中盆侧壁累及1例。血清肿瘤标记物:2例癌胚抗原(CEA)升高(12.7 ng/mL,8.2 ng/mL);4例癌抗原(CA125)升高(45.6 U/mL,231.4 U/mL,85.7 U/mL,136.4 U/mL);1 例甲胎蛋白(AFP)升高(196 μg/L);鳞状细胞癌抗原(SCC)均在正常范围内(0.4~1.1 ng/mL)。宫颈细胞学检查:仅有7例行液基薄层细胞学检查(TCT),其中4例轻度炎症,2例见未明确诊断意义的不典型鳞状上皮细胞,1例见非典型细胞,不除外腺细胞来源。依据国际妇产科联盟(FIGO,2000年)宫颈癌临床分期标准,16例患者临床分期:ⅠB 期 18.8%(3/16),ⅡA 期 25%(4/16),ⅡB期56.3%(9/16)。所有宫颈活检标本及手术切除标本均经HE染色,光镜观察;免疫组化采用SP法,分别有9例应用CEA,7例应用p53,6例应用Ki-67、CAl25及ER染色。16例患者术前均行盆腔超声检查,10例术前行盆腔增强CT检查,7例术前行盆腔增强MRI检查,5例同时行CT和MRI检查。
1.2 治疗及随访
11例行广泛性全子宫切除术及淋巴结切除术,其中1例手术后加局部放疗1个周期后化疗(FIP方案),其余10例手术后行化疗(PVB方案5例,TC方案3例,TP方案2例);2例行宫颈锥切术后加化疗(TC方案);2例门诊阴道镜活检确诊后行新辅助化疗(TC方案);另1例拒绝治疗自行出院。随访2.5~32个月,中位随访时间15个月,随访截止至2012年6月30日。
2 结果
2.1 病理诊断
13例术前行l~2次活检,确诊7例,首次活检确诊5例,首诊确诊率 38.5%(5/13),活检阳性率 53.8%(7/13);另 9例术后病理检查确诊为MDA。术后病理检查结果:16例病变部位可见深层浸润的大量黏液腺体,腺体浸润深部血管及神经组织,达100%(16/16),其中7例浸润宫颈间质全层,占43.8%(7/16);盆腔淋巴结转移者6例,占37.5%(6/16);其他:2例宫旁组织转移,l例右侧卵巢转移。免疫组化:本组病例CEA染色阳性率为55.6%(5/9),p53染色阳性率为28.6%(2/7),Ki-67染色阳性率为 33.3%(2/6),CA125及 ER 均为阴性。见图1。
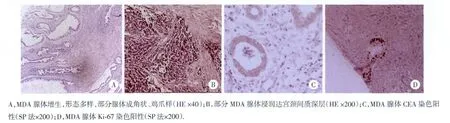
图1 宫颈MDAHE及免疫组化染色图片
2.2 影像学检查
6例患者术前超声检查提示宫颈肥大,2例提示宫颈肥大伴血流丰富,8例提示宫颈囊性改变。8例患者术前行盆腔增强CT检查,提示为宫颈管增大,其中5例呈多囊蜂窝样改变,伴低密度区,增强后可见强化;4例提示宫颈癌可能性大。7例患者术前行盆腔增强MRI检查均见子宫颈增大,其中6例见子宫颈间质多发、不规则的囊性病灶,T1WI低信号,T2WI高信号,静脉注射钆(Gd)后囊肿明显强化。
2.3 治疗及随访
7例患者获随访2.5~32个月。2例健在,其中1例于我院行根治术后加用局部放疗1周期,后行FIP方案化疗5周期,后改用FP方案化疗3周期,于2012年5月复查出现肺转移病灶,现应用斑蝥酸钠+DP方案化疗中。4例分别因局部复发和其他疾病死亡。另9例患者术后未至我院随诊,遂失访。
3 讨论
MDA组织学形态温和,貌似良性,极易误诊。MDA的命名现已扩展应用于具有相应形态特征的子宫内膜样、透明细胞和中肾腺癌[1]。MDA发病率低,所见文献多为个案报道,尚缺乏大样本的流行病学研究结果,国外报道其发病率约占宫颈腺癌的1%~3%[2],国内报道的发病率从1%~7.6%不等[3,4]。本研究中,MDA 占同期收治宫颈腺癌的 1.37%(16/1 168),与国内外文献报道类似。
3.1 临床表现
本组MDA患者平均年龄为45.1岁,与文献报道接近[5]。MDA最常见的临床症状为大量黏液性白带,不规则阴道流血,部分患者间歇性下腹痛及性交后出血。妇科检查宫颈呈不同程度的糜烂、增生,或宫颈部肿瘤,部分形态可正常,后期宫颈可桶状或橡皮球状,光滑,表面呈环形或结节状,质硬。另外,MDA有时还伴有Peutz-Jeghers综合征[6]。由于这些临床表现缺乏特异性,常造成漏诊及误诊,因此,我们认为在临床工作中如遇到这样的病例须注意MDA的可能,采取适当的检查手段,以避免延误诊断及治疗时机。
3.2 诊断
MDA的诊断以宫颈活检或术后病理诊断为准,其组织学特点:(1)腺体类似卵圆形,核质比正常,核染色质不粗,细胞核有异型性,核分裂少见;(2)腺体扭曲,或并有尖角状、鸡爪样或树枝样突出;(3)腺上皮细胞呈高柱状,细胞质内含黏液,异型性不明显;(4)肿瘤性腺体分布不均匀,但一般无背靠背现象。另外,免疫组织化学在MDA的诊断中有重要的作用:CEA、Ki-67、p53、PCNA 在 MDA 中均呈阳性或强阳性反应,而正常宫颈腺体或良性增生的腺上皮中均呈阴性或微弱反应[7],本组16例MDA的确诊由我院2位病理专家阅片确定,均符合上述组织学特点,同时16例MDA免疫组化染色均出现至少1项以上的指标阳性。
3.3 治疗及预后
由于MDA病例数量较少,目前无循证医学的研究,治疗方式的选择尚无统一标准。关于MDA的预后,文献报道差异很大。Gilks等[8]报道26例MDA患者中,2年的无瘤生存率仅为50%,国内李华等[9]报道15例MDA患者的5年生存率达85.7%。本组获随访的7例MDA患者5年生存率为28.6%,远低于文献报道,我们认为与获随访的患者例数较少、分期较晚,且有2例患者术后未接受规范疗程的化疗有关。
MDA病例少见,临床表现不典型,早期诊断困难。临床医生对MDA的临床表现应该提高警惕,检查中应结合超声及增强MRI,如术前影像学检查发现病灶呈多囊性改变并有明显强化,应高度怀疑MDA的可能。总之,如何提高MDA的诊治水平、改善预后仍值得广大临床医生进一步探讨研究。
[1]张建民,黄受方.女性生殖道病理学[M].北京:人民军医出版社,2009:243-246.
[2]Li G,Jiang W,Gui S,et al.Minimal deviation adenocarcinoma of the uterine cervix[J].Int J Gynecol and Obstet,2010,110(2):89-92.
[3]常沽,张莘,周晖,等.5例宫颈微偏腺癌的临床分析[J].癌症,2008,27(12):1310-13l4.
[4]徐珍,彭芝兰,杨开选,等.宫颈微偏腺癌16例临床与病理分析[J].实用妇产科杂志,2011,27(7):519-521.
[5]王袢晨,羊正炎.宫颈微偏腺癌201例分析[J].现代实用医学,2012,24(3):321-322.
[6]伊喜苓,林蓓,朱连成,等.269例子宫颈微偏腺癌的meta分析[J].中国医科大学学报,2009,38(5):369-372.
[7]魏萍,盛修贵,邹卫青.宫颈微偏腺癌14例临床病理分析[J].肿瘤学杂志,2009,15(3):200-201.
[8]Gilks CB,Young RH,Aguirre P,et a1.Adenoma malignum(minimal deviation adenocarcinoma)of the uterine cervix:a clinicopathologic and immunohistochemical analysis of 26 case[J].Am J Clin Pato,1989,13(9):717-729.
[9]李华,郭红燕,韩劲松,等.宫颈微小偏离性腺癌的诊治分析[J].中华肿瘤杂志,2008,30(10):772-774.

