猪肾细胞感染猪伪狂犬病毒后的细胞观察与分析
毛 凝,郑 敏,黄梅清,陈少莺
(福建省农科院畜牧兽医研究所,福建 福州 350003)
流式细胞仪是采用流式细胞术在功能水平上对单个细胞或者其他生物粒子悬液进行定量分析和分选的自动化分析仪器,以获得其大小、内部结构、蛋白质、DNA、RNA及抗原等物理及化学特性。流式细胞仪具有操作简单、分析快速精准、重复性好、费用经济等优点,目前已被广泛使用于检测细胞周期、细胞凋亡和免疫效果检测等方面[1-5]。
猪伪狂犬病毒是疱疹病毒科甲型疱疹病毒亚科的成员,可引起猪繁殖障碍综合症、仔猪脑脊髓炎,仔猪出现呕吐、腹泻、衰竭而死,成年猪一般表现为隐形感染,生长发育受阻并伴随呼吸道症状。目前,猪伪狂犬病在全世界50多个国家和地区均有报道,已给养殖业带来巨大的损失。现在,实验室常用于诊断猪伪狂犬病毒的方法有ELISA和PCR,均只对猪伪狂犬病毒的感染进行定性和定量分析,对细胞确切的变化缺乏微观分析,而利用流式细胞仪则可对其进行细胞水平的分析[6-9]。
1 材料与方法
1.1 试验材料
1.1.1 供试材料 猪肾细胞 (PK细胞)和猪伪狂犬病毒株,由福建省农科院畜牧兽医研究所畜禽疾病防控工程技术研究中心提供。
1.1.2 主要试剂、试剂盒 培养基1640、胰酶(GIBCO、0.25%)、小牛血清(海克隆公司)、PBS(海克隆公司)、RNase A (凯基生物)、碘化丙啶 (凯基生物);细胞周期试剂盒 (KGA512)、细胞凋亡试剂盒 (KGA107),均有凯基生物提供;流式细胞仪 (BD生物科学)
1.2 试验方法
1.2.1 猪肾细胞培养和处理 (1)猪肾细胞体外培养。猪肾细胞采用传统体外培养方法:在含有10%小牛血清的1640培养基中培养,贴壁生长状态良好、铺满培养瓶瓶壁时,用胰酶消化传代,选择生长良好的细胞进行试验。试验组细胞弃去培养液,换入1%小牛血清的维持液,加入100μL猪伪狂犬病毒,显微镜观察试验组细胞发生70%肉眼可见病变时,用胰酶进行消化。对照组为未加入猪伪狂犬病毒的细胞组,与试验组细胞同步消化,各组细胞浓度为5×105mol/L。(2)细胞收集。消化后的细胞平均分为3份,1000r/min离心5 min,弃去上清,PBS (0.01mol/L)重悬,重复2次。
1.2.2 细胞周期检测 (1)收集的细胞悬液用70%的乙醇固定,4℃保存2h,染色前用PBS(0.01mol/L)洗去固定液; (2)加入100μL RNase A,37℃水浴30min;(3)加入400μL PI染色均匀,4℃避光30min;(4)上机检测。
1.2.3 细胞凋亡检测 (1)收集的细胞悬液,2000r/min离心5min; (2)用 PBS (0.01mol/L)洗涤细胞2次 (2000r/min离心5min); (3)加入500μL Binding Buffer悬浮细胞;(4)加入5 μL Annexin V-FITC混匀后,加入5μL Propidium Iodide,混匀; (5)室温、避光、反应5~15 min;(6)6h内上机检测。
2 结果与分析
2.1 猪肾细胞的传代培养和接毒
加入猪伪狂犬病毒前,猪肾细胞排列紧密,单层铺满,细胞呈近圆形 (图1);加入猪伪狂犬病毒后48h,显微镜观察出现空斑病变,细胞皱缩、变小,界限模糊 (图2)。

图1 正常传代培养的猪肾细胞
2.2 细胞周期检测
试验结果显示,处理前细胞多处于DNA合成期 (S)(图3);处理后的细胞大多处在DNA合成前期 (G1)(图4)。说明细胞大多被阻滞在细胞分裂的DNA合成前期,而没有进入细胞分裂间期。

图2 接毒后48h猪肾细胞出现可见病变
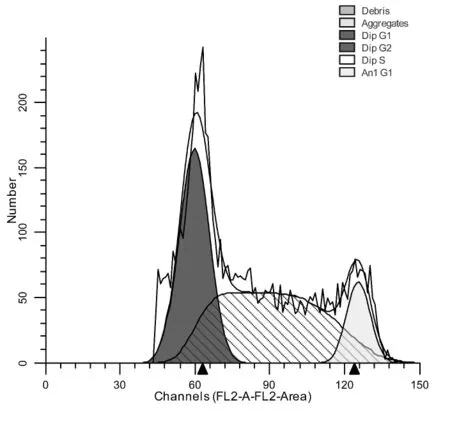
图3 正常细胞周期图
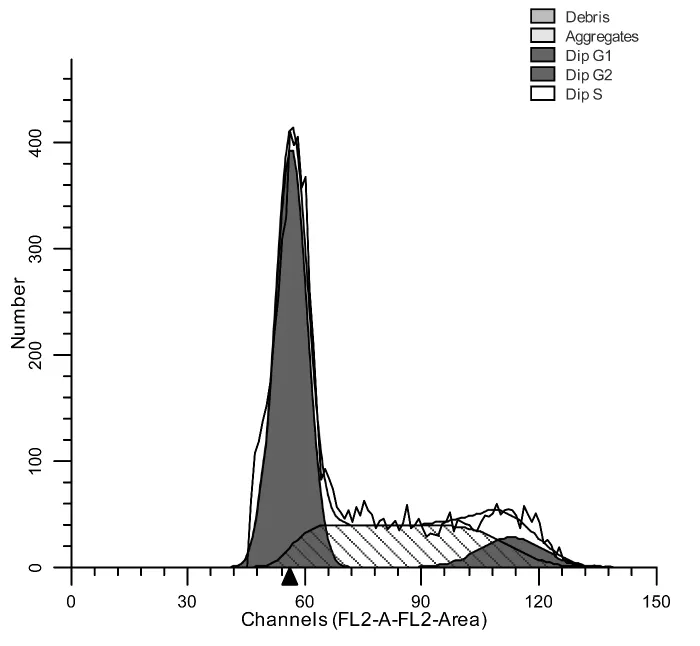
图4 处理后细胞周期图
2.3 细胞凋亡检测
试验显示,正常细胞出现在左下角,显示PI和FITC染色双阴性 (图5);处理后的细胞集中在右下角,PI染色阴性而FITC染色阳性,提示细胞处于凋亡后期 (图6)。

图5 正常细胞凋亡
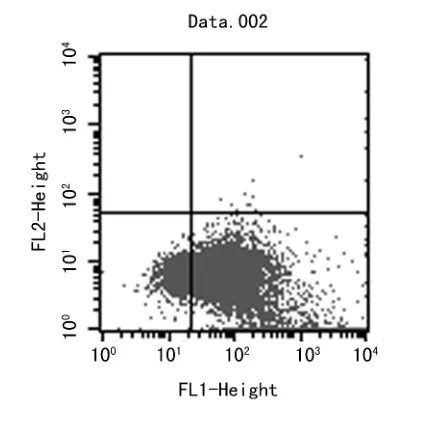
图6 处理后细胞凋亡
3 讨论
细胞周期是指连续分裂细胞从一次有丝分裂结束到下一次有丝分裂结束所经历的整个过程。通过细胞周期,细胞的遗传物质开始复制并加倍,在分裂结束时平均分配到两个子细胞中去。细胞周期分为细胞间期和有丝分裂期,细胞间期常划分为休眠期G0、DNA合成前期G1、DNA合成期S、DNA合成后期G2。本实验利用细胞内DNA能够和荧光染料碘化丙啶 (propidine iodide,PI)结合的特性进行检测,即细胞各个时期的DNA含量不同,其与荧光染料的结合情况也不同,流式细胞仪检测的荧光强度也不一样。实验结果显示,病毒感染后,细胞大部分停滞在DNA合成前期而没有继续进入DNA合成期,即细胞没有进入正常的细胞周期,进而出现凋亡。
细胞凋亡是细胞在一定的生理或者病理条件下,按照自身的规律,启动内部机制来结束自己生命的过程,即细胞在基因控制下的程序性死亡,是机体维持自身内稳定的基本生理功能。本研究采用Annexin-FTIC和PI为双荧光探针,Annexin-FTIC/PI法是流式细胞仪检测细胞凋亡常用的方法之一。正常细胞膜磷脂的分布是不对称的,膜内表面含负电的磷脂 (如磷脂酰丝酸,PS),而膜外表面含有占绝大多数的中性磷脂。在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin V是一种分子量为35×103~36×103的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin V进行荧光素FITC标记即能检测到细胞早期凋亡。碘化丙啶 (propidine iodide,PI)是一种核酸染料,它不能透过完整的细胞膜,而早期凋亡细胞的细胞膜是完好的对PI有拒染性,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来[10-12]。实验结果显示,病毒感染后的细胞在双参数流式细胞仪的散点图上,左下象限为正常细胞,即 (FITC–/PI-);右上象限是非活细胞,即坏死细胞,为(FITC+/PI+);而右下象限为凋亡细胞,显现(FITC+/PI-)。
综上所述,猪伪狂犬病毒感染猪肾细胞影响了细胞的正常周期,大部分细胞被阻滞在DNA合成前期无法进入下一步程序;细胞进而出现大量的凋亡,既而形成了显微镜可见的空斑。
[1]丛玉隆.流式细胞仪的临床应用 [J].继续医学教育,20(26):50-59.
[2]马端辉,庄金秋,申识川.流式细胞仪的原理及其在畜牧兽医中的应用 [J].动物医学进展,2007,28(2):103-106.
[3]曾文军,王柳均,樊翌明,等.细胞凋亡的流式细胞仪检测技术研究进展 [J].医学文选,2005,24(3):425-428.
[4]MCCLOSKEY TW,OYA U N,CORONESI M,et a1.Use of a flow cytometricassay to quantitate apopmsis in human lymphocytes[J].Clin Immunollmmunopathol,1994,71 (1):14-18.
[5]王书奎,周振英.使用流式细胞术彩色图谱 [M].上海:上海第二军医大学出版社,2004.
[6]史须斌.猪伪狂犬病毒的分子生物学研究进展 [J].科技向导,2012 (8):132.
[7]蒋国文.猪伪狂犬病的防制 [J].饲料与畜牧,2011(8):34-35.
[8]中国农业科学院哈尔滨兽医研究所.动物传染病学 [M].北京:中国农业出版社,1999.
[9]叶能胜.猪伪狂犬病的流行特点及综合防控措施 [J].畜禽业,2010 (11):74-75.
[10]VERMES J,HAANEN C,STEFFENS N,et a1.Anovel assay for apoptosis: Flow cytometric detection of ph0sphatidylserineexpressi0non earlyapoptic cells using fluoreescine labelled Annexin V [J].JImmunol M ethods,1995,184 (1):39-42.
[11]王敬春,苗术,黄海涛,等.流式细胞仪在细胞凋亡检测中的应用 [J].齐齐哈尔医学院学报,2007,28 (8):970-971.
[12]梁智辉,朱慧芬,陈九武.流式细胞术基本原理与实用技术[M].武汉:华中科技大学出版社,2008.

