化学还原法制备小粒径金纳米粒子
丰荣娟,李 敏,刘家祥
(北京化工大学 材料科学与工程学院,北京100029)
金纳米颗粒因具有明显的表面效应、量子效应、小尺寸效应及生物亲和性等而成为光学、电子、催化、生物医药等方面的研究和应用热点[1-4]。将金纳米粒子用于制作生物传感器,制得的传感器选择性强、稳定性好且操作方法简便。金纳米颗粒比表面积大,表面自由能高,酶可在其表面得到强有力的固定,不易渗漏,金溶胶具有很好的生物相容性,并且导电性良好,可在酶与电极之间传递电子,显著提高酶电极的响应灵敏度,可开发研制第三代无媒介生物传感器。在纳米化学、凝聚态物理及纳米材料科学中,金纳米粒子是首选的衬底材料之一[5,6]。在生物医药方面,金纳米颗粒可以应用于免疫化学、DNA的识别与检测,作为载体应用于基因治疗[7,8]。金纳米粒子的制备方法主要有液相还原法、模板法、光化学法、电化学法、微波法、晶种法[9,10]等,液相还原法是制备金溶胶的经典方法,该方法成本低、设备简单、反应时间短、操作简便,但是用该法制备的金纳米粒子的直径大于12nm,目前对于如何制备粒径小于12nm、分散性好、粒径分布窄的金纳米粒子鲜见报道。另外,考察制备过程中的各种影响因素(如聚乙烯吡咯烷酮用量、温度)的影响方式及原因,完善实验条件,制备出尺寸及形貌准确可控的金纳米颗粒,对深入研究金纳米颗粒催化体系及表面增强拉曼散射(Surface-Enhanced Raman Scattering,SERS)的构效关系具有重要的意义。
本工作以聚乙烯吡咯烷酮为保护剂用硼氢化钠还原氯金酸,系统地研究还原剂和保护剂的用量、反应温度及试剂加入顺序对制备的金纳米颗粒粒径、形貌与分散度的影响。通过优化反应条件制备出粒径均一、平均粒径在4.3nm、分散性好的金纳米颗粒。
1 实验
1.1 试剂
氯金酸(HAuCl4·4H2O,国药集团化学试剂有限公司),聚乙烯吡咯烷酮(PVP,K30,分子量M 约为40000,汕头市西陇化工有限公司)、硼氢化钠(NaBH4,天津市海纳川科技发展有限公司),均为分析纯,实验前未经进一步纯化。实验用水均为超纯水装置净化的3次去离子水,电阻率大于18.0MΩ·cm。所有玻璃器皿均先由王水浸洗,再用清水多次冲洗后置于烘箱内干燥。
1.2 金纳米颗粒的制备与表征
1.2.1 金纳米颗粒的制备
分别采用两种方式制备金溶胶。方式1:将一定量的氯金酸溶液(0.024mol/L)与PVP溶液(1×10-4mol/L)混合并稀释至100mL,加热搅拌该混合溶液,加热一段时间后,迅速注入一定量硼氢化钠溶液(0.03mol/L),加热搅拌数分钟后移去热源,停止搅拌冷却至室温,4℃避光保存。方式2:将一定量的硼氢化钠溶液(0.03mol/L)和 PVP溶液(1×10-4mol/L)混合,加热搅拌一定时间后迅速注入一定量氯金酸溶液(0.024mol/L),加热搅拌一定时间后移去热源,停止搅拌冷却至室温,4℃避光保存。
1.2.2 金纳米颗粒的表征
利用H-800型透射电子显微镜(100kV条件下)观察样品颗粒大小、形貌及分散情况;利用UV-2200型紫外可见分光光度计测定金溶胶的紫外-可见吸收光谱,扫描范围为300~700nm。
2 结果与讨论
2.1 还原剂用量的影响
根据氯金酸和硼氢化钠的反应方程式,硼氢化钠和氯金酸的理论摩尔比为3∶8,为保证氯金酸反应完全,实验中使其摩尔比大于3∶8。固定氯金酸和保护剂的用量,并且质量比为1,在100℃的反应温度下搅拌加热,改变硼氢化钠的用量来制备金纳米溶胶。表1是不同还原剂用量制备的金溶胶的特性参数,图1和图2分别是金溶胶的紫外吸收光谱图和TEM图。
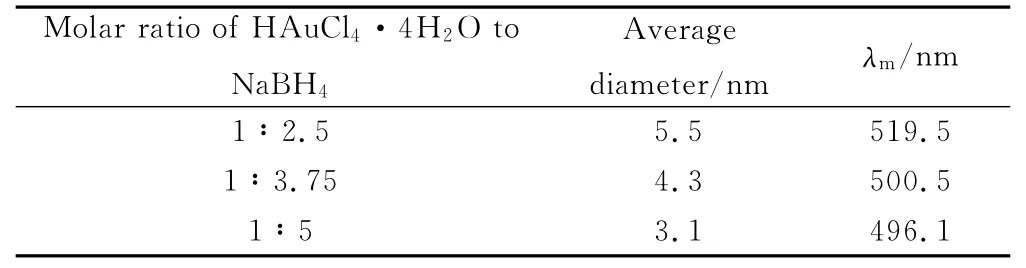
表1 不同还原剂用量制备的金溶胶的特性参数Table 1 The characteristic parameters of gold prepared by different amount of NaBH4
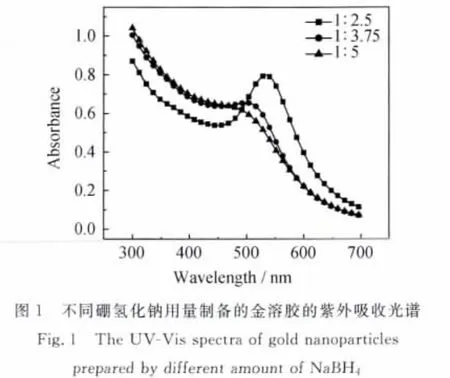

图1为不同硼氢化钠用量制备的金溶胶的紫外吸收光谱,金胶体样品均在520nm附近出现纳米金的表面等离子体共振吸收峰。溶胶的吸收峰随硼氢化钠用量的增加不断蓝移,且半峰宽变大,说明生成的金颗粒的粒径不断减小,且粒径分布变宽。从图2看出颗粒呈球形或者近似球形,分散性逐渐变差,粒径变化规律与上述结果一致,与文献[11]结论一致:纳米颗粒减小,λm向短波方向移动;颗粒增大,λm向长波方向移动。
胶体金颗粒的析出过程与结晶过程相似,可分为两个阶段:第一阶段是晶核形成,第二阶段是晶体成长,而晶体的粒度与形貌又很大程度上受晶核形成与生长机制的影响[12]。实验中,当少量硼氢化钠加入后,首先使部分被还原成金原子形成晶核。由于初始晶核粒度极小,具有很高的表面能,金原子一旦形成稳定的晶核[12,13],生成的晶核就会吸附,且生成晶核的速率慢并且数量少,剩余的数量就多,吸附的可能性也大,被吸附的离子进一步被还原,生成的金颗粒就比较大。而较多硼氢化钠加入时,因为一次有大量的晶核形成,晶核一形成,周围没有剩余的AuCl4-离子,将吸附保护剂PVP来维持自身的稳定,因此能得到粒径更小、均一性更好的金颗粒。通过表征得出当硼氢化钠与氯金酸的摩尔比为3.75∶1时制备的金颗粒的粒径均一、分散性较好。
2.2 温度的影响
固定氯金酸和保护剂的质量比为1,并使硼氢化钠与氯金酸的摩尔比为3.75∶1,改变反应温度搅拌加热。表2是不同温度制备的金溶胶的部分特性参数,图3是不同温度条件下制备的金溶胶的紫外吸收光谱图。

表2 不同温度制备的金溶胶的特性参数Table 2 The characteristic parameters of gold prepared at different temperatures

图3 不同温度条件下制备的金溶胶的紫外吸收光谱Fig.3 The UV-Vis spectra of gold nanoparticles prepared at different temperatures
由图3观察到金溶胶的吸收峰随反应温度的降低,λm红移,半峰宽变宽,说明生成的金颗粒的直径随温度升高而变小且粒径分布变窄。透射电镜的结果与紫外光谱的类似:反应温度为100℃时,生成的金颗粒均一且粒径最小,分散性也最好。
温度越高,分子运动越剧烈,越有利于纳米金颗粒的分散,颗粒碰撞的几率也会增加,增加了颗粒团聚的几率,但是由于保护剂的存在,有效地阻止了纳米金颗粒的团聚。不同的反应温度,生成晶核的速率不一样,温度越高,生成晶核的速率越快[14],溶液中剩余的越少,吸附的可能性小,所以生成的金颗粒的粒径小,并且更均一。本实验中,随反应温度升高,生成的金颗粒粒径逐渐减小、粒径更均一、分散性更好,与文献[14]报道一致。
2.3 保护剂用量的影响
固定氯金酸的用量,改变保护剂PVP的用量,在100℃的反应温度下加热搅拌一段时间,迅速加入一定量的硼氢化钠(硼氢化钠与氯金酸的摩尔比为3.75∶1)来制备金纳米溶胶。表3为不同保护剂用量制备的金纳米溶胶的特性参数,金纳米溶胶的紫外吸收光谱见图4。
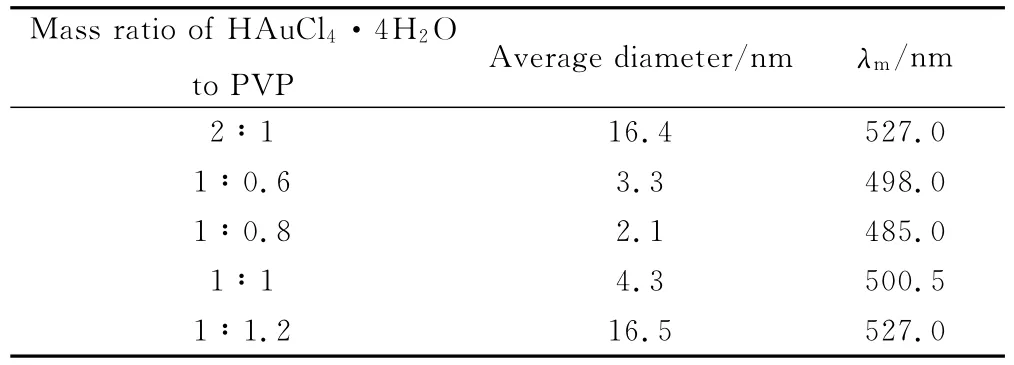
表3 不同保护剂用量制备的金溶胶的特性参数Table 3 The characteristic parameters of gold prepared by different amount of PVP
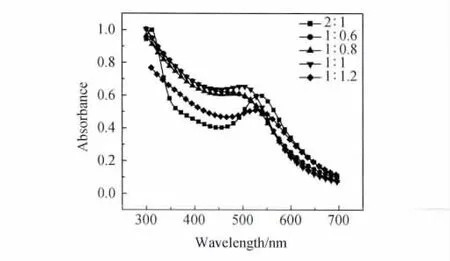
图4 不同保护剂用量制备的金溶胶的紫外吸收光谱Fig.4 The UV-Vis spectra of gold nanoparticles prepared by different amount of PVP
图4显示λm随PVP加入量的增加先蓝移后红移,半峰宽先减小后增加,说明生成的金颗粒的粒径先减小后增加,粒径分布范围先变窄后变宽。透射电镜图观察到的结果与紫外吸收光谱的结果一致:随PVP加入量增加,金颗粒的粒径先减小后增加,粒径分布范围先变窄后变宽,分散性先变好后变差。
溶胶是高度分散的多相体系,能量高,是热力学上的不稳定体系,而溶胶的团聚会使体系的能量降低。PVP带有的亲水性极性基团保证了金颗粒在水中呈良好的分散性,而且PVP可以阻止金颗粒的长大及团聚。采用PVP为保护剂不仅能有效地阻止颗粒团聚并缩小金颗粒的尺寸,而且可使制得的金溶胶具有很好的分散性。PVP对溶液中金颗粒的表面包裹经过三个过程:包裹不完全、刚好完全包裹、包裹完全的PVP在多余的PVP作用下开始发生解离[15]。当PVP加入量相对较少时,PVP对生成的金颗粒表面只能进行部分包裹,没有被包裹的表面还可以吸附溶液中的继续还原,导致粒径较大且粒径分布较宽,并且由于PVP的加入量没有达到实际需要量,导致粒子的分散性也不是很好;随着PVP加入量增加,达到某个加入量(即氯金酸与PVP的质量比为1)时PVP恰好完全包裹金颗粒,此时金颗粒表面不能再吸附溶液中的继续还原,因而生成的金颗粒最均一、粒径最小,并且金颗粒的分散性也最佳;PVP加入量继续增加,则溶液中的PVP与吸附在金纳米粒子表面的PVP作用,PVP从金颗粒表面解离,此时金颗粒的表面已不能被PVP完全包裹,导致粒径变大、粒径分布变宽、分散性变差。
2.4 试剂加入顺序的影响
改变硼氢化钠的加入顺序:①将一定量氯金酸和PVP混合,在100℃的反应温度下搅拌加热,快速加入硼氢化钠制备金纳米颗粒。②将一定量硼氢化钠与PVP混合,在100℃的反应温度下搅拌加热,加入氯金酸来制备金颗粒,制备的金溶胶的紫外吸收光谱如图5所示。

图5 硼氢化钠不同加入顺序制备的金溶胶的紫外吸收光谱Fig.5 The UV-Vis spectra of gold nanoparticles prepared by different order of NaBH4
图5显示先加硼氢化钠的λm比后加硼氢化钠的λm要大,并且半峰宽要大,吸光度要小。这说明先加硼氢化钠与后加硼氢化钠制备的金颗粒相比:粒子直径大、粒径分布宽、金溶胶浓度小。
硼氢化钠为强还原剂,常温条件下即可发生水解反应。若先将硼氢化钠与PVP混合加热,在高温下部分硼氢化钠迅速发生水解反应生成氢气[16],导致溶液中的硼氢化钠的量减少,加入氯金酸后只有少量晶核生成,溶液中剩余的较多吸附在晶核表面继续生长导致生成的金颗粒粒径较大、粒径分布较宽。
3 结论
(1)选用硼氢化钠为还原剂,其用量以硼氢化钠与氯金酸的摩尔比为3.75∶1时为最佳,在此条件下制得的金颗粒的粒径为4.3nm、粒径分布窄、分散性好。
(2)制备金溶胶的适宜温度为100℃,制得的金颗粒分散性好、粒径均一。
(3)氯金酸与PVP质量比为1∶1时,PVP可以阻止金颗粒的长大及团聚,并使制得的金溶胶有很好的分散性,粒径分布窄。
(4)相对于氯金酸的加入顺序,后加硼氢化钠比先加硼氢化钠制得的金颗粒更均一、粒径小。
[1]ROJLUECHAI S,CHAVADEJ S,SCHWANK J W,etal.Catalytic activity of ethy-lene oxidation over Au,Ag and Au-Ag catalysts:support effect[J].Catal Commun,2007,8(3):57-64.
[2]QIAN X M,PENG X H,ANSARI D O,etal.In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags[J].Nature Biotechnology,2008,26(1):83-90.
[3]PASQUATO L,RANCAN F,SCRIMIN P,etal.N-methylimidazole-functionalized gold nanoparticles as catalysts for cleavage of a carboxylic acid ester[J].Chemical Communications,2000,22:2253-2254.
[4]WANG M J,WANG L Y,YUAN H,etal.Immunosensors based on layer-by-layer self-assembled Au colloidal electrode for the electrochemical detection of antigen[J].Electroanalysis,2004,16(9):757-764.
[5]谢微,苏乐,沈爱国,等.金纳米花生的制备及其SERS增强研究[J].分析化学,2009,37(增刊2):12.XIE W,SU L,SHEN A G,etal.Preparation of nano-gold peanut and research of their SERS enhancement[J].Chinese Journal of Analytical Chemistry,2009,37(S2):12.
[6]阮伟东,吕志成,纪楠,等.紫外光引发还原制备金溶胶及其SERS活性的研究[J].光散射学报,2006,17(4):329-331.RUAN W D,LV Z C,JI N,etal.Preparation of gold colloid induced by ultraviolet irradiation and its application in SERS[J].Chinese Journal of Light Scattering,2006,17(4):329-331.
[7]SCAFFIDI J P,GREGAS M K,SEEWALDT V,etal.SERS-based plasmonic nanobiosensing in single living cells[J].Anal Bioanal Chem,2009,393(19):1135-1141.
[8]马立娜,刘殿骏,王振新.金纳米粒子探针的合成及应用[J].分析化学,2010,38(1):1-7.MA L N,LIU D J,WANG Z X.Formation and application of gold nanoparticle probes[J].Chinese Journal of Analytical Chemistry,2010,38(1):1-7.
[9]周思凯,方少明,张伟.金纳米粒子的最新研究进展[J].中国材料科技与设备,2007,(5):1-5.ZHOU S K,FANG S M,ZHANG W.The latest research progress of gold nanoparticles[J].Chinese Materials Science Technology &Equipment,2007,(5):1-5.
[10]殷焕顺,艾仕云,汪建民.制备金纳米粒子的研究进展[J].材料研究与应用,2007,1(4):277-280.YIN H S,AI S Y,WANG J M.Progress in preparation and application of nano-gold particles[J].Journal of Guangdong Nonferrous Metals,2007,1(4):277-280.
[11]LINK S,EI-SAYED M A J.Size and temperature dependence of the plasmon absorption of colloidal gold nanoparticles[J].Phys Chem B,1999,103(21):4212-4217.
[12]KOZLOVA A I,KOZLOVA A P,LIU H C,etal.A new approach to active supported Au catalysts[J].Appl Catal A,1999,182(1):9-28.
[13]BURDA C,GREEN T,LANDES C,etal.Optical Spectroscopy of Nanophase Material[M].New York:Wiley,2000.197-241.
[14]郑海霞,黄博能,胡君曼.制备特定尺寸的纳米金颗粒方法及性能表征[J].北京大学学报:自然科学版,2011,47(5):1-9.ZHENG H X,HUANG B N,HU J M.Synthesis and characterization of gold nanoparticles with various diameters[J].Acta Scientiarum Naturalium Universitatis Pekinensis,2011,47(5):1-9.
[15]彭思,严华.PVP在水相金纳米粒子表面吸附过程的研究[J].材料工程,2008,(10):353-355.PENG S,YAN H.Coating process of PVP layer on nearly monodisperse aqueous dispersions of gold nanoparticles[J].Journal of Materials Engineering,2008,(10):353-355.
[16]张翔,孙奎斌,周俊波.硼氢化钠水解制氢技术研究进展[J].无机盐工业,2010,42(1):9-12.ZHANG X,SUN K B,ZHOU J B.Progress in hydrogen production technology from hydrolysis of sodium borohydride[J].Inorganic Chemicals Industry,2010,42(1):9-12.

