氢氟酸及其在汽车清洗行业的应用综述
Homer C. Genuino,Nftli N. Opeme, Eric C. Njgi,Skye McClin ,Steven L. Sui ,*
a 康涅狄格大学化学系, Eagleville北路55号,Mansfild,美国
b Nerac公司,Tolland,美国
1. 前言
氢氟酸(HF)作为产量大的产品在材料生产过程中是必不可少的原料,在学术研究、居家及工业设施领域也是一种很有价值的化学试剂[1]。在1771年,卡尔 . 威廉 .舍勒首先制备了大量天然氢氟酸[2]。在19世纪后期和20世纪初,氢氟酸被用于玻璃蚀刻、铸造除垢、氟化钠合成和高辛烷值燃料生产。在此基础上,人们开始将氢氟酸作为汽车清洗剂主要成分使用。从历史上看,大多数洗车清洁产品都是在温和的碱和稀释氢氟酸配成的除垢剂基础上,进一步调整配方以便于使汽车上的污垢变得疏松并最终除去[3]。随着全球汽车工业的增长,对更便宜和更有效的高强度清洗液的追求,使得人们开始在专业洗车业务包括汽车维护和保养中使用氢氟酸。人们希望自己的座驾清洁如新,因此定期清洗汽车成为一种必然。据估计,现在美国和欧洲运营商[4]每年至少新安装50套洗车设备。
自1939年以来,专业洗车服务为消费者提供了一种方便、省时省力、实用的洗去汽车尘土和污垢的方式[5,6]。汽车清洁基本内容包括除去油脂和污垢,然后提供汽车养护[7]。除油剂和清洁剂先除去汽车上污垢和颗粒物,随后在汽车表面使用蜡抛光并加涂保护涂层。无论是传统还是现代的专业洗车设备,从操作手段上一般可以分为以下几类:手动清洗,洗车场自助清洗,全自动清洗,隧道清洗,化学清洗及蒸汽清洗设备[8]。传送带操作洗车,即传送带运输汽车通过洗涤隧道,由摩擦或无摩擦系统进行洗车。无摩擦系统采用高压喷嘴朝汽车上喷清洗剂;而摩擦系统则在汽车通过时使用多个刷子进行清洗。在全自动清洗过程,汽车保持静止,一台机器前后来回移动对车辆进行清洗。在自助清洗时,客户使用低压刷子或水龙带洗车,水龙带上装着喷嘴,喷嘴能够控制水或清洗剂的流量和压力。在使用传送带和洗车场自动系统洗车时,需要朝车身上人工喷撒化学剂。含有氢氟酸的洗车清洗液能够很轻易地除去汽车上的道路灰尘、铁锈污点、污泥、刹车痕迹和尘垢。
由于氢氟酸对人体和环境具有危害,随着它的普及,监管法规也更加复杂。在洗车过程中,如果吸入或口腔、眼睛、皮肤等接触氢氟酸,都有可能引发严重的局部和全身中毒。因此,在汽车清洗行业,一直都在大力研究开发更安全的汽车清洗剂并改进洗车技术[9]。这些举措获得了一些成果,使用氢氟酸的专业洗车场的数量已经开始下降。洗车运营商被要求按法律规定对洗车污水进行重复使用和排放前预处理,并要求持有废水排放许可证[10]。近年来,洗车场开始采用废水回收系统和减少能源消耗新技术。然而,仅在美国就有44.5%的车主(在2008年,相当于6100万辆轿车[11])还是喜欢在车道或后院清洗汽车,并且至少75%的汽车每年至少在家中洗一次
[10]。这值得关注,因为氢氟酸仍然作为大量常用清洗剂中的一个组成成分。在家中洗车是一种不规范的洗车方式,车道洗车产生的有害废水排入雨水管,可能污染地下水和地表水。因此,一些国家和地方机构已经开始行动,鼓励消费者花钱使用正规专业洗车场,反对人为在车道和家庭后院洗车。
到今天为止,尚没有学术机构或实验室针对氢氟酸用于洗车行业时的基本化学性质进行研究。这是因为:一方面氢氟酸化学性质特殊,研究其性质具有困难;另一方面人们把大量的精力用于研究和推广氢氟酸的替代产品。然而,这并不意味着不具备(学术和工业)相关研究的条件。
本文提供了关于氢氟酸的来源、全球生产情况和几种用途的背景知识。同时介绍了氢氟酸的物理化学性质、毒性、对人体和环境负面影响以及关于其使用的有关规定。我们还强调了氢氟酸的材料选择、储存规定、汽车清洗剂配方以及来自道路交通的聚集于汽车上颗粒物的来源和属性。本文主要研究氢氟酸在洗车工业中的应用,包括有效除去典型的制动片和道路灰尘的原理阐述。在最后一节,给出了已发现的可用于家居和工业设备清洗的氢氟酸替代物。
2. 氢氟酸的来源
矿物萤石,俗称为萤石(CaF2),是生产氟化氢、氟和氟化钠[12]的重要原料。其他替代材料包括氟磷灰石(CA5(PO4)3F)和冰晶石(Na3AlF6)。氟化氢是最重要的氟化物,同时也是许多氟化物燃烧时的产物,如含有氟橡胶®和聚四氟乙烯(Teflon®)的氟化物[13]。许多国家发现了萤石,特别是在中国、德国、奥地利、瑞士、英国、挪威、墨西哥、加拿大和肯尼亚[14]。美国在伊利诺伊州进行的萤石商业开采于1995年终止。今天,国防储备库是美国国内供应萤石的唯一来源。小批量的合成萤石也能从工业废水[15]中获得。
氢氟酸由无水氟化氢生成,在常温下为无色的气体或液体。氢氟酸可以由含氟化合物水解产生,含氟化合物包括羰基氟、三氟化硼、五氟化磷、四氟化硅、四氟化硫和火山排放物中含的三氟化磷[16]。海洋喷雾和含氟岩石和土壤的风化产生的灰尘以及人类活动污染物是大气氟化合物[17,18]的其他来源。
当无水氟化氢被排放到空气中,与水蒸汽接触立即变成烟和白雾[19]。通常生成的无水氟化氢纯度为99~99.9%,然而市场上氢氟酸主要是浓度为70%的溶液[20]。工业上生产的电子和试剂级的氢氟酸浓度是5~52%[20]。世界各地制造无水氟化氢基本上都通过氟化钙与硫酸进行反应,该反应式由Gay Lussac和Thernard发现,在1809年他们作为第一批化学家获得纯的氟化氢[21]。当加热到538 K时,氟化钙和硫酸反应生成无水氟化氢气体和固体硫酸钙,反应式如1所示[22]。

此工艺通过浓硫酸与萤石(≥97.5%氟化钙)反应获得氟化氢。氟化氢离开反应器后被冷凝,然后通过蒸馏纯化。氢氟酸是通过迅速将无水氟化氢溶解于水获得。
氟化氢也是提取磷酸(肥料前身)的一个副产品,磷酸是从矿物磷灰石(CA5(PO4)3(F,Cl,OH))[13]获得的。磷灰石遇酸释放气体硫,包括氟化氢,二氧化硫,水蒸汽和颗粒物。气体生成物和固体分离,与浓硫酸和发烟硫酸生成无水氟化氢。氢氟酸是伴随着硅酸盐矿物溶解过程产生的,并产生大量的氟硅酸(H2SiF6)[13]。
3. 全球生产和美国进口氢氟酸的情况
1931年氢氟酸第一次商业化生产,其产量稳步增加。在1967年和1974年分别达到161260和375000公吨[23]。2008年的数据显示,中国、墨西哥、蒙古和南非的氢氟酸产量最高,这4个国家的萤石产量分别是3250000、1058000、380000和316000吨[24]。同样在2008年,在美国氢氟酸和氟化铝反应消耗的萤石量(含有> 97%的氟化钙)最多。
表1介绍了北美最大的商业氢氟酸生产商[25],而表2显示了在2008年和2009年美国分别进口的氢氟酸量[15]。霍尼韦尔仍然是世界上氢氟酸的最大生产商,并积极地研究安全处理和运输氢氟酸的方法[26]。在2002年,E.J. du Pont de Nemours &Co. Inc.(杜邦公司)停止零售无水氢氟酸[25],但德克萨斯州拉波特的杜邦工厂继续自产自用无水氢氟酸。美国消耗的大部分氢氟酸靠进口。美国进口氢氟酸从2008年及2009年分别比上一年度下降了12.5%和14%[24]。
4. 氢氟酸的应用
由于氢氟酸具有强腐蚀性[27],其在工业和家庭领域的应用越来越多。例如,氢氟酸广泛应用于清洁不锈钢(这个过程被称为酸洗)[28],蚀刻玻璃,除去金属氧化物,提取金属,纯化石英[29]。制造商出售桶装或包装的氢氟酸。图1介绍了氢氟酸化合物的主要用途[25]。生产制冷剂的无水氟化氢占总量的60%,制冷剂包括氢氟碳化合物、氢氟氯碳化合物和含氟聚合物[30]。其他用途所占比例如下:化学衍生物,18%(有机和无机氟化合物,具有高度专用的属性,例如,织物或纤维处理剂,三氟化硼,六氟化硫和氟盐);铝制造,6%;不锈钢酸洗,5%;石油烷基化催化剂,4%;生产铀化学试剂,3%;其他用途,4%[30,31]。氟化氢也可以制备其他具有工业价值的无机氟化合物,包括冰晶石,六氟铝酸钠,氟化铝。无机氟化合物包括氟化钠和六氟化铀也可以用于生产氢氟酸。

表1 北美氢氟酸主要生产商
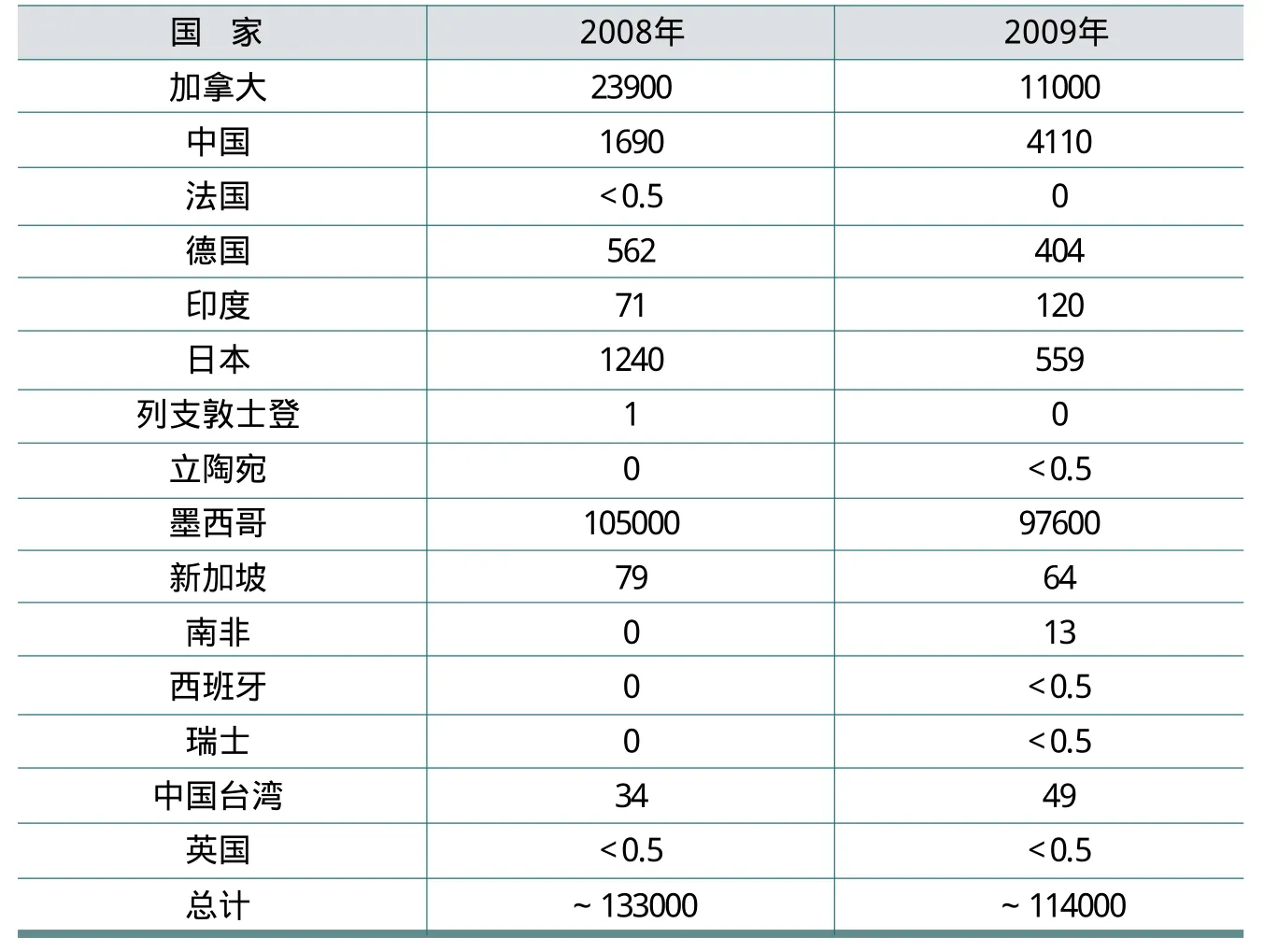
表2 2008年和2009年美国氢氟酸进口量(公吨)按国家分布情况
其他用途包括玻璃蚀刻或加工(石英提纯),除莠剂,除去金属表面氧化物和稀有金属提纯(采矿和钻井作业),半导体和电子行业[32,33],荧光灯泡和清洗液。后一种是汽车清洗的主要部分,也是本文要论述的主题[29]。
在工业领域,氢氟酸的主要用途是去除金属氧化物,其他用途包括家庭除锈和除污渍以及汽车清洗[3]。汽车清洗是应用化学产品最集中的领域。在日常汽车清洗中,一般仍继续采用氢氟酸,因为氢氟酸具有相对低廉的成本,尤其是大量购买时,成本更低(洗车操作的标准程序是将10%~12%氢氟酸溶液和其他成分加入到55加仑水中进行稀释)。平均而言,采用氢氟酸清洗剂成本比采用其他清洁剂便宜5美元,或者以清洗剂的体积计则浓度为8%的氢氟酸溶液比其他清洁剂每加仑便宜3美元至5美元[34]。生产商建议氢氟酸与水的稀释比例为1∶30,但是这个比例通常根据温度、水质和需要的配方强度而改变。
除了作为汽车清洗剂有效成分外,氢氟酸还可以与其他无机酸配合用作金属溶解液,在环境样品的微量元素分析之前进行常规的酸消解程序[35]。固体样品和那些通常积累于汽车上的颗粒物质具有相似的属性或化学成分。对下水道污泥样品的研究显示[36],可以使用氢氟酸、硝酸、高氯酸和王水配成金属溶解液测定镉、铬、铜、铁、镍、铅和锌的浓度。另一研究显示[37]可以使用硝酸和硫酸混合液,冷蒸气原子吸收光谱法测定白星眼的汞浓度;也可以采用硝酸和氢氟酸混合液,采用电感耦合等离子体质谱法测定汞浓度。将微波消解系统应用于环境样品测定时,在消解过程中使用氢氟酸[38]可以使灰尘样本安全而迅速的消解。使用硝酸或王水消解灰尘样品,析出的铅和镉超过80%。使用氢氟酸-硝酸混合液,析出的铅和镉超过90%。氢氟酸也可被用于消解含有放射性元素的地质样品。在样品被氢氟酸解析后,氢氟酸被铂元素组洗脱[39]。这是由于铂可以与部分氢氟酸形成稳定的络合物,而氟络合物在阳离子交换树脂上的分布系数接近零。
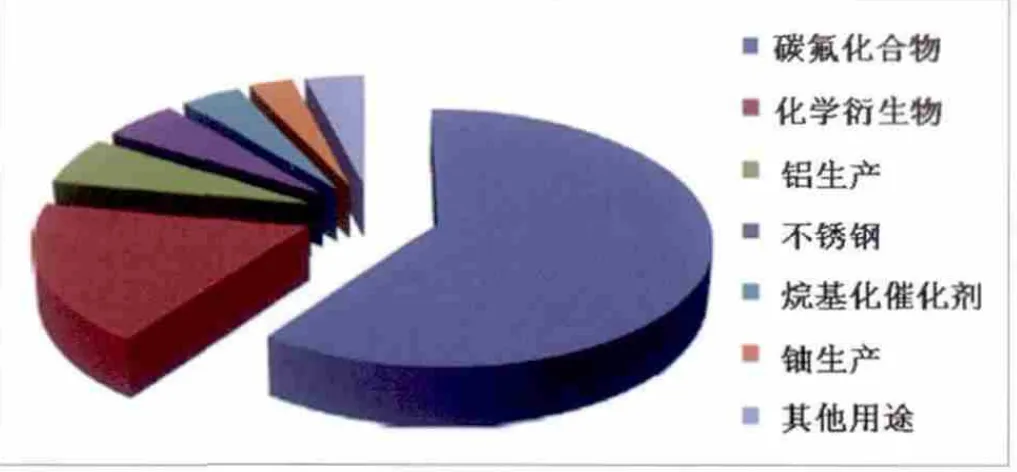
图1 氢氟化合物的主要用途
通过使用氢氟酸也可以改进碳质颗粒提取方法[40]。在对生物固体和土壤样品进行化学分析时,需要将样品分离为无机和有机组分[41]。氢氟酸被用于除去矿物成分和隔离生物固体和土壤有机质。氢氟酸能够减轻生物固体质量的56~82%和土壤质量的93~95%。在大多数情况下,生物固体(85~103%)和土壤样品(67~74%)被氢氟酸处理后,大部分的碳被析出。
氢氟酸也可以用于交通污染的评估[42],研究发现加上氢氟酸后,可以更有效地从标准玻璃中检测出锑。通过标准方法监测重金属总沉积量,证实了锑在道路两旁的富集。分别采用浓度为70%的硝酸和浓度为40%的氢氟酸解析玻璃,对比分析交通繁忙地段、车背面和车流量小的地段、未洗和洗过的玻璃样品,发现氢氟酸解析的玻璃中锑含量增加了一倍。
前人的研究表明氢氟酸可以溶解铜和钨,同时具有选择性的钛蚀刻能力[43]。氢氟酸和硅前驱体复配可以保护二氧化硅。氢氟酸清洗液中若存在过氧化氢会导致铜的溶解率受到抑制。这种现象是由于界面氧化铜形成造成的,氧化铜在氢氟酸中的溶解速度较慢。反应动力学研究确定氢氟酸和氧气浓度符合一阶动力学。氢氟酸可以选择性剥离钛膜,移除等离子体刻蚀聚合物或残留物,同时抑制一些物质的蚀刻速率,如钨、铜、二氧化硅、碳化硅、Si3N2和掺杂二氧化硅的碳。
由于氢氟酸具有溶解铁氧化物和硅基污染物的能力,可以将其用于产生高压蒸汽的预调试锅炉[44]。氢氟酸可以溶解一些氧化物如五氧化二钽和三氧化二钽,也应用于溶解粉末状岩石样品。类似用途如氢氟酸被用来从硅酸盐岩中提取有机化石[45]。含化石岩可直接浸入到酸中,或应用硝酸纤维素膜(溶于乙酸戊酯),硝酸纤维素膜依附于有机成分,并能溶解岩石。稀氢氟酸(1~3%w/w)与有机酸或盐酸组合应用于石油工业,刺激岩层增产石油和天然气[46]。
5. 氢氟酸的化学性质
为了更好地认识氢氟酸如何应用于汽车清洗行业(即除去制动和道路的污垢和灰尘)并寻找可能的替代品,需要全面了解其物理化学性质。表3总结了浓度为70%的氢氟酸的一些重要物理性质[47-50]。
稀氢氟酸具有弱酸性,在水溶液中电离(方程2),在其他常见的酸溶液中也电离[22]。
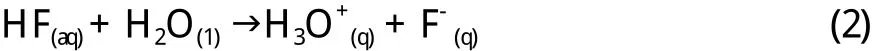
在氢卤酸中,只有氢氟酸不被认为是一种强酸,因为它并没有在水溶液中完全解离并能形成二聚体(二聚体可能会失去一个质子)。氢氟酸分解可形成高浓度的氟化氢阴离子(氢氟酸HF2-稳定,因为存在稳定的H-F键),如公式(3)所示[22]。当氢氟酸的浓度接近100%,它的酸度急剧增加。

在温度为298K的稀水溶液中氢氟酸的酸离解常数为6.7×104(pKa=3.17)[51],在0.1M氢氟酸溶液中对应约8%解离。在沸点为385 K的共沸物中,38%(W/W)为氢氟酸和62%(W/W)为水。已知氟化氢的水合物,如4HF·H2O(熔点261.6K),2HF·H2O(熔点197.5K)和HF·H2O(熔点237.5K),可以和0.1M氢氟酸溶液隔离[52]。然而,稀氢氟酸溶液具有几个独特的物理性质,例如,游离比低(小于盐酸游离比);其离子解离平衡常数比其他氢化物(盐酸、溴化氢及碘化氢)稀水溶液的离子解离平衡常数小10~13个数量级[53]。
氢氟酸表现为弱酸性的确切原因一直存有争议[54-56]。理论研究可以为基本化学事件提供详细的结构和动力学描述[57]。最近的研究结果不支持先前的假设,即氟化氢溶解在水中形成一个非常稳定的F-·H3O+接触式离子对复合物,而不像氢卤酸系列中其他氢化物通过离子解离产生的自由离子[52]。人们认为在水中稀氢氟酸不完全离解的部分原因是打破相互作用强烈的H-F键需要大量能量。氢氟酸在水中离解从热力学角度考虑是因为该离解反应熵很低[52]。氟化氢离子解离自由能远远大于氢化物系列其他成员的离子解离自由能(温度为298K时,氢氟酸、盐酸、氢溴酸和碘化氢的TrS0r分别是-31、-17、-10和-2kJ/mol)。氟化氢离子解离自由能对反应平衡影响很大[52],这主要是因为水中F-水合物的结构组成特性导致了大而强烈的水化熵[52]。
氢氟酸的酸度随着其浓度增加而增加[22,57],并且在H2O中的增长幅度比在D2O中的增长幅度要大(温度为298K时,Ka(H2O)/Ka(D2O)在=2)[58]。令人惊讶的是,在非常低的温度下(40K),在无定形固态水中氢氟酸可以大范围离子解离[52]。因此,在冰中氢氟酸变成相对强烈的酸,而非是具有较小解离常数值的弱酸,这可能是由于减少了对自由能的熵贡献。这些研究结果与实验结果一致,即引入有外形缺陷并掺杂氟化氢的冰可以提高冰的导电性。在冰中氢氟酸的解离常数与其在水中的解离常数是非常相似的[59]。
氟化氢腐蚀玻璃的原理是氟化氢与二氧化硅反应形成氟化硅。反应方程式如(4)和(5)所示[60]。
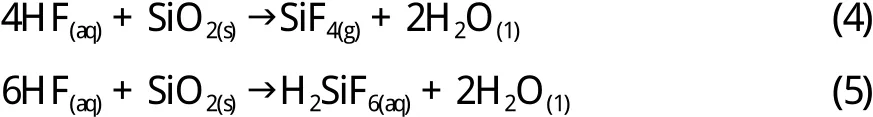
之前的研究已发现,氢氟酸分子吸附在硅晶格中,这将削弱玻璃中的Si-O键并随后溶解。在低pH值范围内,刻蚀速率与HF2-的浓度具有线性关系[61]。因此,配合使用更强的酸如盐酸、硝酸和硫酸或使氟化铵溶解在氢氟酸溶液中,可以提高大面积表面蚀刻能力。因为在溶解过程中形成的H3O+或NH4+具有催化剂作用[32,60],因此该方法受到广泛关注。
氢氟酸与金属氧化物的一些化学反应方程式如(6)~(9)所示[22,62]。
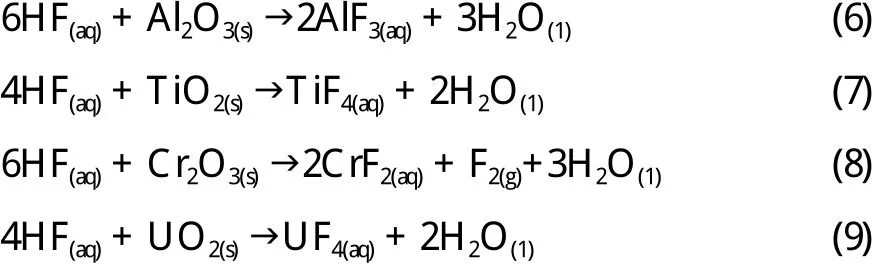
另外,氢氟酸与铝和钛的化学反应方程式分别如(10)和(11)所示[63]:

6. 材料选择和储存准则,洗车产品配方
使用氢氟酸的一个显著缺点是它不能用石英或玻璃容器储存。虽然可以控制高硅铸铁、粗陶和玻璃与氢氟酸的化学反应,但它们仍会受到氢氟酸的强烈腐蚀[64]。使用塑料容器存储氢氟酸是解决方法之一。如聚乙烯、聚丙烯、聚偏二氟乙烯和碳填充的酚醛树脂能储存的氢氟酸的最高浓度约至70%[64]。当氢氟酸的浓度限制在50%~70%时,聚氯乙烯、合成橡胶(橡胶)和铅表现出良好的耐氢氟酸性质。氢氟酸浓度大于5%时,镁和及其合金能抵抗氢氟酸腐蚀,因为其与氢氟酸反应时,在镁和镁合金表面形成不溶的氟化镁膜,致使其表面钝化[64,65]。在环境温度下,纯碳钢比低合金钢具有更高的耐蚀性(64~100%的氢氟酸)。今天用于装氢氟酸的最好容器主要由镍和铜组成的合金[66]。在任何浓度和温度分别高达约393K和338K的情况下,Ni-31.5Cu-1.2Fe和70Cu-30Ni合金都具有优异的耐氢氟酸性能[64]。然而,氧化熔盐具有增加腐蚀这些合金的倾向且铜-镍合金一般比不锈钢成本更高。在环境温度下,氢氟酸浓度低于60%时,铅具有相当好的耐氢氟酸性能。贵金属如银、金、铂不会受到氢氟酸腐蚀,但是他们的价格比Cu-Ni合金更贵。
氢氟酸应储存在阴凉、干燥、通风和无光照区域。储存区需要有一个彩色栏杆或障碍物高到足以包含泄露区域,以及为那些与氢氟酸接触的人提供高流速清洗区。储存区的楼层建议是耐酸和非多孔性。装氢氟酸溶液的容器不能保存氢氟酸超过3个月,而且必须定期检查是否泄漏。
市场销售的洗车产品配方大致可分为三大组:除垢剂配方,碱性清洁剂和酸性清洁剂[67]。已经商业化的洗涤剂虽然已经被人们使用,但不是所有的产品都能有效除垢。汽车仍然需要物理洗涤除去附在车轮表面的颗粒物。碱性清洁剂包括除垢剂、水溶性有机溶剂如乙二醇醚以及碱性材料如氢氧化钠,氢氧化钾和/或碱性硅酸盐和磷酸盐[67]。碱性清洗剂能有效去除部分车轮尘土。硬表面清洁剂的高碱性性质会损坏橡胶、玻璃和油漆过的铝表面[68],因此必需彻底冲洗,否则,碱性清洁剂往往会留下不溶性残渣。酸性清洁剂组成成分包括强酸(盐酸和硫酸)、弱有机酸(氢氟酸、磷酸、草酸、HC2H3O2、乙醇酸或柠檬酸)。酸性清洁剂已经开发并商业化。含有氢氟酸的酸性清洁剂能有效去除污垢和道路尘土。事实上,基于氢氟酸的酸清洁剂通常被用作车轮增亮剂和预先浸泡溶液。酸性清洁剂的缺点是高度腐蚀性和危险性。因为清洗汽车需要很强的化学清洁剂,因此大多数汽车清洗液中含有氢氟酸[69]。然而,如果没有彻底冲洗干净,氢氟酸可能腐蚀汽车的防护蜡涂层和油漆。浓缩氢氟酸透过涂层接触金属车轮,并与金属车轮发生反应,可能会导致车轮过早氧化,成为有凹痕的和迟钝的铬车轮。
7. 刹车片/衬片的成分和性能以及聚积在汽车上的颗粒物质
为了更好地理解氢氟酸是如何清除制动片和道路积尘,确定积尘组成颗粒的化学组分和性质也是很重要的。颗粒物的主要来源有三个:制动盘和制动片的磨损、轮胎磨损和路面磨损[70]。后两者造成的颗粒物在洗车之前存在于汽车的外部。使用肥皂和水或多用途清洁剂就能轻易将汽车上的普通污垢清洗掉,而汽车上的其他不同类型的颗粒物质必须使用酸或强劲的除垢器进行清洁,如制动垫,制动衬片和制动转子上的颗粒物等。清洗过程中的最大困难是除去制动盘和制动片磨损产生的尘土。大多数汽车的制动片主要是由铁元素组成。在汽车行业,目前正在使用的三种主要类型的制动器衬片总结如表4所示[71]。
使用传统汽车清洁产品不能轻易去除沉积在制动系统的颗粒物,这时氢氟酸就能起到作用了。由于制动器尘埃粒子的尺寸小(通常<2.5毫米),用稀氢氟酸溶液除去这些颗粒,将不会导致制动器表面钝化[64]。
刹车片组分已经从聚合物发展到半金属,半金属组分一般是指在组成中存在铁和钢[72]。半金属刹车片由石墨、铁或铜细粉末、少量的无机填料和摩擦改进剂组成[72]。这有助于汽车快速停住,并能延长焊垫的寿命。刹车片组分和粘合剂系统也有其他有机化合物,有机配方一般包含聚合物如Kevlar、树脂,有时含有石棉纤维[73]。然而,为安全起见制造商普遍转向生产无石棉有机物配方。有机和半金属材料可能含有铜,而使用量的多少取决于制造商[74]。电极片的刨花碎屑和车轮上的小制动位转子,这两者均会导致污垢沉积并黏附于刹车系统内和重新黏在车轮上。陶瓷刹车片周围的金属部件发生的腐蚀较少,因为它们的金属含量相对较低。氢氟酸基本上是腐蚀表面和溶解表面上的微粒物质。车轮上的颗粒物越多,这种颗粒嵌入到车轮的深度则更深,清除这些颗粒则变得更加困难。使用水、压缩空气和普通清洁剂不能将累积的刹车粉尘完全除去。氢氟酸能极其有效地溶解一些金属,溶解刹车系统尘埃并能消除胶黏剂的黏性。因此,氢氟酸的有效性远远优于任何其他普通清洁剂。
从环保角度来看,石棉作为刹车片组分将是一个严峻的问题[75]。在1986年,美国环保局禁止刹车片组分中使用石棉。美国环保局规定,从1993年9月开始新的交通车辆不能使用石棉刹车片[76]。造成的结果是现在所有类型的制动器衬片均包括五大组件:纤维(提供机械强度)、磨料(增加摩擦和保持接触面清洁)、润滑剂(稳定摩擦性能)、填料(提高可制造性并降低成本)和黏合剂(保持结构完整性和热稳定性)[77]。表5总结了每个组件普遍使用的材料[77]。
目前对制动衬片材料和产生的颗粒物质的物理性质和化学组成的了解还很不全面。目前正在使用的汽车的制动衬片材料的复杂性和数量,以及影响制动器磨损的多种因素,阻碍了对制动衬片材料和颗粒物质物理性质的全面调查。迄今对制动器粉尘的化学分析研究实际上是有限的。目前缺乏对制动器磨损碎片特性的深入研究[76],刹车材料的确切组分很少完全公开[70]。在文献中找到的所有研究全部侧重于刹车粉尘的化学组分的元素分析,而不是制动刹车材料的实际化学组分的识别。使用的分析方法中首选电感耦合等离子体质谱和X-射线,然而这两者都只提供样品组分信息。例如,通过对一些样品进行分析可得到以下结论:
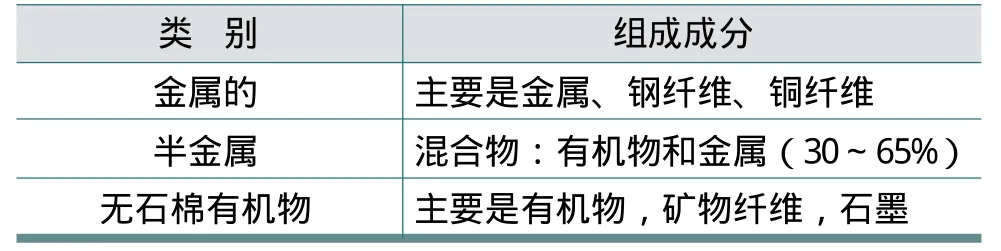
表4 制动衬片的类型
轮胎灰尘是一个严重的污染物,特别是成为了城市环境中锌的来源[78]。
刹车灰尘是一种严重的污染物,已被确认其含气溶胶组分中的铜、锑和钡,它提供的铜占城市径流总量的47%[78]。
道路/轮胎是铝、硅、钾、钙、钛、锰、铁、锌、锶的来源[79]。
刹车片是铬、铁、铜、锌、锆、钼、锡、锑、钡和铅的来源[79]。
交通系统是钡、铜、铬、钼、铅、锑、锌的主要来源[80]。
黄色道路标线是繁忙道路尘土中铬和铅的来源,并且黄色道路标线所用的材料的一个主要组分是铁,不锈钢是道路灰尘和渗水泥沙中铬的另一个来源[81]。

表5 刹车衬片的典型组分
汽车和卡车积累的交通尘土和灰尘的组分是“砂、粘土、钙、镁、铁盐类、黑碳、排放的烟尘和轮胎的橡胶微粒[68]。
分析的粒径尺寸范围是0.35~2.5mm[76,82]。这些小颗粒尺寸使它们特别易受氢氟酸的腐蚀。Thorpe、Harrison和von Uexkull等人提供了三个刹车尘埃样本的元素含量,如图2所示[70,83]。资料表明元素组分很大部分取决于所使用的刹车垫类型。
高浓度锑是潜在的人类致癌物,在以前的研究中,刹车片和灰尘中的锑含量已经量化[84,85]。最近的一项研究表明,在制动过程中SbS3已经被氧化成SbO3[83]。在刹车过程中发生的刹车灰尘颗粒氧化现象,意味这些组成元素的大多数化合物是金属或半金属氧化物,如图2所示。这个假设成立的依据是氢氟酸能非常有效地分解刹车粉尘,而且比其他更强的酸分解效果好。
对世界上五个主要城市街道尘土样品的分析结果显示:样品组分含有26种金属元素。五个主要城市分别是伦敦(英国)、纽约(美国)、哈利法克斯(加拿大)、基督城(新西兰)和金斯敦(牙买加)[86]。这些金属被分为两组:来源主要是土壤的金属元素(铝、钾、钠、钍、铈、镧、钐和钛)和其他来源的金属元素(钙、镉、铅、铬、锌、铜和黄金),如水泥、轮胎磨损、汽车尾气排放和盐。伦敦和纽约的样品中第一组金属元素浓度比其他城市的低,而第二组金属浓度比其他城市的高。大多数金属的浓度随着灰尘颗粒尺寸的减小而增加。另一项研究是针对科隆(德国)环境空气样品,Weckwerth发现气溶胶组分含有锌、钼、铜、铂和锑,这些元素是从汽车各部分排放出来的[87]。
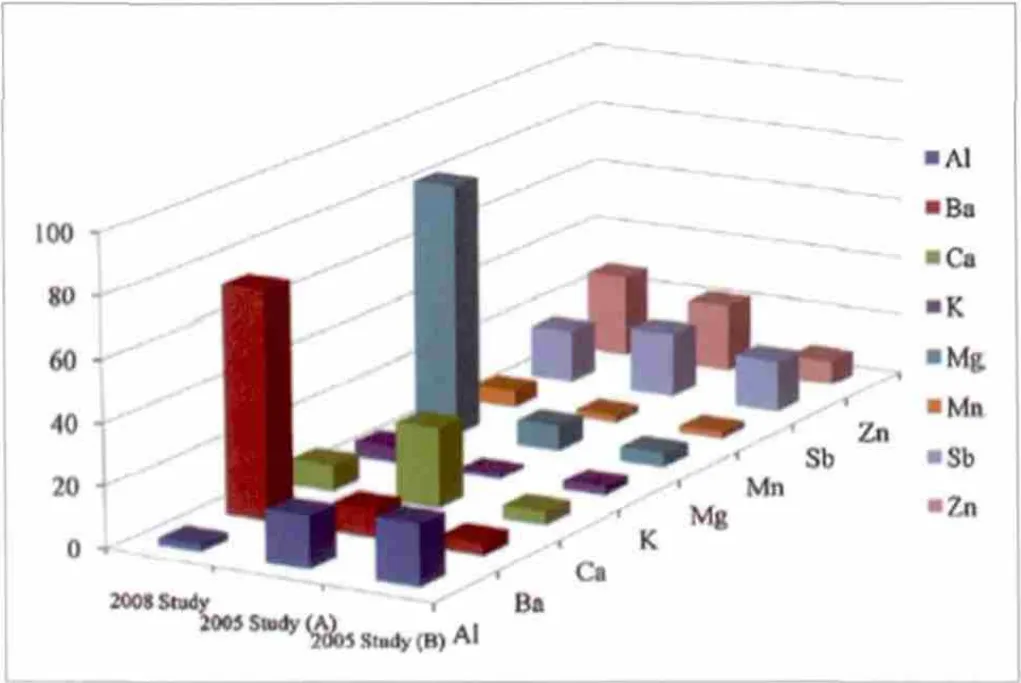
图2 2005年和2008年的各种刹车灰尘的元素浓度(g/Kg)研究结果
从城市卡瓦拉(希腊)的三个不同地方(城市、工业和周边)共收集了96个街道灰尘样品和96个路边土壤样品,用来分析样品中铅、铜、锌、镍、铬、镉和汞的含量[88]。结果表明,城市和工业区的粉尘和土壤样品包含的金属元素含量较高。街道灰尘组分分布模式和路边土壤的组分分布模式基本相同。结果进一步表明,城市和工业街道灰尘样本含有高浓度的铅、铜、锌、砷、镉和汞,其主要来源是当地交通和附近的磷酸化肥和石化工厂。
8. 氢氟酸对人类的影响及公布的相关法规
人们研究了氢氟酸对人类的不利影响,氢氟酸的强腐蚀性和化学性质是主要议题。由于氢氟酸具有低解离常数,它比其他典型的无机酸能更快穿透皮肤组织[90]。因此,通过接触皮肤或眼睛,或吸入或吞入时,都容易发生中毒[91]。吸入氢氟酸蒸汽(气味阈值是0.042mg/L),可引起溃疡性气管,出血性肺水肿,低钙血症(缺乏足够的钙),低镁血症(缺乏足够的镁)[91,92]。最低致死限度是暴露预估浓度为50~250mg/L的氢氟酸5分钟[93]。暴露在氢氟酸气氛中时,氢氟酸浓度较低时,这种症状可能不会立即显现出来,因为它是逐渐干扰神经系统功能的。延误治疗会进一步增加氢氟酸对人体的损伤程度和事故的严重性[94]。
目前仍然不确定氢氟酸的哪种离子类型(F-,H2F+,或对人类是最危险的。因为人类缺乏深入研究F-,H2F+,和的毒性对比。这可能是由于研究氢氟酸化学性质困难较大。然而,H+和F-组合在人体中的损伤作用是有据可查的。例如,氢氟酸造成组织损伤是通过两种不同的机理[95]。面对高浓度氢氟酸(高H+浓度)将导致腐蚀性灼伤类似于强酸造成的灼伤。其次,F-具有亲脂性,能穿透表皮的最外层并深入到内部组织[95]导致组织坏死,具有细菌或真菌感染的特征(液化性坏死)[96,97]。H+和F-分离,然后H+附着在平衡pH值的酶上,pH值能够保持组织稳定[94]。H+损坏人体细胞外表面,而F-损坏内部细胞。氟离子与人体重要的和结合(方程式(12)和(13)),用它们的方式破坏细胞膜和神经直至人骨[94,97,98]。由于神经受损,肢体麻木,致使氢氟酸在全身扩散的几小时内,伤者浑然不知。
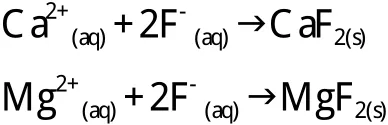
氟离子很容易穿透皮肤,引起深部组织损伤,并使骨头脱钙[94,99]。F-和Ca2+在人体内发生反应是主要中毒效应之一,并为许多治疗建议提供了基础[93]。然而,F-也可以与其他离子如K+和Na+发生反应。除非F-被盐中的Ca2+和Mg2+中和,否则必然造成组织细胞坏死。中和可以通过局部或静脉内注入含有Ca2+和Mg2+的化合物(通常是丙酸盐)。血液透析治疗是治疗严重的全身氟中毒的有效方法[100]。
氟离子渗透,包括与Ca2+和Mg2+反应,都会形成导致低钙血症或低镁血症的条件[101]。如果不逆转低钙血症或低镁血症的病情,最终将会导致神经衰竭和细胞膜萎陷,并最终导致死亡[102]。已经报道过氢氟酸中毒导致了危害生命的心律失常和严重的多器官功能不全[91]。
氢氟酸的浓度决定灼伤的严重程度[103]。同样重要的是暴露区域性质和暴露持续时间[104]。当氢氟酸浓度>50%时,立即被灼伤,并伴随出现变色迹象的快速损伤,通常产生水泡[105],并伴随着剧烈疼痛。当氢氟酸浓度在20%~50%范围时,可最多延迟8小时后产生反应,而浓度<20%后,大约可延迟24小时后产生反应[106]。稀释氢氟酸溶液,浓度<3%时,大多需要较长的时间(大于24小时)才能感觉到中毒反应。在专业洗车场,稀氢氟酸溶液通常用于清洁剂或洗车溶液。
皮肤灼伤面积>160cm2有可能严重干扰血液和组织中Ca2+含量,造成全身氟中毒[26]。葡萄糖酸钙中的Ca2+可以吸收多余的F-,因此氢氟酸灼伤治疗方法可以采用水洗和涂抹2.5%葡萄糖酸钙凝胶治疗或特殊漂洗配方[26,107]。如果皮肤暴露,建议采用10%葡萄糖酸钙和50%的二甲基亚砜,有利于皮肤快速吸收[108]。如果这些外用治疗不够[109],则必须去医院治疗。
职业安全与健康管理局(OSHA)制定了《直接危害生命和健康的氢氟酸暴露限制》,限制氢氟酸浓度小于30mg/L(美国劳工部(OSHA),1997)。OSHA要求医疗监控这些工作内容和氢氟酸紧密接触的工作人员。给工人安排一项工作之前,需要对他们的皮肤、眼、肝、肾和呼吸系统进行检查。在工作期间,健康访谈和体检必须定期完成。当工人换岗或离职,必须进行另一项体检(尿检),以便确定工作条件对身体产生的任何影响。国家职业安全与健康研究所(NIOSH)还公布浓度等级为30mg/L的氢氟酸对生命有直接危险(IDL)[110]。美国工业卫生协会已发表紧急应变规划,规定最大氢氟酸浓度为50mg/L,小于这个浓度时几乎所有人能够在暴露氢氟酸的环境中待1小时,而没有产生任何感受或危害生命和健康的影响。最近又规定最大氢氟酸浓度为20mg/L,小于这个浓度时几乎所有人能够在暴露氢氟酸的环境中待1小时,而不会产生不可逆转的危害健康的症状或者不会损伤自身保护系统。
尽管大多数行业规定了最小量的人员接触氢氟酸,但是一些货运业的工人不知道氢氟酸的危害和限制使用的法规,依然在洗车溶液中采用氢氟酸。有公司在轮胎清理中经常使用的一种混合方法是使氢氟酸与无机酸结合,从而形成了一个超强混合溶液[112,113]。该混合溶液的酸强度比任何酸自身的酸强度高12倍。已报道过关于洗车工人因接触含有氢氟酸的洗车液而患病的事故。仅举几例,例如,某些洗车工人的脚沾上了溢出的含有浓度为2%的氢氟酸的清洗液,而该工人稍后才感觉出来,但是细胞组织已经严重灼伤了[114]。另一个洗车工人,由于戴了被氢氟酸污染后的手套,导致他的手指被截肢[114]。
由于基于氢氟酸的清洗液一般比安全肥皂替代品更便宜,然而适合于处理氢氟酸的个人防护设备的成本已经超过了节约的金钱。根据NIOSH和疾病控制中心,眼睛或眼睑接触到氢氟酸可能会导致永久性失明。OSHA建议在接触任何浓度的氢氟酸时,使用护目镜与安全面罩和呼吸器。化工活性炭呼吸器、防毒面具或能提供空气呼吸器并具有一个完整面具、头盔或戴头罩的任何设备,都被批准用于处理氢氟酸。防溅实验室外套、手套、套筒盖和靴子应采用防酸氯丁橡胶或聚乙烯材料。氢氟酸浓度大于30%的溶液,穿透氯丁橡胶和聚乙烯需要1~4小时[115]。
总之,定期教育项目和安全培训必须实行,使得所有工人能掌握关于氢氟酸的危险性的知识[116]。虽然国际洗车协会致力于通知专业洗车协会和公众关于在工业中使用化学试剂的相关安全问题,但是它对于任何特殊化学产品的使用情况不表态,也不对任何特殊化学产品的使用情况进行监控。
9. 洗车水源和废水对环境的影响及相关法规
来源于溪流、河流和水道的水资源日益受到公众的卫生关注,这导致产生了一些保护饮用水和流域的环境法规。洗车场的工作环境需要变得更环保和安全。洗车行业主要考虑的影响环境的因素是使用的水和能源资源[117],因为这将直接或间接污染土壤,地下水和地表沉积物和水资源[118-120]。每次全方位清洗一辆小型汽车需要170L淡水,随后产生的废水中含有高污染物负荷(平均浓度1100毫克/升油脂,4500毫克/升化学需氧量和3500mg/L的总悬浮固体)[121]。清洗液排放到雨水渠道或河道网络造成地表水污染。水和污染物未经过处理便进入雨水渠道、溪流和湖泊[122,123]。通过地表径流,汽车废水也可能污染土壤和地下水。
洗车水污染物的来源包括交通污染物、汽车本身的材料和使用的清洗液中的化学试剂[124]。因此,洗车废水复杂,因为它含有很多污染物,包括氢氟酸、氟化氢铵(NH4HF2)、清洁剂/表面活性剂、油和油脂、挥发性有机物和硫化合物、多环芳烃、磷、氮化合物、氯化溶剂、油漆残留物、增塑剂、橡胶、防锈剂、邻苯二甲酸盐、磷酸盐、柴油机尾气颗粒物、道路污垢和刹车片的重金属[125-127]。如果未经处理就将废水排出或进入城市污水处理厂,将对生态环境十分不利[128]。氢氟酸、氟化氢铵和油性溶液对人体、植物和动物有害。环境中存在过量的氟盐也是一个严重的问题[129]。专业洗车会产生这些污染物,在将它们排放到卫生系统中,需要先对它们进行处理。但是,洗车站对废水进行预处理后,未必能使废水达到排放到雨水系统中的质量标准[130]。
洗车清洗溶液中使用的氢氟酸与从洗车废水中发现的金属离子有关联。在美国的菲尼克斯、佛罗里达州和波士顿,对从洗车自助服务、洗车场洗车,洗车机器操作中获得的废水样品进行了水质测试[122]。对经常从涂料、橡胶制品、汽车的制动衬块中发现的金属进行量化。在所有的测试中都发现了锡、砷、镉、铬、铜、铅、银、镍和锌,但是只在程序数量限制的测试中发现汞、硒、铊。
一些欧洲国家纷纷出台减少用水量和洗车废水回收利用的法规。例如,在荷兰和斯堪的纳维亚规定每辆汽车每次清洗时的最大耗水量是60~70L;在德国和奥地利强制实行废水回收比例大于80%;目前比利时的15%的洗车场对废水重复利用比例达55%[117]。
经营车队运输的公司始终面临国家和联邦环境预防条例中的环境问题。美国环保局建立运输设备及车辆清洗法规,并发布了用于进行公共处理工程的新能源和已存在能源的预处理标准。例如,资源保护和回收法(RCRA)在资源回收、处理和处置方法上提供了建议,以便在清洗车辆后,最大限度地减少氢氟酸的浪费。RCRA建议安装一个封闭清洗和漂洗系统,用于回收废水,同时降低用水量。此系统还可以防止残留物堆积而产生有害废水。建议重复使用废水,并将废水用于第一轮冲洗汽车。同时也建议在根据水净化处置条例的规定对氢氟酸污染物进行进一步的处理前,使用废旧碱性溶液中和氢氟酸污染物。此外,洗车场需要获得水净化处置条例的授权,才能将废水排放到当地下水道或油分离器系统。
10. 氢氟酸替代品
清洗汽车是一个费力而耗时的工作,因此产生了对氢氟酸的需求,氢氟酸是目前市场上销售的最有效的酸性清洁成分。由于储存、使用和暴露氢氟酸都会产生相应的危害,因此目前正努力开发新的氢氟酸替代品。一个取代氢氟酸的理想化学物质应该具有以下特征:有效而且不需要进一步清理;在不需要升温的条件下,能快速与污垢发生反应;能将表面清洗干净而不会产生污点、蚀刻或雾霾,不会剥离涂料或残留不溶性物质。
许多洗涤剂公司提供了关于在洗车过程中如何使用他们的含有氢氟酸的产品的建议。“两步自动驾驶通过工艺”可以被采纳。这个过程首先应用氢氟酸基清洗溶液冲击表面,并松动尘垢、油脂和油,然后添加碱性溶液来平衡酸度,之后才开始腐蚀表面。一个肥皂公司指出人工使用酸时,采用碱性洗涤剂和氢氟酸。另一种氢氟酸替代清洗方法建议从底部表面开始清洗,以防止冲洗时产生腐蚀性条纹。
下面是关于洗车清洗液中的氢氟酸替代品的化学物质和具体使用方法。
改进的清洗方法:除了使用机械法还将使用更多传统除垢剂,无论是对车轮进行水喷射还是物理刷涂以便除去刹车粉尘,这些方法在欧洲都是常见的。一个例子是先将温和的预洗溶液喷到车轮,然后将高压水流喷到车轮,再进一步用旋转刷子进行清洗。虽然洗车系统的机械设计可提高不太强效的清洁剂的效果,但这个方法不能取代氢氟酸。
处理前的水质:另一种可能的氢氟酸替代方法是清洗汽车之前,通过预处理洗车用水而改进洗车过程的一种方法。预处理包括进行初始漂洗时,增加水或清洗溶液的温度,或改变其属性以便提高洗涤效率和化学反应速度。
聚合物提升:S&S汽车服务公司推出可将车轮的污垢提升而非将其融解掉的清洁产品[131]。一个想法是将喷雾聚合物溶液和车轮上的刹车灰尘结合,然后剥落,这是解决洗车和用水问题的一种潜在的新的解决方案。同样,从事洗车行业的Keenwash公司最近在中东缺水的国家推出了一款几乎无毒、可生物降解的便宜喷雾式洗车液[4]。这些产品都将在人工洗车市场运用良好,但可能在自动化洗车领域是不符合实际的。
氟化氢铵:氟化氢铵代替氢氟酸,氟化氢铵和硫酸加入到酸性的表面清洁剂/表面活性剂和水中[132]。氟化氢铵已被吹捧为一种比某些应用于汽车清洁领域的添加剂或化学试剂更安全的氢氟酸替代品,这是一个危险的误解,因为氟化氢铵基本上溶解于水时就离解成了氢氟酸。因此,不建议考虑将氟化氢铵当作氢氟酸的替代品。
应用于洗车行业的氢氟酸替代品的最新进展大多是在专利文献中找到的。位于圣保罗,明尼苏达州的Ecolab公司有一个新近的关于洗车溶液的美国专利。该专利指出Ecolab公司在洗车溶液中使用了比氢氟酸腐蚀性小的材料[133]。汽车清洗液由阴离子表面活性剂、聚(氧亚烷基)铵表面活性剂和碱性剂组成。位于威斯康星州迪皮尔的清洁系统公司生产了汽车清洁产品Lustra®系列。在2009年这家公司获得一项美国专利。该专利提出金属光亮剂和表面清洁剂可安全地用于其他一些表面,如油漆表面、玻璃、橡胶和塑料[134]。该清洁产品是由碱金属氢氧化物、羧酸、有机酸的碱金属盐和各种表面活性剂组成。该公司描述碱金属氢氧化物为氢氧化钠或氢氧化钾,碱金属盐是葡萄糖酸钠和多羧酸如乙二胺四乙酸或丙二胺四乙酸。得克萨斯州休斯敦的壳牌石油公司持有一项关于水溶液清洁汽车轮胎的专利。该清洗液由亚烷基二醇、二烷基磺基琥珀酸盐、乙醇胺和一种乙氧基磷酸酯表面活性剂[135]。肯塔基州科温顿的亚什兰公司申请了多项专利,这些专利是关于一种“非接触式”车轮和轮胎清洁剂的。该清洁剂将乙烯基吡咯烷酮,乙烯基咪唑,乙烯基吡啶聚合物作为螯合剂[136],同时结合了一些酸,如氢氟酸、盐酸、硫酸、硝酸、草酸、乙酸、一羟基乙酸和柠檬酸等。宾夕法尼亚州普利茅斯的汉高公司申请了一个美国专利。该专利是关于清洁铁路车辆的清洁剂,该清洁剂包含不是来自于氟化氢的HF2-离子[137]。该专利称此清洁剂不能蚀刻玻璃,但可以用于未上漆金属表面的清洁,如不锈钢和铝。

目前已有一些用于金属表面和工业机械的其他清洁产品配方,并申请了专利。然而,这些清洁产品通常要在高温条件下使用,并常常通过刻蚀表面来完成清洗任务。例如,氟化铵被用作清洁剂组分。该配方用于除去铝金属表面的残留物[138]。为了保证效果,需要将使用温度升高(322K)。美国专利4346128介绍了镀铝铝基板容器[139]的清洗,即将衬底浸在低pH值的含氟化物及其盐的稀酸液槽,以便除去表面的污染物如重金属氧化物和硅衬底。然而,这种清洗过程将导致部分铝衬底被蚀刻。美国专利号4614607介绍了一种包含硝酸、硫酸、氟化氢铵水溶液的脱氧剂凝胶,并且煅制二氧化硅即用不变的蚀刻速率蚀刻铝[140]。该清洁剂能有效除去氧化物、水垢、腐蚀并除去铝合金表面进行阳极氧化处理前的残余物质。美国专利第5733377号详细介绍了有机化合物清洁剂(洗涤剂/有机溶剂)。该方法可以乳化土壤和油脂,并采用一种能迅速矿化金属或金属氧化物的材料取代氢氟酸,该金属和金属氧化物包括钙氟磷酸钠和氟硅酸[141]。同时,美国专利第5932023介绍了一种包含酸性溶液和氟溶液的清洁剂的配方[142]。美国专利第6982241也描述了一种配方,该配方包含一种解离常数≦2.5的酸、磷酸和一种氧化剂[143]。
11. 结论
制动片和制动盘的磨损、轮胎磨损、道路表面的磨损、土壤和城市污染是颗粒物的主要来源,它们积累在汽车上是无法避免的。为了清洗汽车的污垢,洗车行业中应用氢氟酸的基本思路已经明确。氢氟酸的物理化学属性和腐蚀性质已经被反复讨论。氢氟酸能有效地清理汽车表面的刹车灰尘和道路尘垢是和氢氟酸的独特性质相关的,颗粒物质的组分很容易被氢氟酸分解。文中提供的信息表明将氢氟酸作为清洗剂使用对洗车行业有巨大的影响。
含氢氟酸的清洁溶液和其反应产物污染物都被认为是具有危险性的。人们对氢氟酸影响环境、健康的认识日益提高,但是这并未导致氢氟酸的使用减少。处理洗车废水是非常困难的,因此,有必要减少直至消除氢氟酸在洗车行业的应用,并制定有效回收洗车清洁溶液和预处理产生的废水的方法。
虽然市场上存在清洁产品替代品,但是现有文献中没有发现关于它们和氢氟酸有效性比较结果的公开科学论文。因此,很难评估是否有任何方法和产品可以替代氢氟酸。不过,采用环境安全且无毒的清洗剂并结合高压水清洗,可能是最佳替代方法。然而,需要解决成本增加、环境可持续性和节约用水问题。更高效的水再生和循环系统对于减少水的使用是相当重要的。对健康和环境方面的负面影响与含氢氟酸的洗车清洗液的相对简单的使用流程之间存在矛盾,公众对于如何解决这一矛盾非常关注。
从氢氟酸除去汽车上的刹车灰尘和道路污垢的能力来说,现有的化学化合物可能没有能够直接代替氢氟酸的。由于使用氢氟酸的固有危害,只有接受过如何规范使用和处理氢氟酸深入培训的工作人员并且在具有必要的防护设备来保障化学安全的条件下,才能使用氢氟酸。作为一项政策,汽车清洁公司不应该将氢氟酸卖给没有接受过安全使用氢氟酸(即使是规定的氢氟酸浓度)专业培训的客户。尽管如此,鉴于氢氟酸的剧毒性质,开发更安全更有效的氢氟酸替代品将是对社会负责的正确选择。
建议直接或间接参与洗车行业的公司应该严格执行有利于减少氢氟酸使用的洗车工艺的变更。同时应鼓励这些公司与当地机构或大学开始合作,致力于开发氢氟酸的替代工艺和各种方法,以提高和改进现有的洗车程序和清洗剂配方。
[1]U.S. Environmental Protection Agency, Hydrogen chloride and hydrogen fluoride emission factors for the National Acid Precipitation Assessment Program (NAPAP)emission inventory, Research Triangle Park, Durham, North Carolina, EPA-600/7-85/041, 1985.
[2]A.B. Burg, in: J.H. Simons (Ed.), Fluorine Chemistry, I, Academic Press,New York,1950, p. 180.
[3]J. Strachan, A deadly rinse: the dangers of hydrofluoric acid, Professional Car- washing and Detailing. http://www.carwash.com/article.asp?Index ID=4230101,1999.
[4]N. Leiber, Keenwash: A waterless car wash from the Middle East.Innovator, Bloomberg Businessweek. http://www.businessweek.com/magazine/content/11_26/b4234046583125.htm, 2011.
[5]J. DeMarre, Water Technol. Magazine (1998)118–120.
[6]B. Ruder, Water Technol. Magazine (1998)121–124.
[7]N. Paxee us, Water Sci. Technol. 33 (1996)1-8.
[8]C. Brown, Water conservation in the professional car wash industry, A report for the International Carwash Association. International Carwash Association, Inc.. http://www.carwash.org/SiteCollectionDocuments/Research/Environmental%20Reports/Water%20Conservation%20in%20 the%20Professional%20Car%20Wash%20Industry.pdf, 1999.
[9]U.S. Environmental Protection Agency, Hydrogen fluoride study:report to congress: Research Triangle Park, Druham, North Carolina,EPA-550/R-93/001, 1993.
[10]K. Mercer, Take me out to the carwash: Successful residential and community- based non-point source pollution prevention, Stormwater.http://www.stormh2o.com/may-june-2002/carwash-successfulresidential.aspx, 2002.
[11]Research and Innovative Technology Administration, Bureau of Transportation Statistics, Table 1-11: Number of U.S. aircraft, vehicles,vessels, and other conveyances. http://www.bts.gov/publications/nation al_transportation_statistics/html/table_01_11.html, 2008.
[12]S.E. Manahan, Environmental Science and Technology: A Sustainable Approach to Green Science and Technology, second ed., CRC Press,FL, USA, 2007, pp. 307-310.
[13]J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R.Romano, J.P. Cuer, Ullmann's Encyclopedia of Industrial Chemistry,Wiley-VCH, Weinheim, 2005.
[14]U.S. Geological Survey, Area Reports-Domestic: U.S. Geological Survey Minerals Yearbook 2006, 2, Government Printing Office,Washington D.C., 2009, pp. 15-3.
[15]M.M. Miller, Minerals Yearbook, Fluorspar (Advance Release), U.S.Geological Survey Minerals Yearbook, 2011, pp. 26. 1-26.13. http://minerals.usgs.gov/minerals/pubs/commodity/fluorspar/myb1-2009-fluor.pdf, 2009.
[16]K.A. McGee, T.M. Gerlach, Volcanic hazards fact sheet: volcanic gas,U.S. Geological Survey Open-File Report, 95-85, pp. 2.http://vulcan.wr.usgs.gov/Glossary/ Emissions/Publications/OFR95-85/OFR95-85.html, 1995.
[17]R. Carpenter, Geochim. Cosmochim. Acta 33 (1969)1153-1167.
[18]O.G. Bartels, Health Phys. 22 (1972)387–392.
[19]H.F. Mark, D.F. Othmer, C.G. Overberger, G.T. Seaborg (Eds.), third ed., Kirk-Othmer Encyclopedia of Chemical Technology, vol. 10,John Wiley and Sons, New York, 1980, p. 285.
[20]DuPont Chemicals, Material Safety Data Sheet, Hydrofluoric acid—Anhydrous, Wilmington, Delaware, 1991, pp. 138.
[21]S.C. Mitchell, in: H.R. Waring, B.G. Stevenson, S.C. Mitchell (Eds.),Molecules of Death,, second ed., Imperial College Press, London, 2007,pp. 119-130.
[22]A.F. Holleman, E. Wiberg, Inorganic Chemistry, Academic Press, San Diego, CA, USA, 2001, pp. 425.
[23]National Institute for Occupational Safety and Health, U.S. Department of Health, Education, and Welfare: Criteria for a Recommended Standard Occupational Exposure to Hydrogen Fluoride, HEW Publication No. (NIOSH)76-143, GPO No. 017-033-00171-5,U.S. Government Printing Office, Washington, D.C., 1976.
[24]M.M. Miller, Minerals Yearbook, Fluorspar (Advance Release), U.S.Geological Survey Minerals Yearbook, 2010, pp. 26. 1-26.10. http://minerals.usgs.gov/minerals/pubs/commodity/fluorspar/myb1-2008-fluor.pdf, 2008.
[25]M. Kirschner, Hydrofluoric Acid, Chemical Market Reporter 268 (16)(2005)38.
[26]Honeywell Specialty Materials, Recommended medical treatment for Hydrofluoric acid expo-sure, Morristown, New Jersey, Honeywell International, Inc., pp. 1-16.http://www51.honeywell.com/sm/ Hydrofluoric acid/common/documents/ Hydrofluoric acid _medical_book.pdf,2006.
[27]F. Ullmann, Ullmann's Encyclopedia of Industrial Chemistry, sixth ed.,Wiley VCH, New York, 2003.
[28]J.L. Galvez, J. Dufour, C. Negro, F. Lopez-Mateos, Ind. Eng. Chem.Res. 46 (2007)5221-5227.
[29]C.D. Hance, P.A. Solomon, L.G. Salmon, T. Fall, G.R. Cass, Environ.Sci. Technol. 31 (1997)956–959.
[30]B. Conley, T. Shaikh, D.A. Atwood, Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc., New York, 2002.
[31]G. Stefanidakis, J.E. Gwyn, in: J.J. McKetta (Ed.), Chemical Processing Handbook, CRC Press, Boca Raton, FL, USA, 1993, pp. 80–138.
[32]D.J. Monk, D.S. Soane, R.T. Howe, Thin Solid Films 232 (1993)1–12.
[33]H.-D. Jakubke, H. Jeschkeit (Eds.), Concise Encyclopedia Chemistry,revised ed., Bibliographisches Institut & F.A. Brockhaus AG, Mannheim,Germany, 1994, p.834.
[34]J.P. Salame, Hydrofluoric acid + truck washing = death. http://www.interclean. com/InterClean/List/ Hydrofluoric acid -warning/Hydrofluoric Acid report.htm, 2010.
[35]B. Markert, Sci. Total Environ. 176 (1995)45–61.
[36]J. Scanca, R.U. Milcica, M. Strazar, O. Burica, Sci. Total Environ. 250(2000)9–19.
[37]R.C. Lathrop, P.W. Rasmussen, K.K. Knauer, Water Air Soil Pollut.56 (1991)295–307.
[38]Y. Feng, R.S. Barratt, Sci. Total Environ. 143 (1994)157–161.
[39]J.C. Ely, C.R. Neal, J.A. O’Neill Jr., J.C. Jain, Chem. Geol. 157(1999)219–234.
[40]N.L. Rose, J. Paleolimnol. 3 (1990)45–53.
[41]G. Merrington, R.J. Smernik, Sci. Total Environ. 327 (2004)239–247.
[42]C. Dietl, W. Reifenha¨ user, L. Peichl, Sci. Total Environ. 205 (1997)235-244.
[43]N.G. Mistkawi, Fundamental studies in selective wet etching and corrosionprocesses for high-performance semiconductor devices,Dissertation, PortlandState University, Department of Chemistry.http://archives.pdx.edu/ds/psu/4704, 2010.
[44]D.O. Jonas, L. Machemer, Combined cycle journal, first quarter (2004)3-7.
[45]D. Edwards, Bot. J. Linn. Soc. 84 (1982)223–256.
[46]C.F. Smith, A.R. Hendrickson, J. Petrol. Tech. 17 (1965)215–222.
[47]K. Fredenhagen, Z. Anorg. Allg. Chem. 210 (1933)210–224.
[48]E.U. Franck, F. Meyer, Fluorwasserstoff III, Z. Elektrochem. 63 (1959)571–582.
[49]C.D. Hodgeman, Handbook of Chemistry and Physics, 33 ed.,Chemical RubberPublishing Co., Boca Raton, FL, USA, 1951, 1677.
[50]P.A. Munter, O.T. Aepli, R.A. Kossatz, Ind. Eng. Chem. 41 (1949)1504-1508.
[51]H.H. Broene, T.J. De Vries, J. Am. Chem. Soc. 69 (1947)1644–1646.
[52]P. Ayotte, M. Hebert, P. Marchand, J. Chem. Phys. 123 (2005)184501-1-184501-8.
[53]F.A. Cotton, G. Wilkinson, Advanced Inorganic Chemistry, Wiley VCH, New York, 1999.
[54]J.C. McCoubrey, Trans. Faraday Soc. 51 (1955)743-747.
[55]L. Pauling, J. Chem. Educ. 53 (1976)762.
[56]P.A. Giguege, S. Turrell, J. Am. Chem. Soc. 102 (1980)5473-5481.
[57]K. Ando, J.T. Hynes, J. Phys. Chem. A 103 (1999)10398–10408.
[58]A.J. Kresge, Y. Chiang, J. Phys. Chem. 77 (1973)822–825.
[59]A. Uritski, I. Presiado, Y. Erez, R. Gepshtein, D. Huppert, J. Phys.Chem. C 113 (2009)7342–7354.
[60]G.A.C.M. Spierings, J. Mater. Sci. 28 (1993)6261–6273.
[61]D.M. Knotter, J. Am. Chem. Soc. 122 (2000)4345–4351.
[62]P. Atkins, T. Overton, J. Rourke, M. Weller, F. Armstrong, Inorganic Chemistry, fourth ed., W. H. Freeman and Company, New York,2006.
[63]M.F.A. Dove, P.G. Harrison, P. Hubberstey, R.J. Pulham, M.G.Barker, N. Logan, D.B. Sowerby, G. Davidson, The Halogens, in: C.C.Addison (Ed.), Inorganic chemistry of the main group elements, 2, The Chemical Society Burlington House, London, 1977, pp. 672-675.
[64]J.R. Davis, Corrosion Understanding the basics, ASM International,Materials Park, OH, USA, 2000, pp. 229–230.
[65]J.-Z. Li, J.-G. Huang, Y.-W. Tian, C.-S. Liu, Trans. Nonferrous Met. Soc. China 19 (2009)50–54.
[66]M. Rockel, in: U. Heubner (Ed.), Nickel Alloys, Marcel Dekker, Inc.,New York, NY, USA, 1998, pp. 44–52.
[67]E.W. Flick, Advanced Cleaning Product Formulations, Noyes Publishing, William Andrew Publications, LLC, Norwich, New York,1999, pp. 178–201.
[68]F.U. Ahmed, in: U. Zoller (Ed.), Handbook of Detergents Part E:Applications, 141, CRC Press, Boca Raton, FL, USA, 2009, pp. 201–286.
[69]G.-J. Wei, D.M. Daniel, M.D. Levitt, Hydrofluoric acid generating composition and method of treating surfaces, U.S. Patent No. 6,579,377,USA (2003).
[70]A. Thorpe, R.M. Harrison, Sci. Total Environ. 400 (2008)270–282.
[71]D. Chan, G.W. Stachowiak, J. Automobile Eng. Proc. Inst. Mech.Eng., Part D 218 (2004)953–966.
[72]J. Toboldt, L. Johnson, S.W. Olive, Automotive Encyclopedia,Goodheart-Wilcox Co., South Holland, IL, USA, 1989.
[73]J.P. Gallagher, P.H. Dougherty, Aramid containing friction materials,U.S. Patent No. 4,374,211, USA (1983).
[74]C.C. Engberg, The regulation and manufacture of brake pads: the feasibility of reformulation to reduce the copper load to the San Francisco Bay, Prepared for the Palo Alto Regional Water Quality Control Plant. http://www.p2pays.org/ref/02/01393.pdf, 1995.
[75]M.A.K. Atkinson, M.O. O' Sullivan, S. Zuber, R.F. Dodson, Am. J.Ind. Med. 46 (2004)545–553.
[76]M. Mosleh, B.A. Khemet, Tribol. Trans. 49 (2006)279–283.
[77]M. Eriksson, S. Jacobson, Tribol. Int. 33 (2000)817–827.
[78]K. Adachi, Y. Tainosho, Environ. Int. 30 (2004)1009–1017.
[79]P. Wahlin, R. Berkowicz, F. Palmgren, Atmos. Environ. 40 (2006)2151–2159.
[80]E. Manno, D. Varrica, G. Dongarra, Atmos. Environ. 40 (2006)5929–5941.
[81]M. Murakami, F. Nakajima, H. Furumai, B. Tomiyasu, M. Owari,Chemosphere 67 (2007)2000–2010.
[82]A. Iijima, K. Sato, K. Yano, H. Tago, M. Kato, H. Kimura, N. Furuta,Atmos. Environ. 41 (2007)4908–4919.
[83]O. von Uexkull, S. Skerfving, R. Doyle, M. Braungart, J. Cleaner Prod.13 (2005)19–31.
[84]A. Rauterberg-Wulff, Beitrag des Reifen- und Bremsabriebs zur Ruflemission an Straflen. Fortschritt-Berichte Reihe 15, Nr. 202, VDI Verlag, Du¨ sseldorf, Germany, 1998.
[85]Okotest Magazin, Ausgebremst—Test Bremsbela¨ ge 1, 2002, pp. 72.
[86]J.E. Fergusson, D.E. Ryan, Sci. Total Environ. 34 (1984)101–116.
[87]G. Weckwerth, Atmos. Environ. 35 (2001)5525–5536.
[88]A. Christoforidis, N. Stamatis, Geoderma 151 (2009)257–263.
[89]L.T. Fairhall, Industrial Toxicology, second ed., Williams & Wilkins Co, Baltimore, Maryland, 1957.
[90]M. Yamashita, M. Yamashita, M. Suzuki, H. Hirai, H. Kajigaya, Crit.Care Med. 29 (2001)1575–1578.
[91]M. Upfal, C. Doyle, J. Occup. Med. 32 (1990)726–731.
[92]J.E. Amoore, E. Hautala, J. Appl. Toxicol. 3 (1983)272–290.
[93]A.B.T.J. Boink, Pathophysiological mechanisms of hydrofluoric acid and fluoride intoxication: an explorative study in rats and pigs, Thesis,University of Utrecht, The Netherlands, 1993.
[94]P.B. Tepperman, J. Occup. Med. 22 (1980)691–692.
[95]E.M. Caravati, Am. J. Emerg. Med. 6 (1988)143–150.
[96]G.J. Wilkes, Emerg. Med. 5 (1993)155–158.
[97]M. Ohtani, N. Nishida, T. Chiba, H. Muto, N. Yoshioka, Forensic Sci.Int. 167 (2007)49–52.
[98]R.S. Hoffman, L.S. Nelson, M.A. Howland, N.A. Lewin, N.E.Flomenbaum, L.R. Goldfrank, Goldfrank's Manual of Toxicologic Emergencies, McGraw-Hill Pro- fessional, New York, 2007, pp.1333.
[99]J.J.R. Kirkpatrick, D.S. Enion, D.A.R. Burd, Burns 21 (1995)483–493.
[100]V. Bjo rnhagen, J. Hojer, C. Karlson-Stiber, A.I. Selden, M.Sundbom, J. Toxicol. Clin. Toxicol. 41 (2003)855–860.
[101]R.J. Greco, C.E. Hartford, L.R. Haith Jr., M.L. Patton, J. Trauma 28(1988)1593–1596.
[102]M. Dalamaga, K. Karmaniolas, A. Nikolaidou, E. Papadavid, J. Burn Care Res. 29 (2008)541–543.
[103]J.C. Bertolini, J. Emerg. Med. 10 (1992)163–168.
[104]G. Dowdak, K. Rose, R.J. Rohrich, J. Burn Care Rehabil. 15 (1994)323–327.
[105]R.I. Sheridan, C.M. Ryan, W.C. Duinby Jr., J. Blair, R.G. Tompkins,J.F. Burke, Burns21 (1995)62–64.
[106]S.T. Seyb, L. Noordhoek, S. Botens, M.M. Mani, J. Burn Care Rehabil. 16 (1995)253–257.
[107]K.J. DiLuigi, Am. J. Nurs. 101 (2001)24AAA–124AAA.
[108]M. Hatzifotis, A. Williams, M. Muller, S. Pegg, Burns 30 (2004)156–159.
[109]F.M. Buckingham, J. Occup. Med. 30 (1988)873–874.
[110]National Institute for Occupational Safety and Health, NTIS Publication No. PB-94-195047, Documentation for Immediately Dangerous to Life or Health concentrations (IDLHs). http://www.cdc.gov/niosh/idlh/idlh-1.html, 1994.
[111]American Chemistry Council, Emergency Response Guideline for Anhydrous Hydrogen Fluoride, Hydrogen Fluoride Panel, Arlington,VA. http://www. americanchemistry.com/s_acc/sec_directory.asp?CID=1457&DID=5883, 2007.
[112]G.A. Olah, J. Org. Chem. 70 (2005)2413–2429.
[113]M. Herlem, Pure Appl. Chem. 49 (1977)107–113.
[114]Oregon Occupational Safety and Health Administration, Hazard Alert, Hydro- fluoric (氢氟酸)acid in commercial cleaners for vehicles, OR-OSHA 2993 (4/09). http://www.orosha.org/pdf/hazards/2993-22.pdf, 2009.
[115]H.E. Stockinger, in: G.D. Clayton, F.E. Clayton (Eds.), fourth ed.,Patty's Industrial Hygiene and Toxicology, 2B, Wiley, New York,1981, pp. 2937–2954.
[116]E.B. Segal, J. Chem. Health Saf. 15 (2008)5–6.
[117]K. Boussu, C. Kindts, C. Vandecasteele, B. Van der Bruggen, Sep.Purif. Technol. 54 (2007)139–146.
[118]L.D. Duke, Y.J. Chung, Waste Manage. 15 (1995)543–558.
[119]C. Brown, Water use and wastewater discharge in professional car washes, A report for the International Carwash Association,International Carwash Associ- ation, Inc.. http://www.carcarecentral.com/International Carwash Association, 2002.
[120]B.O. Kwach, J.O. Lalah, Bull. Environ. Contam. Toxicol. 83 (2009)727–733.
[121]C. Fall, C.M. Lopez-Vazquez, M.C. Jimenez-Moleon, K.M. Ba,C. Daz-Delgado, D.Garca-Pulido, M. Lucero-Chavez, Revista Mexicana De Ingeniera Qumica 6(2007)175–184.
[122]C. Brown, Water effluent and solid waste characteristics in the professional car wash industry, A report for the International Carwash Association, Interna- tional Carwash Association, Inc..http://www.carwash.org/SiteCollection Documents/Research/Environmental%20Reports/Water%20Effluent%20and%20Solid%20W aste%20Characteristics.pdf, 2002).
[123]C. Brown, Water use in the professional carwash industry, A Report for the International Carwash Association, International Carwash Association, Inc..http://www. carwash.org/SiteCollectionDocuments/Research/Environmental%20Reports/Water%20Use%20in%20the%20Profession al%20Car%20Wash%20Industry.pdf, 2002.
[124]H. Janik, A. Kupiec, Polish J. Environ. Stud. 16 (2007)927–931.
[125]D.B. Kittelson, J. Aerosol Sci. 29 (1998)575–588.
[126]U.S. Department of Ecology, Stormwater management manual for Western Washington, Washington State, Water Quality Program,Publication Nos. 99-11 through 99-15, Volume IV, Source Control BMPs.http://www.ecy.wa.gov/biblio/9914.html, 2001.
[127]Z.A. Bhatti, Q. Mahmood, A.I. Raja, A.H. Malik, M.S. Khan, D.Wu, Phys. Chem. Earth 36 (2010)465–469.
[128]T. Hamada, Y. Miyazald, Desalination 169 (2004)257–267.
[129]K. Akiniwa, Fluoride 30 (1997)89–104.
[130]A. Breton, C. Vialle, M. Montrejaud-Vignoles, C. Cecutti, C.Vignoles, C. Sablayr-olles, Fresen. Environ. Bull. 19 (2010)1954–1962.
[131]J. Gromley, The truth about ammonium bifluoride. Professional Carwashing & Detailing. http://www.carwash.com/articleprint.asp?print=1& IndexID=6631269,2001.
[132]Air Products and Chemicals, Inc., Industrial and Institutional Cleaning Formu- lary, Pennsylvania, USA, pp. 22.http://www.tomah3.com/flles/110-10-006- US_brochure.pdf,2010.
[133]M.D. Levitt, T.J. Kloss, M.E. Besse, R.D. Hei, J.D. Hoyt, C.O'Connor, V.F. Man, Composition and method for road-fllm removal, U.S. Patent No. 7,482,315, USA (2009).
[134]V. Chernin, R.W. Kubala, R. Martens, Metal brightener and surface cleaner, U.S. Patent No. 7,384,902, USA (2008).
[135]L. Minevski, Tire wheel cleaner comprising a dialkyl sulfosuccinate and phos- phate ester surfactant mixture, U.S. Patent No. 7,390,773, USA(2008).
[136]E.A. Jordan, W.-C. Su, R.J. Baumgart, F.E. Lockwood, Touchless wheel and tire cleaner composition, U.S. Patent No. 20,040,097,390,USA (2003).
[137]D.P. Murphy, Metal brightening composition and process that do not damage glass, U.S. Patent No. 5,810,938, USA (1998).
[138]P.F. King, D.D. Fekete, Low temperature aluminum cleaning composition and process, U.S. Patent No. 3,969,135, USA (1976).
[139]D.M. Loch, Tank process for plating aluminum substrates including porous aluminum castings, U.S. Patent No. 4,346,128, USA (1982).
[140]D.M. Loch, Non-chromated deoxidizer, U.S. Patent No. 4,614,607,USA (1986).
[141]M. Howe, Method for cleaning an automotive or truck wheel surface,U.S. Patent No. 5,733,377, USA (1998).
[142]G.D. Ward, R.N. Peterson, K. Donda, Method of washing a vehicle using a two- part washing composition, U.S. Patent No. 5,932,023,USA (1999).
[143]K.R. Smith, R.D. Hei, M.E. Besse, J.D. Hoyt, Cleaning composition comprising an inorganic acid mixture and a cationic surfactant, U.S.Patent No. 6,982,241, USA (2006).

