HA蛋白多肽抗体的设计、制备与鉴定
袁红花,王珍珍,陈仁金,胡安康,张腾业,吴连连,冀德君,朱孝荣*
(1.徐州医学院, 江苏 徐州 221004;2.扬州大学,江苏 扬州 225009)
牛皮蝇蛆病是由牛皮蝇寄生于牦牛或黄牛体内引起的一种家畜寄生虫病,牛只感染后可使产奶量和产肉量降低,牛皮穿孔,给养牛业带来巨大的经济损失。研究发现,纹皮蝇和牛皮蝇幼虫能在宿主组织中移行8个月,其分泌的四种丝氨酸蛋白酶―皮蝇素,起免疫抑制作用,以致宿主不能用免疫机能杀死蝇的幼虫。皮蝇素A(Hydermin A,HA)是牛皮蝇一期幼虫在宿主体内游行时分泌的一种丝氨酸蛋白酶。皮蝇素A具有抗炎、抑制补体反应等功能[1-2]。
据研究报道,HA调节宿主免疫功能有下列3种机制: HA抑制IL-10生成,从而抑制T-淋巴细胞增殖[3];裂解补体C3,中断宿主补体反应途径[4];HA通过前列腺素途径,过表达前列腺素E2,减少IL-2生成,抑制免疫排斥[5]。HA这些免疫调节功能,抑制了宿主对牛皮蝇幼虫的排斥反应,保证了牛皮蝇幼虫在宿主体内成活。HA具有很好的免疫原性,以其作为免疫抗原,可使被免疫的动物产生对牛皮蝇幼虫感染具有保护性的抗体。利用生物学信息预测HA蛋白的高级结构及亲水性,根据分析结果选取预测抗原性较高与已知蛋白同源性低的多肽片段,采用固相多肽合成法合成多肽,免疫家兔,制备HA的多克隆抗体。为进一步研究HA的分子功能提供了有用的工具。
1 材料与方法
1.1 试验材料
新西兰大白兔为徐州医学院实验动物中心饲养;完全弗氏佐剂和不完全弗氏佐剂购自购自Gibco BRL公司;载体蛋白交联试剂盒购自Pharmacia Biotech公司;ECL化学发光试剂及BcA蛋白定量试剂盒购自Pierce公司;HRP-IgG抗体购自Santa Cruz公司。
1.2 方 法
1.2.1 生物学分析及多肽的设计 登录进入http:// www.nicbi.nlm.nih.gov,采用Blastn和Blastx程序,进行同源性和保守性分析。利用生物信息学DNAstar (Protean)软件对HA的二级结构、抗原性、亲水性、疏水性、结合位点、氨基酸的带电性及所选择氨基酸偏碱性和偏酸性等理化性质进行分析[6]。设计含13~16个氨基酸的目的多肽。
1.2.2 多肽的合成及载体的偶联 多肽的合成和与载体蛋白-血蓝素联(KLH)接交由百奇生物有限公司完成,多肽的合成采用9-氟甲氧羰基(9-fluorenylmethyloxycarbonyl,Fmoc)固相合成法合成多肽片段,利用高效液相法(highper formance liquid chromatography,HPLC)进行纯化,纯化后的样品再用质谱分析,纯度为91.2%。
1.2.3 抗HA多肽抗体的制备 以250 μg/次剂量的多肽-KLH偶联物与等体积的完全弗氏佐剂混合,采用背部多点注射法。两周后取多肽抗原原液加等体积的不完全弗氏佐剂进行免疫,连续免疫3~4次,每次免疫10 d左右,从兔耳静脉采血测定抗体效价,符合要求时,动脉取血,分离血清,-20 ℃保存。
1.2.4 ELISA检测多克隆抗体的效价 人工合成裸肽作为抗原,以2 μg/mL为最终浓度溶解于包被液中,对应孔加入100 μL抗原,室温孵育2 h或4 ℃过夜;抗血清稀释比分别为1∶1 k、1∶4 k、1∶8 k。以1∶1 k、1∶4 k,稀释的正常兔血清作为阴性对照,37 ℃孵育1~2 h或室温孵育3 h;每孔中加100 μL二抗,室温孵育1 h,倒空并拍干残留液体,加满洗涤液清洗,重复2~5次;每孔中加入100 μL底物,显色30 min,酶标仪读取405~410 nm波长处的OD值。
1.2.5 Western blotting 分析抗血清和多克隆抗体的特异性 提取牛皮蝇一期幼虫的蛋白,进行SDS-PAGE 电泳分离,加心法电转至PVDF膜,半干转40 mA,45 min,室温封闭1~2 h。多克隆抗体的终浓度为4 μg/mL,阴性和阳性血清稀释比为1∶1 500,4 ℃孵育过夜。HRP-标记的羊抗兔的二抗采用1∶1 000稀释,室温孵育1 h。用化学发光底物检测。
2 结 果
2.1 采用生物学信息学预测多肽序列
对HA序列进行抗原表性生物学信息分析(图1),采用Blastn和Blastx程序发现HA3段多肽序列具有良好的序列特异性,多肽序列如表1所示。

图1 HA抗原性的生物学信息分析A.同源性;B.亲水性;C.β-转角;D.柔性区域;E.易近性Fig. 1 Analysis of antigenicity of HA biological informationA.Homology;B.Hydrophilic;C.β-corner;D.Flexible regions;E.Easy to be close
2.2 抗血清或多克隆抗体效价
采用间接ELSIA方法,对三只兔子的血清进行免疫检测,并取阴性兔子为对照。阳性血清分别稀释为1∶1 k、1∶4 k和1∶8 k,阴性血清分别稀释为:1∶1 k和1∶4 k。结果发现在1∶1 k的条件下,样本A、B和C的两个重复抗血清的OD值分别为3.481、3.459和3.424(表2)。对A和B的多克隆抗体进行RP-HPLC纯化,并通过质谱鉴定,结果最终浓度分别达到1.14 mg/mL、1.17 mg/mL和0.96 mg/mL。

表1 多肽序列及其评分Table 1 Peptide sequences and scores
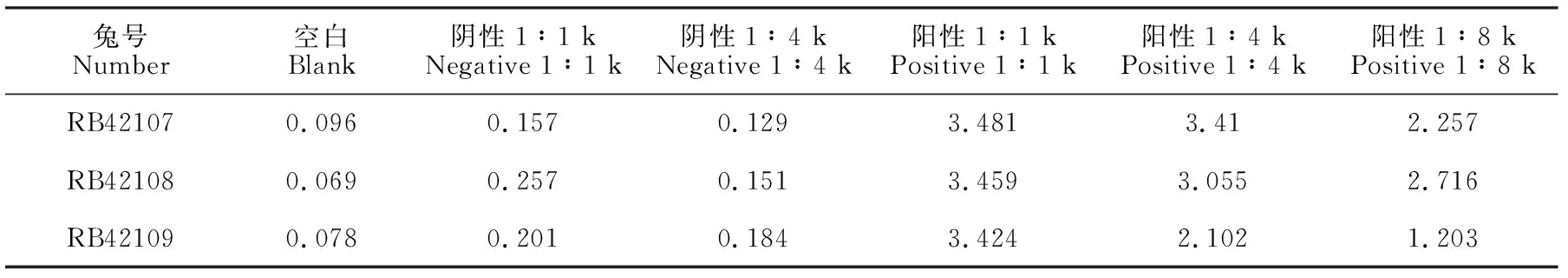
表2 血清的ELISA结果Table 2 The results of serum ELISA
2.3 Western印迹检测HA抗体特异性
提取牛皮蝇一期幼虫的总蛋白,分别加入一抗(2 μg/mL),阴性血清(1∶1 500)和阳性血清(1∶1 500)。结果显示一抗与阳性血清在28 kD处均有目标条带,说明HA 抗体的特异性较强(图2)。

图2 三种抗体的western印迹验证结果1,4,7分别为抗1、抗2、抗3;2,5,8分别为阴性血清;3,6,9分别为阳性血清Fig.2 Western blotting result of the three antibodies 1,4 and 7 are respectively antibody 1, 2 and 3; 2, 5 and 8 are negative serums, while 3, 6 and 9 are positive serums
3 讨 论
HA 是一种功能性抗原基因,在特异性的免疫系统中参与免疫调节过程。研究发现,HA能降解补体C3 ,抑制补体介导的细胞毒性,从而延迟移植排斥反应[7-8]。抗体是研究蛋白必不可少的研究工具,根据氨基酸序列合成多肽并与载体偶联,免疫制备多肽抗体是一种比较快速的手段。利用生物信息学对HA的抗原性及其亲水性分析提示该氨基酸具有较好的抗原性,并发现抗原表位主要分布在氨基酸的C端,101~116,161~173,37~50的三个区域。
通过RP-HPLC方法测定人工合成的多肽发现,其纯度达到91.2%,并通过质谱鉴定分子量与预计的分子量吻合为28 kD。然后与KLH连接,免疫新西兰大白兔,得到了HA的多肽抗体。采用ELISA和western blotting方法验证了抗体的特异性。ELISA结果显示制备的HA多肽抗体特异性识别多肽,且滴度较高。同时从牛皮蝇一期幼虫中提取蛋白,对制备抗体、阴性血清和阳性血清进行western blotting检测,结果发现制备抗体和阳性血清分别在28 kD处有目的条带,而阴性血清没有目的条带。
综上所述,结果显示制备的HA多克隆抗体具有与抗原结合的特异性,并运用ELISA和western blotting方法进行了验证。这为进一步研究HA的分子功能及免疫调控机制提供了有用工具。
参考文献:
[1] Boulard C. Degradation of bovine C3 by serine proteases from parasites Hypoderma lineatam (diptera, oesttidae)[J]. Vet Immunol Immunopathol, 2001, 20:287-391.
[2] Gjini E, Haydon D T, Barry J D,et al. Critical interplay between parasite differentiation, host immunity, and antigenic variation in trypanosome infections [J]. American Naturalist, 2010, 176(4): 424-439.
[3] Panadero R, Dacal V, López C, et al.Immunomodulatory effect of Hypoderma lineatum antigens: in vitro effect on bovine lymphocyte proliferation and cytokine production [J]. Parasite Immunology, 2009, 31: 72-77.
[4] Baron R W. Cleavage of purified bovine complement component C3 in larval Hypoderma lineatum (Diptera: Oestridae) hypo-dermins [J]. Journal of medical entomology, 1990, 27 (5): 899-904.
[5] Nicolas-Gaulard I, Moire N, Boulard C. Effect of the parasite enzyme, hypodermin A, on bovine lymphocyte proliferation and interleukin-2 production via the prostaglandin pathway [J]. Immunology, 1995, 85 (1): 160-165.
[6] 陈 卓,刘家驹,毕 亮,等. NPR1多肽抗体的制备和应用[J]. 生物技术通报,2012(1): 145-149.
[7] Malassagne B, Regimbeau J M, Taboit F, et al. Hypodermin A, a new inhibitor of human complement for the prevention of xenogeneic hyperacute rejection [J]. Xenotransplantation, 2003, 10: 267-277.
[8] Panadero R, Dacal V, Lopez C, et al. Immunomodulatory eff-ect of Hypoderma lineatum antigens: in vitro effect on bovine lymphocyte proliferation and cytokine production [J]. Parasite Immunology, 2009, 31: 72-77.

