胎儿成纤维细胞的培养分离方法对猪体细胞核移植胚胎发育潜力的影响
黄雅琼,石德顺,陈旭健,李家洲,曾诗媛,谢秋季,赵仕花,阮桂文
(1.玉林师范学院 生命科学与技术学院,广西 玉林 537000 ;2.广西大学 动物繁殖研究所,广西 南宁 530005)
在生产实践中,由于各种因素的影响,造成体细胞核移植效率低下的问题非常严重,制约了该技术的进一步发展和应用。供核体细胞是影响核移植效率的关键因素之一[1]。血清饥饿诱导G0期是哺乳动物体细胞核移植克隆成功的必要步骤[2]。诱导细胞进入G1和G2/M等时期可得到克隆后代[3-4]。血清饥饿处理供体细胞成为众多研究者首选的方法[5]。在各种影响因素中,体细胞和卵母细胞细胞周期协调更是体细胞核移植最为关键的环节[6]。目前,卵母细胞体外发育质量及培养体系仍不完善,需进一步提高核移植重构胚的体外发育的潜能。本研究探讨了胎儿成纤维细胞的不同处理方式等相关因素对核移植重构胚胎发育能力的影响,以期提高猪体细胞核移植重构胚胎的发育潜力。
1 材料与方法
1.1 卵母细胞的成熟
卵母细胞的采集和成熟培养采用黄雅琼等[7-8]介绍的方法,将屠宰场采集的青年母猪的卵巢放在38 ℃加热板上,抽取卵巢表面卵泡内的卵泡液和卵母细胞,在体视显微镜下挑选并收集具有完整卵丘细胞层和部分致密卵丘细胞的卵母细胞(卵丘-卵母细胞复合体)。在1 mL含有促卵泡素(FSH)0.1 μg/mL的成熟培养液(无血清的TCM-199基础液+10%PFF+0.1%mg/mL cysteine)的培养液中,38.5 ℃、5% CO2和100%湿度的条件下,培养卵母细胞22~24 h,接着在不含FSH的成熟培养液中成熟培养22~24 h。培养44~48 h后,卵母细胞复合体用100 μL的移液枪反复轻轻吹打或者放入0.1%透明质酸酶5 min,除去颗粒细胞,然后逐一检查第一极体(PB1)的排出情况,计算第一极体排出率,并以此计算卵母细胞的体外成熟率。
1.2 卵母细胞的激活
排出第一极体的卵母细胞首先放入5 μmol/L ionomycin(离子酶素:ION)中激活5 min,然后将清洗后的卵母细胞放入含有2 mmol/L 6-DMAP(6-二甲氨基嘌呤)中的培养液中培养3~4 h。
1.3 猪胎儿成纤维细胞的准备
猪胎儿成纤维细胞作为供体细胞,胎儿成纤维细胞的收集方法参照文献[9-10]。首先用PBS溶液清洗干净胎儿组织,剪碎成1 mm3大小的组织块,在37 ℃、5%CO2、100%湿度条件下贴壁培养于10%FCS的DMEM(Dulbecco's Modified Eagle's Medium)培养液中。当80%以上胎儿成纤维细胞细胞汇合后,用无Ca2+,Mg2+的PBS清洗原代细胞,再用0.25%胰蛋白酶的Hank's液2~3 mL消化3~5 min使胎儿纤维细胞分离,中止消化后,将胎儿成纤维细胞离心洗涤(800×g,5 min),加入10%FCS的DMEM培养液中,制成1.0×106个细胞/mL的悬浮液,即可多次进行接种培养和传代。
1.4 核移植重构胚胎的构建
将卵母细胞轻轻吹打或放入含0.1%透明质酸酶的培养液中轻轻反复吹打,除去卵母细胞外颗粒细胞后获得裸卵,挑选其中具有第一极体、细胞质均匀的成熟良好的卵母细胞移入含有5 μg/mL细胞松弛素B+TCM199+5 mmol/L Hepes+5 mmol/L NaHCO3+5%OCS的培养液中,置于显微操作仪的载物台上。用盲吸法去核和Hochest33342染色法进行染色[8-9],确认去核后的卵母细胞放入胚胎培养液(NCSU-23+0.3%BSA)中30 min促进形态的恢复。用含有0.25%胰蛋白酶消化分离和处理胎儿成纤维细胞,将纤维细胞和恢复后的卵母细胞移入操作盘,构建卵母细胞-胎儿成纤维细胞复合体。
1.5 核移植重构胚胎的融合与激活和培养
将卵母细胞-胎儿成纤维细胞复合体放在融合液0.28 mol/L甘露醇+0.05 mmol/LCaCl2+0.1mmol/LMgSO4+5 mmol/LHepes+0.1%BSA+5mg/L酚红溶液中,施加电流进行融合。在38.5℃、5%CO2、100%湿度的条件下培养电融合后的卵母细胞-供体细胞复合体30 min~60 min,在显微镜下检查融合情况,注入卵周隙的胎儿成纤维细胞进入去核后的卵母细胞的胞质内,卵母细胞与供体细胞融合为一体即为重构胚胎。计录各组融合数及融合率[11]。将融合激活后的重构胚胎用猪胚胎培养液NCSU-23(North Carolina State University-23,NCSU-23)溶液在38.5 ℃,含5%CO2的空气和100%湿度的条件下培养48 h后观察分裂率。每2 d将进行重构胚胎培半换液1次,6~9 d记录囊胚率。重构胚胎的融合率为融合卵数/NT卵数的比率;重构胚胎的卵裂率为分裂卵数/培养卵数的比率;重构胚胎的囊胚率为囊胚发育卵数/分裂卵数的比率。
1.6 试验设计
试验一:采用血清饥饿法和接触抑制法诱导第6代胎儿成纤维细胞进入G0/G1期,以70%~80%汇合的胎儿成纤维细胞作对照组,进行70%~80%接触、完全接触抑制法(100%长满)和血清饥饿法(0.5%FCS+DMEM)比较,探讨三种处理胎儿成纤维细胞的方法对重构胚胎体外发育的影响。
试验二:分别用常规传代消化、4 ℃冷藏和冷冻-解冻的第6代胎儿成纤维细胞作为供体细胞,分析核移植胚胎的发育潜力。
试验三:分别用酶消化法和组织块法分离培养的胎儿成纤维细胞作为供体细胞构建核移植胚胎,分析不同方法对核移植胚胎发育潜力的影响。
1.7 统计分析
所有试验数据采用INSTAT统计软件进行卡方(x2)分析检验。
2 结果与分析
2.1 不同传代培养方法对核移植胚胎发育潜力的影响
胎儿成纤维细胞不同传代的培养方法对核移植胚胎发育潜力的影响见表1。由表1知,完全接触抑制组融合率较高,与对照组相比差异显著(P<0.05),接触抑制组分裂率与血清饥饿组分裂率相比,差异显著(P<0.05),但各组之间的囊胚率差异不显著(P>0.05)。70%~80%接触、完全接触抑制法(100%长满)和血清饥饿法(0.5%FCS+DMEM)是三种调节供体细胞进入G0/G1期的有效的同期化处理胎儿成纤维细胞作为供体的方法。
2.2 成纤维细胞对核移植胚胎发育潜力的影响
在常规消化(Routine Digestion)情况中,即正常传代消化分离的胎儿成纤维细胞直接用,一部分收集于Eppendorf离心管中,放于4 ℃冷藏,液氮( 196 ℃)冷冻解冻(37 ℃)的胎儿成纤维细胞复苏后收集做为供体细胞,构建重构胚胎。三种方法的结果见表2。由表2知,猪胎儿成纤维细胞冷冻解冻后的核移植分裂率和囊胚发育率均显著低于新鲜和4 ℃冷藏的细胞(P<0.05)。虽然融合率无显著差异(P>0.05),但猪胎儿成纤维细胞解冻后不宜直接进行核移植。
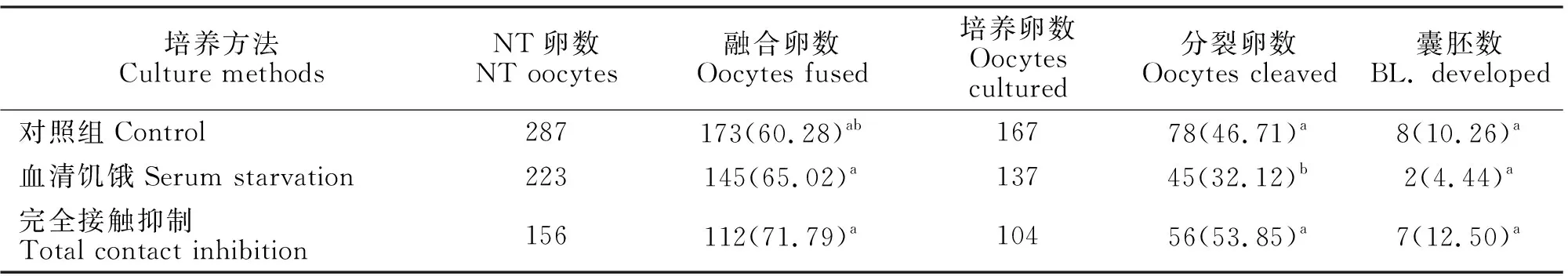
表1 胎儿成纤维细胞的不同传代的培养方法对核移植胚胎发育潜力的影响Table 1 Effects of different passage culture methods of fetal fibroblasts on embryos developmentalcapacity of porcine somatic cells nuclear transfer
注:同列数据肩标为不同小写字母表示差异显著(P<0.05),无字母或相同小写字母表示差异不显著(P>0.05);括号内数字分别是融合率、分裂卵率、囊胚率。下同。
Note:Values with different small letter superscripts in the same column mean significant difference(P>0.05),while those with the same letter or without superscripts mean insignifiant difference(P>0.05);Numbers in the brackets are respectively fusion rate, cleavage rate and blastocyst rate.The same below.
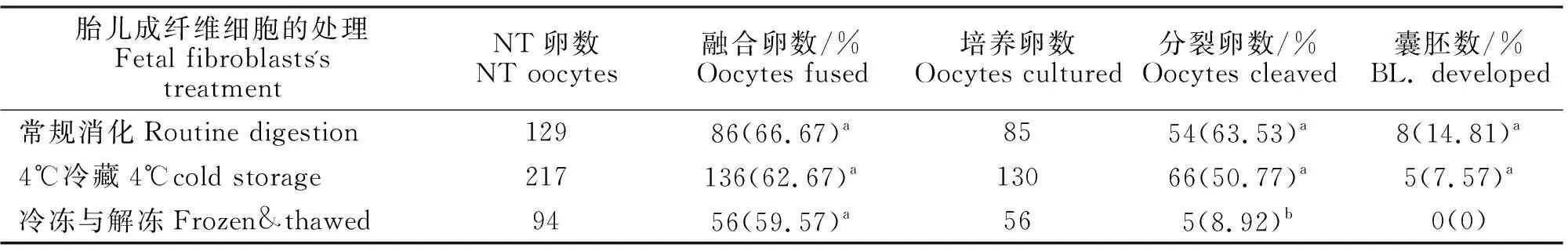
表2 不同方法处理的胎儿成纤维细胞对核移植胚胎发育潜力的影响Table 2 Effects of different treatment methods of fetal fibroblasts on embryos developmental capacity of porcine somatic cells nuclear transfer
2.3 不同分离培养方法对核移植胚胎发育的影响
用组织块和酶消化法分离培养的胎儿成纤维细胞对核移植胚胎发育潜力的影响见表3。表3表明,两种分离方法分离得到的胎儿成纤维细胞构建的重构胚胎在融合率、分裂率和囊胚率方面没有显著差异(P>0.05)。组织块和酶消化法分离方法均是分离培养的胎儿成纤维细胞细胞的方法。

表3 胎儿成纤维细胞不同分离培养方法对重构胚胎发育潜力的影响Table 3 Effects of different cell dissociate culture methods of fetal fibroblasts on embryos developmental capacity of porcine somatic cells nuclear transfer
3 讨 论
3.1 胎儿成纤维细胞不同传代的培养方法对核移植胚胎发育潜力的影响
调节细胞周期的方法有血清饥饿法、接触抑制法、诱导法及辅助用化学试剂调节等方法。目前,血清饥饿法、接触抑制法较常用,很多克隆动物都由这两种方法获得[12-14]。血清饥饿法是经典的调节细胞周期的方法,首例体细胞克隆绵羊“Dolly”等多种动物克隆成功都是采用将供体细胞调节至G0/G1期而实现[15-18]。Beyhan等[19]和Ono等[20]研究表明,供体细胞处于G0/G1状态下有利于核移植重构胚胎发育。因此,供体细胞处于G0/G1阶段是体细胞核移植重构胚胎进行重编,启动发育的重要因素。通常可利用细胞贴壁生长接触抑制的特性将其调节到G0/G1期,体细胞在体外贴壁培养并接触抑制时,70%左右的细胞处于G0/G1期的细胞生长周期内[21-23],100%汇合的供体细胞自然停止生长,其细胞周期达到静止期。本试验结果表明,胎儿成纤维细胞在完全接触抑制组的融合率较高,接触抑制组分裂率显著高于血清饥饿组,但不同处理间的囊胚率差异不显著。血清饥饿处理的细胞DNA碎片明显较高,影响核移植的效率[23-24]。Bochenek等[25]研究表明,血清饥饿处理并不能显著增加成纤维细胞处于G0/G1期细胞的比率。Kues等[23]研究证实,血清饥饿培养时间延长会导致大量的DNA碎裂;降低培养液中血清浓度可以尽量维持细胞不分化的状态,降低细胞的生长速度,调节细胞生长状态,不发生增殖,从而使细胞达到周期一致。血清饥饿处理对囊胚的早期发育没有明显的促进[26-29]。诱导细胞进入G1和G2/M等时期可得到克隆后代[3-4]。Vignon等[30]和Cibelli 等[31]等不经血清饥饿同样得到了克降动物,这说明供体细胞可以不需要血清饥饿。Kasinathan等[3]研究发现,分别从25%和100%汇合程度人供体细胞分离出来的G1期细胞为供体细胞,其重构胚胎的囊胚的细胞数量和囊胚率都没有明显区别。这说明可能细胞的汇合程度并不能做为判断细胞周期同期化程度的标准。多数研究者均认为,血清饥饿和接触抑制可以提高供体细胞处于G0/G1周期阶段的数量,G0/G1周期阶段的供体细胞有利于重构胚胎的发育和克隆动物的成功[15-19]。
Boquest等[22]认为没有一种最佳方法调节细胞周期完全达到(100% G0/G1)周期同步的要求,而Woods等[5]采用血清饥饿的方法处理供体细胞。本试验研究结果表明,胎儿成纤维细胞70%~80%接触、完全接触抑制法(100%长满)和血清饥饿法(0.5%FCS + DMEM)三种方法均可有效地同期化供体细胞周期。对于供体细胞周期的问题,Enright等[32]建议通过监测细胞周期同期化建立预测克隆胚胎命运的模型。对于供体细胞的周期同步调节问题上,细胞的处理方法、血清的成分、血清浓度、血清培养时间、细胞生长的最佳密度、细胞生长的合适时间、促进细胞生长的调节因子、细胞生长的影响因素、影响细胞生长的处理和调控方法等还需要进一步研究。
3.2 不同处理方法对核移植胚胎发育潜力的影响
使用胎儿成纤维细胞为供体,探讨在常规消化法、4 ℃冷藏法和液氮( 196 ℃)冷冻与解冻(37 ℃)法处理后,对猪重构胚胎发育潜力。常规消化法和冷藏方法可有效处理胎儿成纤维细胞。Liu等[33]成功得到了冷藏2~5 d后的牛囊胚;Guo等[34]成功得到了冷藏细胞克隆的山羊后代。据王立芳[35]报道,成功得到冷冻细胞克隆的种间水牛。张运海[29]研究表明,冷藏的细胞支持囊胚发育效率没有受到不利影响,也获得首例用冷藏的猪体细胞表达绿色荧光蛋白的克隆囊胚。新鲜解冻的供体细胞步骤较复杂,可利用的传代次数也不多,效率低,所以人们通过冷冻/解冻供体细胞的方法来保证核移植的供体细胞的需要。本试验中,对胎儿成纤维细胞冷冻/解冻后,发现冷冻效果不理想,可能是大部分细胞受到了冷冻损伤,造成重构胚胎的卵裂率降低;猪胎儿成纤维细胞冷冻解冻后的核移植分裂率和囊胚发育率均显著低于新鲜和4 ℃冷藏的细胞,说明猪胎儿成纤维细胞解冻后不宜直接进行核移植。本试验中胎儿成纤维细胞所构建的核移植重构胚胎出现分裂到细胞的不同阶段,没有得到冷冻解冻后的胎儿成纤维细胞构建的核移植囊胚。其原因可能是胎儿成纤维细胞在冷冻解冻过程中,胎儿成纤维细胞冷冻所形成的细胞内的冰晶融解后,对胎儿成纤维细胞的亚显微结构成一定程度的损坏,胎儿成纤维细胞的由于冷冻损伤而活力下降。另外,由于使用方法不同及条件差异,造成试验结果不尽相同,本试验中,胎儿成纤维细胞冷冻解冻的重构胚胎不能发育至囊胚阶段。
3.3 不同分离培养方法对核移植胚胎发育潜力的影响
酶消化法和组织块培养法是常规的细胞分离培养方法。王启凤等[36]利用胰蛋白酶消化供体细胞易受pH、温度、组织的硬度以及酶的浓度、消化时间和消化液浓度等因素的影响,导致细胞损伤,不易贴壁。因此,在使用酶消化法分离的细胞作为供体细胞时,会影响核移植胚胎的发育潜力。组织块培养法获得细胞生长状态良好,形态规则整齐,取材方便,成本低,但原代细胞生长慢,细胞传代时间长。研究表明,组织块的采样为1 cm2左右为宜,这可降低对动物健康状况和应用价值的影响[37-40]。蔡文琴[41]研究发现,组织块法进行培养可提高培养成功率。本试验中,采用酶消化法和组织块法分离得到的供体细胞构建的重构胚胎的融合率(60.15%和67.72%)、分裂率(64.34%和60.63%)和囊胚率(17.39%和14.92%)没有显著差异,这说明两种胎儿成纤维细胞分离培养方法均为有效的分离培养方法,可支持重构胚胎的构建和发育。
4 结 论
结果表明,100%长满汇合培养是较好的猪胎儿成纤维细胞培养处理方法;猪胎儿成纤维细胞解冻后不宜直接进行核移植;组织块法和酶消化法均可用于分离培养猪体细胞核移植的胎儿成纤维细胞。
参考文献:
[1] Oback B, Wells D. Donor cells for nuclear cloning: many are celled, but few are chosen[J].Cloning Stem Cells,2002,4(2):147-168.
[2] Willmut I, Campbell K H. Quiescence in nuclear transfer[J]. Science,1998, 281: 1611.
[3] Kasinathan P, Knott J G, Moreira P, et al. Effects of fibrobalst donor cell age and cell cycle on development of bovine nuclear transfer in vitro[J]. Biol Reprod,2001, 64: 1 487-1 493.
[4] Lai L X, Kolber-Simonds D, Park R J, et al. Production of α-1,3-galactosyltransferase knockout pigs by nuclear transfer cloning[J]. Science, 2002, 295:1 089-1 092.
[5] Woods G L, White K L, Vanderwall D K, et al. A mule cloned from fetal cells by nuclear transfer[J]. Science,2003, 301:1063.
[6] 李劲松,韩之明,朱子玉,等.未经休眠处理的体细胞用于异种核移植(简报)[J].实验生物学报,2002,35(1):62-65.
[7] 黄雅琼,石德顺,谭世俭,等.猪卵母细胞体外成熟和孤雌培养体系的建立和优化[J].中国畜牧杂志,2007,43(7):13-16.
[8] 黄雅琼,石德顺,张晓溪,等.猪卵母细胞体外成熟的发育潜力及核移植重构胚构建方法的研究[J].基因组学与应用生物学,2009,28(5):835-844.
[9] 黄雅琼,王晓丽,崔奎青,等.猪卵丘细胞和胎儿成纤维细胞的分离培养及传代[J].中国兽医科学,2007,37(3): 255-259.
[10] 黄雅琼,石德顺,陈旭健,等.供体细胞形态、直径和传代次数对猪体细胞核移植效果的影响[J].中国兽医科学,2011,41(5):530-535.
[11] 黄雅琼,石德顺,陈旭健,等.供体细胞种类及性别对猪体细胞核移植效果的影响[J].中国畜牧杂志,2011,47(11):25-28.
[12] Kubota C, Yamakuchi H, Todoroki J, et al. Six cloned calves produced from adult fibroblast cells after long-term culture[J]. Proc Natl Acad Sci USA,2000,97:990-995.
[13] Shin T, Kraemer D, Pryor J, et al. A cat cloned by nuclear transplantation[J]. Nature,2002, 415:859.
[14] Lee B C, Kim M K, Jang G, et al. Dog cloned form adult somatic cells[J]. Nature,2005(4):436:641.
[15] Collas P, Balise J J,Robl J M. Influence of cell cycle stage of donor nucleus on development of nuclear transplant rabbit embryos[J]. Biol Reprod,1992,46: 492-500.
[16] Campbell K H, Loi P, Otaegui P J, et al. Cell cycle co-ordination in embryo cloning by nuclear transfer[J]. Dev Reprod,1996,1(1):40-46.
[17] Wilmut I, Schnieke A E, Mcwhir J, et al. Viable offspring derived from fetal and adult mammalian cells[J]. Nature,1997, 385: 810-813.
[18] Wakayama T, Perry A C F, Zueeotti M,et al. Full-term development of mice from enucleated oocytes infected with cumulus cell nuclei[J]. Nature,1998, 394:369-374.
[19] Beyhan Z, Mitalipova M, Chang T, et al. Developmental potential of bovine nuclear transfer embryos produced using different types of adult donor cells[J]. Theriogenology,2000, 53: 210.
[20] Ono Y, Shimozawa N, Ito M, et al. Cloned mice from fetal fibroblast cells arrested at metaphase by a serial nuclear transfer[J]. Biol Reprod , 2001, 64:44-50.
[21] Prather R S, Boquest A C, Day B N. Cell cycle analysis of cultured procine mammol/Lary cells[J]. Cloning,1996, 1:17-24.
[22] Boquest A C, Day B N,Prather R S. Flow cytometric cell cycle analysis of cultured porcine fetal fibroblast cells[J]. Biol Reprod,1999, 60: 1 013-1 019.
[23] Kues W A, Anger M, Carnwath J W, et al. Cell synchronization of porcine fetal fibroblasts: Effects of serum deprivation and reverible cell cycle inhibitors[J]. Biol Reprod,2000, 62: 412-419.
[24] Peura T T. Serum starvation can cause excessive DNA damage in sheep fetal fibroblasts[J]. Theriogenology,2001,55(5):285.
[25] Bochenek M, Katska L, Kania G, et al. Cell cycle analysis of somatic cell lines in the cloning of the domestic cat[J]. Theriogenology,2001, 55: 256.
[26] Kuhholzer B, Hawley R J, Lai L, et al. Clonal lines of transgenic fibroblast cells derived from the same fetus result in different development when used for nuclear transfer in pigs[J]. Biol Reprod, 2001, 64(6): 1 695-1 698.
[27] Hyun S H, Lee G S, Kim D Y, et al. Effect of maturation media and oocytes derived from sows or gilts on the development of cloned pig embryos[J]. Theriogenology, 2003,59:1 641-1 649.
[28] Koo D B, Kang Y K, Choi YH, et al. In vitro development of reconstructed porcine oocytes after somatic cell nuclear transfer J[J]. Biol Reprod, 2000, 63 (4):986-992.
[29] 张运海.利用体细胞核移植技术生产猪克隆胚胎的研究[D].北京:中国农业大学,2005.
[30] Vignon X, LeBourhis D, Chesne P, et al. Development of bovine nuclear transfer embryos reconstituted with quescent and proliferative skin fibroblasts[J].Theriogenology,1999, 51(1): 216.
[31] Cibelli J B, Stice S L, Golueke P J, et al. Cloned transgenic calves produced from nonquiestent fetal fibroblasts[J]. Science, 1998, 280: 1 256-1 258.
[32] Enright B P, Jeong B S, Yang X, et al. Epigenetic characteristics of bovine donor cells fore nuclear transfer: levels of histone acetylation[J]. Biol Reprod,2003,69:1 525-1 530.
[33] Liu L, Wang M K ,Chen D Y. Packged nuclear transfer (PNT)-bovine oocyte as mid-vehicle in mouse serial cloning[J]. Theriogenology,2001,55:279.
[34] Guo J T, An Z X, Li Y,et al. Cloned goats (Capra hircus ) from adult ear cells[J]. Science China,2002,45:260-267.
[35] 王立芳.首例冷冻胚胎亚种间克隆水牛在广西诞生[J].广州医学院学报,2008,23(2):39.
[36] 王启凤,王 锋.消毒处理及培养方法对SD大鼠尾尖皮肤成纤维细胞原代培养的影响[C]∥第二届全国动物胚胎生物技术暨第九届兽医产科学研讨会论文集.2003:164-167.
[37] 刘冀珑,王敏康,廉 莉,等.非休眠期成年牛耳成纤维细胞用于核移植[J].科学通报,1999,44(12):1 284-1 287.
[38] 王红梅,黄俊成,刘明军,等.利用动物耳皮肤组织培养成纤维细胞的研究[J].草食家畜,2001(S2):210-214.
[39] 李雪峰.牛卵母细胞孤雌激活与体细胞核移植[D].陕西杨凌:西北农林科技大学,2001.
[40] 任芳丽,李 熤,张 涌,等.牛皮肤成纤维细胞的体外培养与冻存[J].黄牛杂志,2002,28(1):8-10.
[41] 蔡文琴.现代实用细胞与分子生物学实验技术[M].北京:人民军医出版社,2003:3-8.

