溶剂萃取法净化含钒溶液的研究现状
张菊花,张 力,张 伟,杨丽梅,张 武,顾松青
(1.东北大学 材料与冶金学院,沈阳 110819;2.中国铝业股份有限公司 郑州研究院,郑州 450041)
钒作为一种重要的战略资源,应用非常广泛[1].目前,除传统的钠化焙烧—水浸工艺外,有代表性的新提钒工艺有钙化焙烧提钒、无盐焙烧提钒、直接酸浸提钒和碱熔法提钒.一般提钒原料不同,采用的处理方法也不同,但大体都包括焙烧—浸出—净化—沉钒或浸出—净化—沉钒这几个工序,其中钒溶液的净化直接决定终产品的质量,因此,对钒液净化的研究至关重要.
目前常用的净化方法有化学沉淀,溶剂萃取和离子交换.其中,由于溶剂萃取法选择性强、处理能力大、平衡速度快,产品纯度高,从而受到广泛关注[2].国外在工业上应用萃取法提钒始于1956年,我国在这方面研究也较多,其主要致力于萃取剂、反萃剂、稀释剂的选择,以及含钒溶液体系、萃取平衡时间、杂质元素、萃取和反萃级数对钒回收率及钒与其他元素分离系数的影响.
1 含钒溶液中钒离子的存在状态
溶液中钒的存在形式直接影响其在萃取过程中的行为.钒在溶液中的聚合状态不仅与溶液pH值有关,也与溶液中钒的浓度密切相关.如图1所示,低浓度钒(c(V)<10-4mol·L-1)在所有 pH值范围内均以单核形式存在,在pH=1~3时,主要以存在,随pH升高,逐渐转化为HVO3.浓度较高时生成高聚合度的同多酸根离子,聚合的状态与pH有关.在一定的钒浓度下,碱性和弱碱性溶液中钒以、、和阴离子的形式存在;当溶液接近中性时,钒以四聚体的偏钒酸根离子()存在;弱酸性和酸性溶液中存在的是各种多钒酸根离子;当溶液pH<1时,多聚钒酸根离子遭到破坏而以离子的形式存在.图2为钒溶液的E-pH图,从图中看出仅在高电位和pH<2下稳定存在;随pH升高,V(Ⅴ)以一系列阴离子形式存在,根据pH不同,依次发生去质子化,形成和;随电位下降,在pH<4的溶液中,钒依次以 VO2+、V3+、V(OH)2+和 V2+阳离子形式存在.
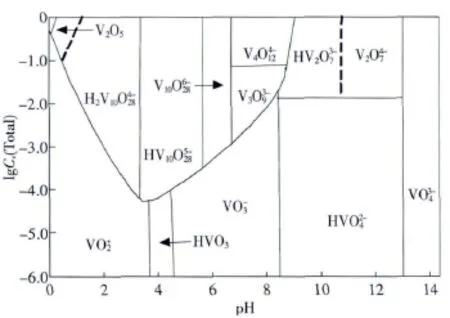
图1 溶液中五价钒在不同pH和钒浓度下的聚合状态[3,4]Fig.1 Vanadium species distribution diagram for different pH and vanadium concentrations
2 溶剂萃取法净化含钒浸液
常用于萃取钒的萃取剂主要是有机磷型萃取剂和胺类,如表1所示.阳离子型萃取剂适用于从酸性溶液中萃钒,因为在低pH范围内,溶液中钒以阳离子形态稳定存在.碱性长链氨基烷适用于从阳离子形态不占主导地位的溶液中萃取阴离子聚合物,而长链季胺盐能用于萃取中性和碱性溶液中的阴离子聚合物.由于钒离子在浸出液中常以+4和+5价存在,且其聚合物的聚合度与溶液pH值及含钒浓度密切相关,因此应根据溶液体系和钒价态来选择合适的萃取剂.

图2 钒离子和钒化合物在水溶液中的稳定区图(25 ℃,100 kPa)[5]Fig.2 E-pH diagram for V-H2O system at 25℃and 100 kPa

表1 常用萃取钒的有机磷类和胺类萃取剂Table 1 Commonly used organophosphorus and amine extractants for vanadium extraction
溶剂萃取含钒溶液的流程如图3所示.
2.1 溶液pH值对钒萃取率的影响
由于溶液pH值决定了聚合物的价态,因而其对金属螯合物的形成和后续萃取效果起着极其重要的作用.不同萃取剂萃取钒的最佳pH范围如表2所示.
P204,P507和Cyanex 272属于磷型萃取剂,常用于酸性溶液体系中.它们对V(Ⅳ)的萃取性能优于V(Ⅴ),因此在萃取前常用Na2SO3将V(Ⅴ)还原为V(Ⅳ).
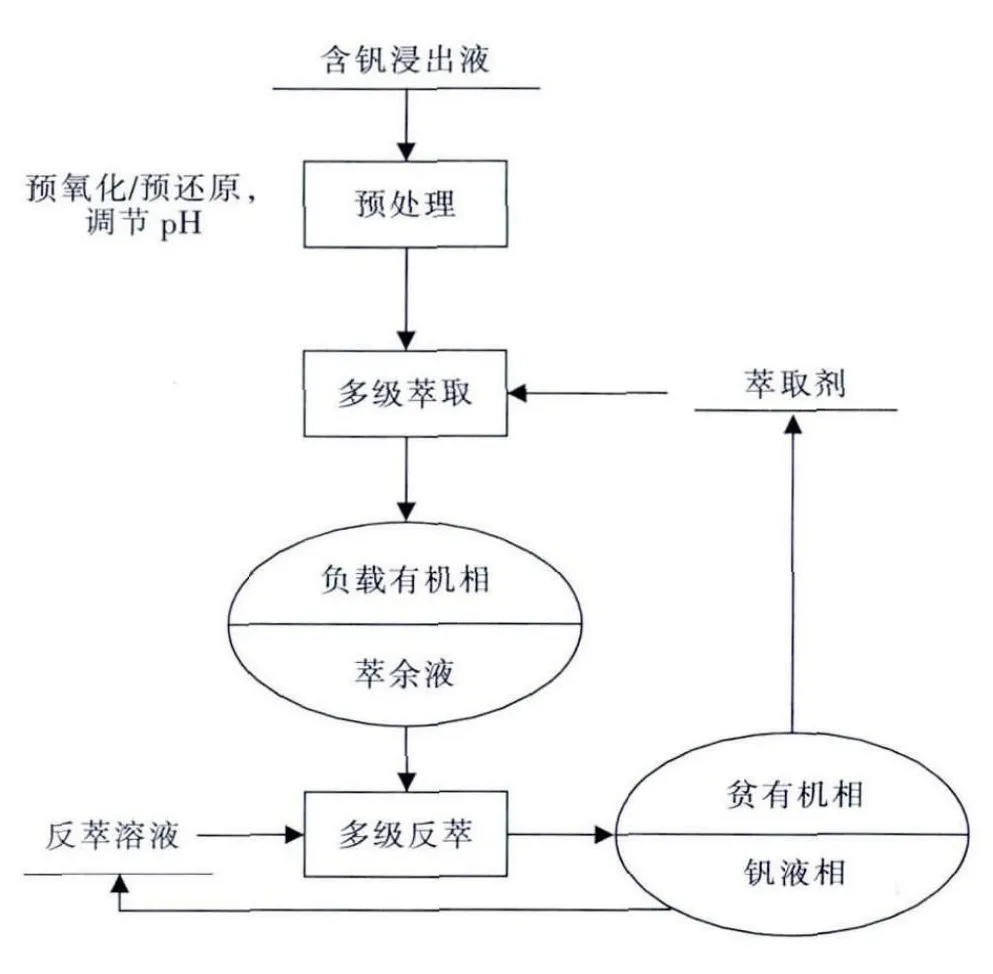
图3 溶剂萃取钒的流程图Fig.3 Flowchart of vanadium solvent extraction
许多文献就溶液pH值对有机磷型萃取剂从酸性溶液中萃取钒的影响进行了研究.Xingbin Li[7]等人发现在 O/A(有机相/溶液)比值为 1.0的条件下,用P204和TBP萃取V(Ⅳ),当pH从1.5升高到3.2时,萃取率由17%增加到83%.Wang Li[6]得到了同样的趋势,但最优pH范围有所不同,当pH从0.5增加到1.5时,V(Ⅳ)的萃取率显著升高,当pH超过1.5后,增加幅度不明显;也有研究[22]表明当溶液pH值高于2,V(Ⅳ)萃取率不再增加.这3篇文献中所得的最优pH范围存在的差距主要归因于实验中含钒溶液的V(Ⅳ)浓度和萃取剂浓度的不同,以及O/A比值的不同.尽管如此,当初始溶液 pH值高于2.5时,由于Al(Ⅲ)和Fe(Ⅲ)的水解以及SiO2的生成,溶液中会出现三相,从而导致钒损失增加.TBP作为一种相调节剂,适量添加可以抑制三相形成.TBP对钒萃取率影响不大,但添加5%或高于 5% 的 TBP,两相分离时间将大大缩短[7,8,22].同样对于P507,当溶液初始pH从1到3时,钒萃取率也会明显增加[10].同前两种磷型萃取剂一样,当平衡pH值在0.9~2.0之间逐渐增加时,V(Ⅳ)在Cyanex 272的分配比会随之升高,但当硫酸根浓度在0.1~2.5 mol·L-1之间变化时,其对钒分配比没有影响,这表明硫酸根在此浓度范围内不参与萃合物的形成[11].
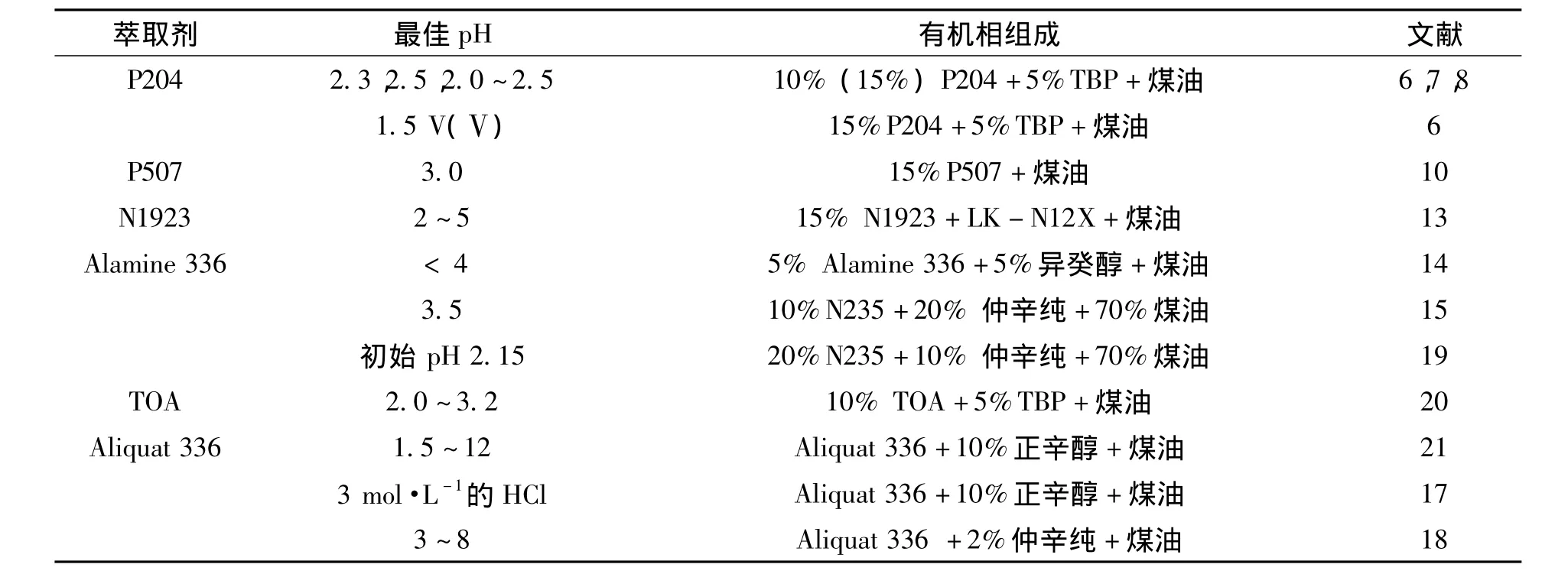
表2 不同类型萃取剂萃取钒的最佳pH值范围Table 2 Optimum pH range for different extractants to extract vanadium
如图2所示,在低 pH范围内,钒主要以VO2+阳离子形式稳定存在,随着pH值升高,钒阳离子逐渐转化为中性钒化合物和钒阴离子.由于这3种萃取剂萃取V(Ⅳ)的机理都是通过阳离子交换,因此中性钒化合物和钒阴离子不能被酸性有机磷类萃取剂萃取.
酸性磷型萃取剂萃取钒的萃取反应如式(1)所示:

其中(HA)2表示阳离子萃取剂,2n表示反应释放的H+数目.
当平衡酸度较高时,1 mol二聚物参与萃取反应,反之,则 2 mol二聚物参与反应[23].
关于磷型萃取剂萃取V(Ⅴ)的研究报道较少.Wang Li发现当 pH从0.5升高至1.5时,V(Ⅴ)的萃取率随之增加,但pH继续增加时,萃取率开始下降,这是由于阳离子只能在pH低于2.0 的溶液中稳定存在[6].Kasikova[9]考察了当溶液酸度较高时,酸浓度对煤油体系中 P204及Cyanex 272萃取V(Ⅴ)的影响,结果显示当硫酸浓度在0.5~10 mol·L-1之间变化,酸浓度为1~4 mol·L-1时萃取率最低,这是因为在萃取过程中,除阳离子交换外,萃取剂的两个官能团—PO和—OH也参与了萃取反应,产生协萃效应,且该协萃效应会随溶液酸度增加而加强.
胺类属阴离子萃取剂,适用于萃取溶液中的钒酸根阴离子,因只有五价钒可形成钒酸根阴离子,所以用胺类萃取剂萃取前需将溶液中的钒全部氧化为V(Ⅴ).
Alamine 336(N235)仅限于在pH低于4的含钒溶液中使用,其pH50(分配比为1时的平衡水相 pH 值)为 4.67[14].当 pH 降低时,N1923 萃取性能减弱,且在钒浸出液中,界面沉淀物生成量在低pH时也达到最大,进而影响萃取性能,但是N1923可以通过溶剂化作用萃取中性溶液中V(Ⅴ)[24].TOA的较佳萃取酸度范围为pH 2.0~3.2,但 Chagnes[25]发现以十三醇为相调节剂,正十二烷为稀释剂时,TOA可通过阴离子交换从较高酸度的硫酸介质中萃取少量V(Ⅴ),这是由于在pH<2的硫酸溶液中,V(Ⅴ)同时以和VO2两种形态存在.该现象与Zhou Xuejiao[26]和Rakib[3]等的热力学计算结果一致,在钒浓度低于10-4mol·L-1的硫酸溶液中,VO2SO-4 在25℃时的生成常数为log β1=1.30±0.02.同理,由于硫酸根与的生成物不能被1-癸醇萃取,因此该物质的生成会降低V(Ⅴ)在阳离子萃取剂上的分配比.
因为只有V(Ⅴ)在溶液中能以阴离子状态存在,所以亲脂性胺类只能有效萃取酸性介质中的钒(通常pH为1.5~4),但高分子季铵盐可在较广泛的 pH 范围内 发 挥 作 用.Aliquat 336(N263)可以在pH为2~8范围内高效萃取V(Ⅴ)[27],但在一定酸度范围内,不同的矿物酸介质对其萃取V(Ⅴ)的效果会产生不同的影响.在0.5 ~4 mol·L-1的 HCl介质中,V(Ⅴ)的萃取率在HCl浓度为3 mol·L-1时达到最大值为60%,相同条件下,在H2SO4和HNO3介质中萃取率均不超过10%.酸度固定时,Cl-的浓度 从3 mol·L-1增加到 5 mol·L-1时,钒萃取率随之降低,这是因为萃取反应会释放4个Cl-.在碱性介质中使用Aliquat 336时,要用NaOH溶液将Cl-Aliquat 336转化为HO-Aliquat 336,且其在碱性介质中的钒萃取率随NaOH浓度升高而降低[17].由于 Primene JM -T(伯胺)、Alamine 336和Alamine 304(叔胺)以及 Amberlite LA-2(仲胺)的萃取性能与溶液中钒的存在状态密切相关,随pH升高,这些萃取剂在pH=1或pH=3时萃取率出现最大值,而Aliquat 336对钒的萃取率则是随pH升高逐渐增加[28].1 mol Aliquat 336对不同类别的钒阴离子萃取量差别很大,最多可差7.5倍.钒阴离子的价数为z,钒原子数为n,若n/z值大,萃取量亦大,经过计算,pH在2.4~6.2时萃取率较大[18].
2.2 稀释剂对钒萃取率的影响
不同稀释剂对 P204、P207和 Cyanex 272萃取V(Ⅳ)的影响见表3.从表中看出,P204和P507在煤油和正己烷中萃取性能最佳,在苯,甲苯,环己烷和四氯化碳中萃取性能较差.相反,Cyanex 272溶于苯,甲苯,四氯化碳时的萃取率高于在环己烷,煤油,正己烷的萃取率.这是由于稀释剂可在萃取过程中与萃取剂形成复合物,进而影响萃取剂的萃取性能.
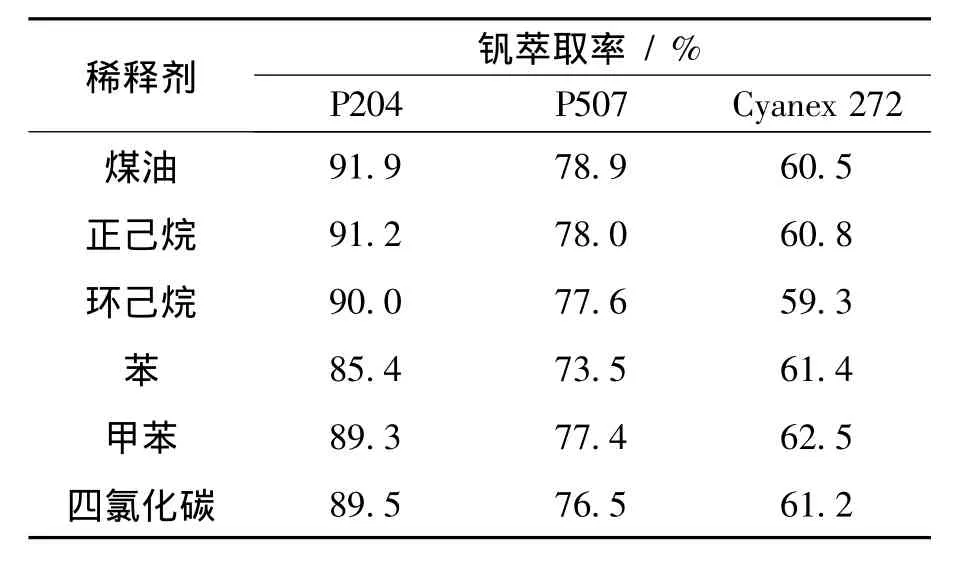
表3 稀释剂对P204、P207和Cyanex 272萃取钒的影响Table 3 Effect of diluents on vanadium extraction with P204,P207 and Cyanex 272[12]
Kasikova[9]对比了中性含氧化合物和惰性稀释剂对P204和Cyanex 272萃取V(Ⅴ)的影响.研究发现,当含钒溶液酸度不同时,含氧稀释剂对烷基磷酸的萃取性能产生的影响不同.当溶液中硫酸浓度低于2 mol·L-1时,按钒萃取率由高到低的顺序,稀释剂对P204的影响为煤油>辛醇≈异辛醇≈正癸醇>辛酮,对Cyanex 272的影响为煤油>辛酮>正癸醇=异辛醇=辛醇.只有一种酮对Cyanex 272的萃取性能产生积极的影响,这是因为酮上面的 C=O基团吸引电子,使得Cyanex 272的质子移动性增强,进而增强其与金属阳离子的交换能力.在高浓度矿物酸中,有机磷酸在脂肪醇中的萃取性能明显高于在惰性稀释剂中,其中在异辛醇的萃取率要高于在正癸醇和辛醇中.
胺类萃取剂的聚合程度与稀释剂的极性有关,极性越小,萃取剂聚合程度越高(通常为二聚物),钒的分配比就越高,萃取率也越高.通常煤油和正十二烷用作胺型萃取剂萃取V(Ⅴ)的稀释剂.
2.3 萃取平衡和萃取动力学
P204、P507和Cyanex 272萃取V(Ⅳ)的过程为放热反应,其反应△G均为负值,0.1 mol·L-1的P204、P507和Cyanex 272的pH50分别为1.17、1.42和1.72,因此这3种萃取剂的萃取性能为P204 > P507 >Cyanex 272[12].考虑到V(Ⅳ)与硫酸根的结合,当 V(Ⅳ)离子活度 α=0.95时,P204萃取V(Ⅳ)的平衡常数为(1.86±0.02)× 10-1[29].
在惰性稀释剂中,萃取V(Ⅴ)的强弱顺序为P204(工业纯)<P204(精制)<Cyanex 272.萃取剂的碳链影响其萃取性能和选择性,Cyanex 272的第四个碳上有多于两个取代基(甲基),表明其对钒的选择性比P204高.但在弱酸性溶液中,由于阳离子交换起主要作用,P204的萃取性能优于Cyanex 272,这是因为P204上的两个酯基(—OR)吸引羟基上的电子,从而使质子移动性增强.
由于同时拥有质子给予方(-OH)和质子接受方(P=O),精制的有机磷酸在惰性稀释剂中极易形成二聚物,氢键的增加会阻碍V(Ⅴ)与萃取剂的作用官能团结合,从而降低了萃取剂的热力学活性.添加活性试剂,中性含氧试剂,如TBP、亚砜、酮类和醇类能改变有机磷酸的二聚程度,并且提高其萃取活性[9].如石油亚砜对 P204萃取(Ⅴ)有明显的协萃效应,其萃取反应如式(2)[30]所示:
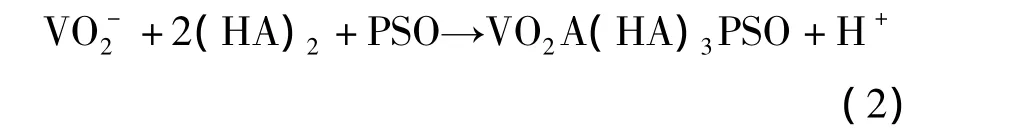
该协萃反应的平衡常数为3.34,高于P204在低酸度HCl溶液中的萃取平衡常数.
此外,磁场能显著提高TOA的萃取性能[31],与机械搅拌相比,超声波能够促进溶液相和有机相界面的乳化,从而提高V(Ⅴ)的萃取率[32].
Navarro[28]发现与 Primene JM - T、Alamine 336、Alamine 304、Amberlite LA -2 相比,pH=3时,萃取剂Aliquat 336的消耗量最少.Aliquat 336在碱性溶液(pH>10)和酸性溶液(pH<2)中的萃取平衡常数分别为(2.5±0.21)×103和(5.50±0.56)×102,在15~45℃,反应的 ΔH 值均为正值,说明在两种介质中的萃取反应均为吸热反应.当 Aliquat 336浓度为 0.5 mol·L-1,钒质量浓度为1 g/L 时,在 3 mol·L-1的 HCl溶液中反应的ΔG为负,在 0.1 mol·L-1NaOH 溶液中的 ΔG为正[17].
不同萃取剂萃取钒反应达到平衡所需的时间如表4所示.

表4 萃取钒反应达到平衡所需时间Table 4 Time for the vanadium extraction to reach equilibrium
有机磷萃取剂和胺类萃取钒的萃取反应达到平衡时间均少于15 min.但是,通常单级萃取并不能取得理想的钒回收率.以P204为例,10%P204和5%TBP溶于煤油中,其McCabe-Thiele曲线表明,在O/A为1∶1的条件下,理论萃取级数为6[7].在 O/A 比为 1:2 的条件下,接触时间10 min,仅95.94%的钒被萃取,经过六级逆流萃取,负载相中钒质量浓度为7.56 g/L,萃余液中钒为0.16 g/L[8].P507 萃取 V(Ⅳ)的 McCabe -Thiele曲线表明,在O/A比为1∶1的条件下,理论萃取级数为 3[10].
Ei- Nadi[17]比较了 Aliquat 336 从碱性和酸性溶液中萃取钒的性能,研究表明随萃取级数的增加,有机相上负载钒含量不断增加,当萃取12级后,从碱性溶液中萃取的钒含量为酸性溶液的两倍.当溶液中初始钒的质量浓度为3.88 g/L时,Primene 81R和Alamine 336的理论萃取级数为2,此时萃余液中钒的质量浓度低于0.001 g/L[14].
2.4 萃取剂对钒离子和溶液中其他杂质离子选择性的影响
不同萃取剂对钒离子和溶液中其他杂质离子的选择性见表5.
由表可见,磷型萃取剂和胺类基本上可以把含钒溶液中常以阳离子形式存在的Ca,Mg,Al,Fe和以阴离子形式存在的Mo,Cr,Si,P与钒分离开,其他类型萃取剂如羟肟萃取剂LIX63和8-羟基喹啉也表现出良好的选择性.

表5 不同萃取剂对钒及其他杂质离子的选择性Table 5 Selectivity for vanadium and the other impurities of different extractants
P204对金属离子的萃取性能由强到弱的顺序为:Fe3+>VO2+>>Ca2+>Mn2+>Mg2+>Fe2+> K+≈Na+[34,35].在中性溶液中,伯胺可以通过溶剂作用优先萃取钒而不萃取Cr,二者的分离系数可达170[24].由于萃取反应平衡和反应动力学的差异,P507可以将低酸度溶液中的Mo、V与Al分离,之后负载相上的Mo和V可通过不同的反萃剂(NH4OH+NH4Cl溶液和纯酸溶液)分步反萃分离[36].
0.5 mol·L-1的 LIX 63 溶于 Shellsol 70 中,在A/O为1∶1的条件下,几乎能够全部萃取出pH为1~2的硫酸溶液中的V(Ⅴ)和Mo(Ⅵ),而对溶液中Ni(Ⅱ),Co(Ⅱ),Fe(Ⅲ)和Al(Ⅲ)的萃取可以忽略[33].用8-quinolinol萃取酸性溶液中V(Ⅴ),当钒回收率超过97%时,其他杂质元素Ca(Ⅱ),Mg(Ⅱ),Al(Ⅲ),Fe(Ⅲ),Cu(Ⅱ)和Cr(Ⅵ)的萃取率都低于0.2% ~0.3%[32].
2.5 反萃过程的影响
常用于钒液萃取净化反萃过程的反萃剂及其反萃效果如表6所示.

表6 从不同负载钒有机相上反萃钒Table 6 Stripping vanadium from loaded organic phases
一般采用纯酸溶液多级反萃从负载有机磷萃取剂上反萃钒,且随反萃级数增加,反萃率增高[7,10].酸浓度对反萃率的影响实验表明当酸浓度从 0.5 mol·L-1增加到 2.5 mol·L-1时,反萃率从41%提高到98%,但是,随之反萃液中自由H2SO4浓度也增加,这是萃取过程中要避免的,因此必须综合考虑钒反萃率和反萃液中自由酸度来选择适宜的酸浓度[7].反萃过程可以进一步将钒与其他伴随的杂质金属离子分离.采用15%H2SO4溶液洗涤金属-P204负载有机相,在O/A比为5∶1,温度45℃,时间15 min的条件下,经过5级逆流反萃,钒、铁反萃率分别为99.14%和19.35%,反萃溶液中m(V)/m(Fe)的比值为62,分离效果良好[8].贫有机相经过 NH4HCO3溶液洗涤除铁—水洗—再酸化可实现再生利用.
从负载钒的高分子季铵盐相上反萃钒比较困难,其反萃速度慢.尽管采用1 mol·L-1NaOH 溶液可以将Aliquat 336从酸性和碱性介质中萃取的钒洗涤下来[17],且该反应在热力学上可行,但其反应速率较慢.研究表明多钒酸根H2V10O4-28转化为和(或)为其反应速率限制性步骤[21].Navarro[28]发现采用浓度较高的氨水和铵盐的混合溶液洗涤(e.g.1.5 mol·L-1NH3+1.5 mol·L-1NH4NO3/NH4Cl)可以取得较高的反萃率,而浓度低的混合液(e.g.1.0 mol·L-1NH3+1.0 mol·L-1NH4NO3/NH4Cl)或 1 mol·L-1NaOH只能释放部分钒.用铵水和铵盐混合溶液洗涤负载钒有机相时,会生成NH4VO3沉淀,NaCl溶液可有效避免沉淀生成.氯化物溶液反萃钒的同时可实现萃取剂再生,而在同样条件下,经NH4NO3溶液洗涤再生的硝酸型萃取剂的萃取性能将远低于原萃取剂[18].
此外,添加剂 KBr、NaBrO3、HNO3等添加剂和使用超声波可以大大缩短NaOH溶液从负钒有机相上反萃V(Ⅴ)的时间.研究表明,通过机械搅拌方式,反萃率达到91%需要60 min,而加添加剂后,采用超声搅拌,取得97%的反萃率仅需5 min[32].
3 结语
常用的钒萃取剂是有机磷型萃取剂和胺类,有机磷型萃取剂属于阳离子萃取剂,适用于提取酸性溶液中的V(Ⅳ)和V(Ⅴ),且随pH升高,萃取率增大,但是当pH大于2.5时,会形成三相或出现沉淀物.胺类只用于萃取以阴离子形式存在的V(Ⅴ),其中伯胺,叔胺适用于pH大于2的弱酸性溶液,而大分子季铵盐使用的pH范围则较广,可以萃取中性和碱性溶液中的钒.萃取平衡时间较短,但是通常需要多级萃取才能取得满意的钒回收率.负载酸性有机磷相的反萃过程使用酸溶液,负载胺类使用碱性溶液洗涤反萃,通常反萃率均可达99%,但是负载季铵盐的反萃过程比较困难,其速率较慢.
溶剂萃取处理量大,便于连续、自动化操作,选择性高,用于钒液净化可以高效富集、分离钒,得到的终产品纯度高,但其操作条件苛刻,易受溶液中杂质离子的影响而出现三相或产生沉淀,且常用的萃取剂和稀释剂价格较高,易挥发,易燃.此外,反萃过程和萃取剂再生过程要消耗大量的酸碱.因此,开发安全环保、价格低廉的萃取剂和稀释剂,寻求高效的相调节剂和协萃剂非常必要,同时对于含有少量有机相的萃余液以及反萃、洗涤过程排放出的大量酸、碱液的综合利用也应给予足够的重视.
[1]廖世明,柏谈论.国外钒冶金[M].北京:冶金工业出版社,1985:4 -19,143,147.
(Liao Shiming,Bo Tanlun.Foreign vanadium metallurgy[M].Beijing:Metallurgical Industry Press,1985:4 -19,143,147.)
[2]叶国华,童雄,路璐.含钒钢渣资源特性及其提钒的研究进展[J].稀有金属,2010,34(5):769 -775.
(Ye Guohua,Tong Xiong,Lu Lu.Resource characteristics of
vanadium-bearingsteel slagandprogress inextracting vanadium from it[J].Chinese Journal of Rare Metals,2010,34(5):769 -775.)
[3]Rakib M,Durand G. Studyofcomplexformation of vanadium(Ⅴ)with sulphate ions using a solvent extraction method[J].Hydrometallurgy,1996(43):335 -336.
[4]张青莲,申泮文.无机化学丛书-钛分族,钒分族,铬分族[M].北京:科学出版社,1991:288.
(Zhang Qinglian,Shen Banwen.Inorganic chemical seriestitanium,vanadium and chromium groups[M].Beijing:Science Press,1991:288.)
[5]陈云.碱性体系中铝钒钼的溶液化学性质及分离技术研究[D].长沙:中南大学,2006:37-38.
(Chen Yun.Solution chemistry& separation technology of aluminum,vanadium and molybdenum in alkaline solution[D].Changsha:Central south university,2006:37-38.)
[6] Wang Li,Yimin Zhang,Tao Liu,et al.Comparison of ion exchange and solvent extraction in recovering vanadium from sulfuric acid leach solutions of stone coal [J].Hydrometallurgy,2013(131-132):1-7.
[7] Xingbin Li,Chang Wei,Zhigan Deng,et al.Selective solvent extraction of vanadium over iron from a stone/black shale acid leach solution by D2EHPA/TBP[J].Hydrometallurgy,2011(105):359-363.
[8] Deng Zhigan,Wei Chang,Fan Gang,et al.Extracting vanadium from stone-coal by oxygen pressure acid leaching and solvent extraction [J].Transactions of Nonferrous Metals Society of China,2010(20):s118-s122.
[9] Kasikova N I,Kasikov A G,Kalinnikov V T.Effect of diluents on the extractive capacity of organophosphoric acids in vanadium(Ⅴ)recovery from sulfuric acid solutions[J].Russian Journal of Applied Chemistry,2007,80(6):868-873.
[10] Xingbin Li,Chang Wei,Jun Wu,et al.Co - extraction and selective stripping of vanadium(Ⅳ)and molybdenum(Ⅵ)from sulphuric acid solution using 2-ethylhexyl phosphoric acid mono-2 -ethlhexyl ester[J].Separation and Purification Technology,2011(86):64-69.
[11] Saily A,Tandon S N.Liquid-liquid extraction behavior of V(Ⅳ)using phosphinic acids as extractants[J].Fresenius J Anal Chen,1998(360):266-270.
[12] Li Xingbin,Wei Chang,Wu Jun,et al.Thermodynamics and mechanism of vanadium(Ⅳ)extraction from sulfate medium with D2EHPA,EHEHPA,CYANEX 272 in kerosene[J].Transactions of Nonferrous Metals Society of China,2012(22):461-466.
[13] PenggeNing, Hongbin Gao, Chenming Liu, etal.Characterization and prevention of interfacial crud produced during the extraction of vanadium and chromium by primary amine[J].Hydrometallurgy,2009(97):131 -136.
[14] Lozano L J, Godinez C. Comparative study of solvent extraction of vanadium from sulphate solutions by primene 81R and alamine 336 [J].Minerals Engineering,2003(16):291-294.
[15] Dongsheng He,Qiming Feng,Guofan Zhang,et al.An environmentally-friendly technology of vanadium extraction from stone coal[J].Minerals Engineering,2002(20):1184-1186.
[16] Alexandre Chagnes,Marie - Noelle Rager,Bruno Courtaud,et al.Speciation of vanadium(Ⅴ)extracted from acidic sulfate media by trioctylamine in n-dodecane modified with 1-triedcanol[J].Hydrometallurgy,2010(104):20 -24.
[17] EI-Nadi Y A,Awwad N S,Nayl A A.A comparative study of vanadium extraction by aliquat-336 from acidic and alkaline media with application to spentcatalyst[J].Mineral Processing,2009(90):115-120.
[18]刘波,冯光熙,黄祥玉.用N-263从钒溶液中回收钒[J].化学研究与应用,2003,15(1):54 -57.
(Liu Bo, Feng Guangxi, Huang Xiangyu. Recovery of vanadium pentoxide from contained vanadium solution with Methytri(C9-11alkyl)ammonium chloride [J].Chemical Research and Application,2003,15(1):54 -57.)
[19] Yun Chen,Qiming Feng,Yanhai Shao,et al.Investigations onthe extraction ofmolybdenum and vanadium from ammonium leaching residue of spent catalyst[J].International Journal of Mineral Processing,2006(79):42-48.
[20]张云,范必威,彭达平.从石煤酸浸液中萃取钒的工艺研究[J].成都理工学院学报,2001,28(1):107 -110.
(Zhang Yun,Fan Biwei,Peng Daping,et al.Technology of extracting V2O5from the stone coal acid-leaching solution with TOA [J].Journal of Chengdu University of technology,2001,28(1):107-110.)
[21] Bal Y,Bal K E,Cote G.Kinetics of the alkaline stripping of vanadium(Ⅴ)previously extracted by Aliquat 336 [J].Minerals Engineering,2002(15):337-397.
[22]朱军,郭继科,马晶,等.从含钒石煤酸浸液中溶剂萃取钒的试验研究[J].湿法冶金,2011,30(4):293 -297.
(Zhu Jun,Guo Jike,Ma Jing,et al.Solvent extraction of vanadium from acidic leaching solution of stone coal[J].Hydrometallurgy of China,2011,30(4):293 -297.)
[23]《有色金属提取冶金手册》编委会.有色金属提取冶金手册(下)[M].北京:冶金工业出版社,2002:327,330-331.
(Editorial Board of a handbook for extraction metallurgy of nonferrous metals.A handbook for extraction metallurgy of nonferrous metals[M].Beijing:Metallurgical Industry Press,2002:327,330 -331.)
[24] PenggeNing, Hongbin Gao, Chenming Liu, etal.Characterization and prevention of interfacial crud produced during the extraction of vanadium and chromium by primary amine[J].Hydrometallurgy,2009(97):131 -136.
[25] Alexandre Chagnes,Marie - Noelle Rager,Bruno Courtaud,et al.Speciation of vanadium(Ⅴ)extracted from acidic sulfate media by trioctylamine in n-dodecane modified with 1-triedcanol[J].Hydrometallurgy,2010(104):20 - 24.
[26] Xuejiao Zhou, Chang Wei, Minting Li, et al.Thermodynamics of vanadium-sulfur-water systems at 298K[J].Hydrometallurgy,2011(108):104 -112.
[27]Bal Y,Cote G,Bauer D.The peculiarities of molybdenum(Ⅵ)and vanadium(Ⅴ)extraction by lipophilic quaternary ammonium salts[C] //In:Sekine,T(Ed),Solvent Extraction 1990,Part A,Process Metallurgy,vol 7A.Elsevier Amsterdam,1992:919-924.
[28] Navarro R,Guzman J,Saucedo I,et al.Vanadium recovery from oil fly ash by leaching,precipitation and solvent extraction process[J].Waste Management,2007(27):425 - 438.
[29] Kurbatova L D, KurbatovD I. Extraction recoveryof vanadium(Ⅳ)from acid sulfate solutions with Di-(2-ethylhexyl)phosphoric acid[J].Russian Journal of Applied Chemistry,2010,83(6):1093-1095.
[30]古国榜,程飞,杨新荣,等.P204-PSO协同萃取钒(Ⅴ)的机理[J].华南理工大学学报(自然科学版),1997,25(2):85-90.
(Gu Guobang,Cheng Fei,Yang Xinrong,et al.Mechanism of synergistic extraction of vanadium(Ⅴ)by P204 and PSO[J].Journal of South China University of Technology(Natural Science),1997,25(2):85-90.)
[31]马荣骏,邱电云,马文骥.磁场作用下三辛胺萃取钒的机理研究[J].湿法冶金,1997(4):20 -22.
(Ma Rongjun,Qiu Dianyun,Ma Wenji.Mechanism of vanadium extraction with trioctylamine in magnetic field [J].Chinese Hydrometallurgy,1997(4):20 -22.)
[32] Susumu Kawakubo,Yoshihiko Tsuchiya,Masaaki Iwatsuki.Extraction with 8-quinolinol and mixed anionic addictives using ultrasonic irradiation for the catalytic determination of vanadium in freshwaters[J].Analytical Chimica Acta,1995(310):501-507.
[33] Li Zeng,Chu Yongcheng.Recovery of molybdenum and vanadium from synthetic sulphuric acid leach solutions of spent hydrodesulphurization catalysts using solvent extraction [J].Hydrometallurgy,2010(101):141-147.
[34]邓志敢,魏昶,李旻廷,等.石煤氧压酸浸萃钒除铁工艺研究[J].稀有金属,2009,33(2):290 -294.
(Deng Zhigan,Wei Chang,Li Minting,et al.Technology of extracting vanadium and removing iron from stone-coal oxygen pressure acid-leaching solution[J].Chinese Journal of Rare Metals,2009,33(2):290 -294.)
[35] Chu Yongcheng.Purification of synthetic laterite leach solution by solvent extraction using D2EHPA [J].Hydrometallurgy,2000(56):369-386.
[36] Zhang P W,Inoue K,Yoshizuka K.A new solvent extraction process for recovery of rare metals from spent hydrodesulfurization catalysts [J]. Kagaku kogaku Ronbunshu,1997,23(1):1-10.

