抗VEGF单克隆抗体Fab片段在大肠杆菌的表达①
霍世元 朱文华 滕 凌 叶亚东
(常州亚当生物技术有限公司,常州213022)
1971年,美国科学家福克曼(Judah Folkman)在《新英格兰医学杂志》中提出,抗血管生成可能是一种有效的抗癌手段[1]。从七十年代早期开始,以这个前瞻性的假说为基础,福克曼及其研究小组致力于从人体和动物的肿瘤中分离某种“肿瘤血管生成因子”[2]。1978年,Gullino也提出了抑制血管生成能避免癌症的观点[3]。随后,多种血管源因子如表皮生长因子 EGF,转化生长因子 TGF-α、TGF-β,肿瘤生长因子TNF-α和血管生长素等先后被发现[4]。
由于与传统的抗癌治疗相比,抗血管生成治疗具有许多优点。因此在过去的三十多年中,人们一直在努力寻找合适的靶点以阻断和破坏肿瘤血管生成,研制有效的抗肿瘤血管生成药物,近年来取得了许多令人鼓舞的成绩。血管内皮生长因子(Vascular endothelial growth factor,VEGF)正是这样一个血管生成的关键调节因子[5],现已成为抗血管生成抗肿瘤治疗的新靶点。2004年,第一个靶向VEGF抗肿瘤血管生成的抗体药物——安维汀(Bevacizumab,Avastin)获得 FDA批准上市,2012年销售额已突破60亿美元,成为安进的明星级重磅炸弹药物。我国已有以VEGF为靶点的新型抗体的研究报道,但无相关生产工艺专利。而进口药物价格高,尚未满足国内临床需求。
经过多年的艰苦研发,我们自主研制出一个抗VEGF的治疗性单抗药物,命名为眼明(Vasculizumab),已经获得国家发明专利授权(抗VEGF单克隆抗体 Fab片段 Vasculizumab及其应用,ZL201110225852.7)。前期研究结果表明其对VEGF有良好的靶向作用,主要用于治疗视网膜病变、老年性黄斑病变等眼底疾病。眼明是一个Fab片段,分子量相对大分子全抗体较小,通透性强,并且利用原核系统大肠杆菌进行表达,可降低大规模生产的成本。本研究通过基因合成该Fab片段,在此基础上构建共表达载体pET21a-LC-HC,初步表达出带活性的眼明Fab,为该药物将来的规模化生产奠定一定基础。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒 质粒pET21a,大肠杆菌菌株E.coli BL21(DE3)购自英杰生命技术公司;大肠杆菌DH5α感受态由中国药科大学提供。
1.1.2 酶及试剂 酵母提取物、胰蛋白胨购自Oxoid公司;限制性内切酶XhoⅠ、NdeⅠ、BamHⅠ购自TaKaRa公司;T4 DNA连接酶、DNA Marker等PCR相关试剂、蛋白质Marker购自北京全式金生物技术有限公司;异丙基硫代-D-半乳糖苷(IPTG)等购自大连宝生物技术公司;PCR产物凝胶回收试剂盒、质粒抽提试剂盒购自Biomiga公司;Protein G,Protein L购自Pharmacia公司;其他常用化学试剂为国产分析纯试剂。
1.1.3 引物序列 M13 F:5'-CCCAGTCACGACGTTGTAAAACG-3';M13R:5'-AGCGGATAACAATTTCACACAGG-3'。Hc-forward2:5'-CAGGGATCCAATTAATACGACTCACTATAGGG-3';HcX-rev-1:5'-GATCTCGAGTTATTTCTTGTCAA-3'。
1.2 方法 质粒DNA提取、电泳、酶切、菌感受态制备、转化等操作参见文献[6]。琼脂糖凝胶中DNA片段的回收参见试剂盒说明。
1.2.1 基因合成 按照我们拥有的眼明氨基酸序列,委托南京金斯瑞生物科技有限公司完成基因合成工作,测序正确。
1.2.2 轻链质粒构建
数据使用SPSS 20.0软件进行统计分析,计量资料用均数±标准差(±s),数据比较采用t检验;计数资料用百分比(%)表示,数据比较采用χ2检验,P<0.05表示差异有统计学意义。
1.2.2.1 目的基因片段的获得 PCR反应体系:2 ×Pfu Master mix 40 μl,10 μmol/L 上下游引物各1 μl,模板质粒 1 μl,加 ddH2O 至总体积为 80 μl。
热循环参数:94℃ 5分钟;94℃ 20秒,55℃ 20秒,72℃1分钟,25个循环;72℃ 5分钟;PCR产物切胶试剂盒回收。
1.2.2.2 目的基因/载体双酶切 目的基因酶切体系:10 × K Buffer 7 μl,Nde Ⅰ 1 μl、BamH Ⅰ 1 μl、基因片段20 μl,加ddH2O 至70 μl。37℃过夜,双酶切产物乙醇沉淀法回收。
pET21a载体酶切体系:10 × K Buffer 7 μl,NdeⅠ 1 μl,BamH Ⅰ 1 μl,质粒 1 μg,加 ddH2O 至 70 μl。37℃过夜,切胶纯化试剂盒回收。
1.2.2.3 目的基因与载体连接 连接体系:10×T4连接酶 Buffer 1.5 μl,载体 5 μl,片段 7.5 μl,T4 连接酶1 ml,16℃连接过夜。
1.2.2.4 转化 DH5α 大肠杆菌 连接液转化DH5α大肠杆菌,挑取克隆进行PCR鉴定,PCR体系:2 × super Taq Master mix 70 μl,10 μmol/L 上下游引物各 1 μl,模板菌液 2 μl,加 ddH2O 至总体积为 140 μl。
热循环参数:94℃ 5分钟;94℃ 20秒,55℃ 20秒,72℃ 20秒,25个循环;72℃ 5分钟。挑选PCR结果为阳性进行测序比对。
1.2.4 蛋白表达及纯化
1.2.4.1 转化 取出在 -80℃冻存的 E.coli BL21(DE3)感受态细胞,立即放置于冰上,待解冻后转化。取1 μl质粒加到100 μl感受态细胞中,轻轻混匀,在冰上孵育30分钟,42℃热激90秒,立即置冰上3分钟。加入37℃预热的500 μl LB液体无抗培养基,37℃、200 r/min摇晃培养50分钟。然后取100~200 μl上述菌液涂布在含有 Amp(50 μg/ml)的LB平板上,37℃培养过夜。
1.2.4.2 细胞培养及表达小试 在 E.coli BL21(DE3)转化平板上挑取单菌落并接种于2 ml LB液体培养基(含50 μg/ml Amp)中,37℃ 200 r/min震摇培养3小时至对数生长期,取200 μl培养菌液作对照(未诱导),剩余的培养基加入IPTG至终浓度为0.1 mmol/L 后,18℃、200 r/min 震摇培养,18 小时后收集培养菌液于离心管中。各取200 μl菌液于离心管中,离心去上清,分别取40 μl H2O重悬(诱后全菌),诱导前全菌样同样处理。其余菌液离心,菌体用600 μl 1 ×PBS(pH7.4)重悬,超声破碎菌体,取40 μl高速离心 (两份),分离上清(诱导后破菌上清),加入10 μl 5× loading Buffer(还原,非还原),混匀,煮沸5分钟,2 000 r/min离心5分钟,取10 μl上清进行SDS-PAGE电泳。
1.2.4.3 Protein G/L 亲和层析纯化 用 10 ml起始缓冲液(pH7.0,20 mmol/L磷酸缓冲液)平衡Protein G-琼脂糖亲和层析柱(Hi Trap Protein G 1 ml)。取待纯化的样品(每毫升样品含蛋白10~20 mg)15 ~25 ml上柱,流速为 0.5 ml/min,然后以同样的流速依次用起始缓冲液8 ml、洗脱缓冲液(pH2.7,0.1 mmol/L 甘氨酸盐酸)6 ml、起始缓冲液5 ml洗涤,每管1 ml收集洗脱液,测每管OD280吸收值。收集第2洗脱峰,BCA法测蛋白含量,4℃保存备用。Protein L纯化过程参照Protein G亲和层析操作。
1.2.5 ELISA 检测 用 PBS(pH7.4)稀释 VEGF165至浓度 1.0 μg/ml,100 μl/孔,4℃ 包被过夜。弃去包被液后用 PBS洗板3次,加入200 μl封闭液1(PBS+3%BSA),室温封闭1.5小时。PBS洗板3次,用封闭液2(PBST+3%BSA)按不同比例分别稀释相关样品,100 μl/孔,室温孵育2小时。用 PBST洗板3次,加入100 μl HRP偶联的二抗(抗人的IgG,用封闭液2按1∶2 000比例稀释),室温孵育2小时。PBST洗板3次,再用PBS洗1次。加入100 μl底物四甲基联苯胺(TMB)显色,室温避光显色20分钟。取出每孔加入100 μl终止液停止反应,酶标仪测定A450nm计算结合率。
2 结果
2.1 轻链质粒构建 对眼明(Vasculizumab)轻链氨基酸序列进行密码子优化后进行基因合成,然后以基因合成轻链质粒为模板进行PCR扩增(引物为M13F/M13R),以获得目的基因(图1A)。PCR产物进行琼脂糖凝胶电泳后切胶回收。回收产物与pET21a载体分别进行NdeⅠ/BamHⅠ双酶切,最后将双酶切产物连接到pET21a载体上。重组载体转化DH5α大肠杆菌,挑取9个克隆进行鉴定。选PCR结果为阳性的1、2、9号克隆进行测序比对(图1B),2和9测序正确,说明轻链基因已经成功克隆至载体pET21a上。
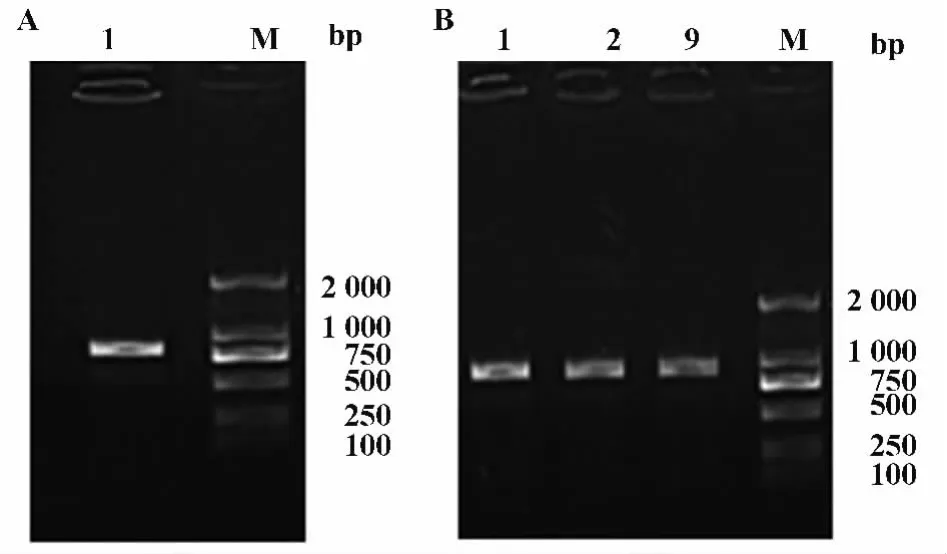
图1 轻链质粒构建Fig.1 Construction of pET21a-LC
2.2 共表达质粒构建 以基因合成重链质粒为模板进行PCR扩增(图2A),NdeⅠ/XhoⅠ双酶切处理重链基因片段与pET21a质粒,连接转化到DH5α中筛选阳性转化子。用引物Hc-forward2/HCX-rev-1扩增得到目的基因(5'端含T7 promoter及RBS序列),BamHⅠ/XhoⅠ处理片段及轻链质粒,连接液转化DH5α大肠杆菌,挑取10个克隆进行鉴定和测序比对(图2C),偏码4测序正确,说明共表达质粒构建成功(图2B),可以进行表达宿主菌的转化及诱导表达。
2.3 诱导表达 将测序正确的共表达质粒pET21a-LC-HC用热激法转入BL21(DE3)表达菌株中,取100 ~200 μl菌液涂布在含有 Amp(50 μg/ml)的LB平板上,放入37℃培养箱培养过夜。挑单个菌落接种于2 ml LB液体培养基(含50 μg/ml Amp)中,37℃ 250 r/min振荡培养至 OD600=0.5~0.6 后,加入 IPTG(0.1 mmol/L)于18℃诱导表达20小时,收集培养菌液于离心管中,分开上清与沉淀SDS-PAGE电泳检测表达结果。电泳结果显示,目的蛋白有表达,大小约为28 kD,说明Fab蛋白在E.coli BL21(DE3)中主要以包涵体形式存在,上清中表达量相对较低(图3)。
周质表达虽然有较多的蛋白形成包涵体,但在上清中25 kD左右,和沉淀相同位置可以看到目的蛋白有一定量的可溶表达(图4)。之后用ELISA检测周质表达上清是否有Fab活性,如果能确定有Fab活性,也说明共表达成功。
2.4 ELISA鉴定 筛选出有表达的克隆,取其菌液100 μl接于100 ml LB培养基中,37℃培养过夜,转接至1 L LB培养基中37℃培养,待其 OD600值至0.6左右加入0.1 mmol/L IPTG 18℃诱导表达18小时,离心收菌体。破菌收集周质表达上清做ELISA活性鉴定(表1),结果证明培养上清中的Fab片段可与抗原VEGF165特异结合,结合活性良好。
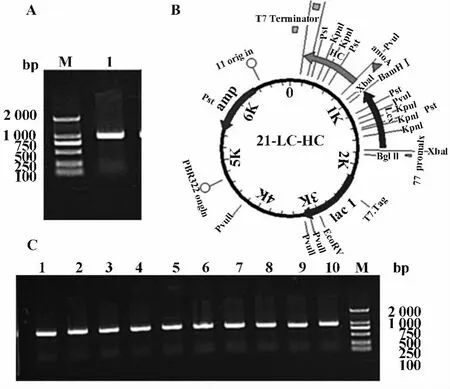
图2 共表达质粒构建Fig.2 Construction of pET21a-LC-HC
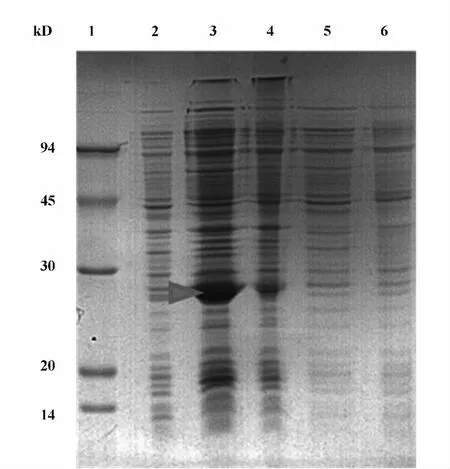
图3 SDS-PAGE鉴定Fig.3 Using SDS-PAGE to identify
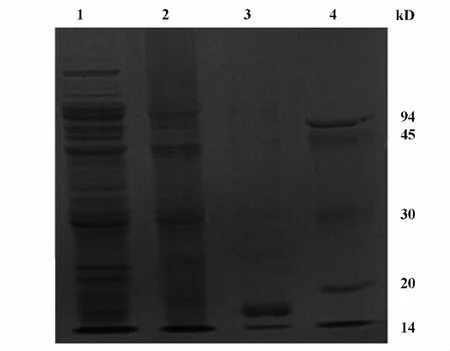
图4 10%SDS-PAGEFig.4 10%SDS-PAGE
2.5 初步纯化 周质表达上清经Protein G纯化后做ELISA检测(结果未给出)表明,上柱前样品和上柱后流穿中Fab活性相当,而上柱后洗脱样品基本无Fab活性,说明Protein G对目的蛋白无富集纯化效果。然后我们选择 Protein L进行纯化,SDSPAGE电泳结果如图5。
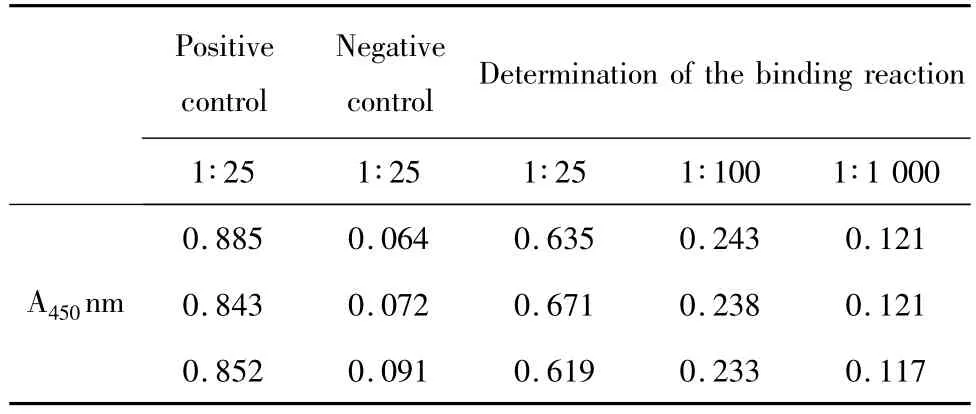
表1 Fab片段与VEGF165结合反应的ELISA测定Tab.1 The ELISA determination of binding reaction between Fab fragment with VEGF165

图5 Protein L纯化结果Fig.5 Result of purification by protein L
由于轻链和重链都含有分子内二硫键,在还原状态下二硫键全部打开,电泳时条带很清晰。而在非还原电泳条件下二硫键未打开,在分子量偏小的地方能隐约看到条带,原因可能主要是蛋白量太少。
3 讨论
本研究利用基因合成得到了眼明Fab蛋白的全长基因,构建共表达质粒后转入大肠杆菌中进行诱导表达。通过对目的蛋白表达条件的摸索,使Fab蛋白获得了高效的表达。
在大肠杆菌直接表达有功能的抗体分子片段是抗体工程的重要进展[7],本研究采用大肠杆菌周质分泌表达Fab蛋白,由于外源蛋白在细胞质中过度积累会影响细胞正常的生理功能,而外源蛋白以分泌蛋白的形式表达则可以解决这一问题。分泌型蛋白是指将外源基因的表达产物运输到周质或细胞外的一种表达方式。本研究在抗体基因上游补充了OmpA信号肽序列,使抗体片段表达于周质,并在这一类似于真核内质网腔的氧化环境中完成折叠及二硫键的形成[8]。周质的氧化环境有利于蛋白的正确折叠,获得具有较好的生物学活性的蛋白,而且周质中的蛋白酶较少,外源蛋白质酶解的程度较低。然而眼明Fab主要形成了包涵体,上清中表达量相对较低。尽管周质表达上清经ELISA检测有Fab活性,仍需要通过优化表达条件提高周质目的蛋白的可溶表达量,然后再探索纯化方法。另外也可重新构建Fab周质共表达载体,采用PhoA启动子,StlI大肠杆菌周质表达信号肽,比较周质可溶表达量是否有差异。
1 Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971;285:1182-1186.
2 Folkman J,Merler E,Abernathy C et al.Isolation of a tumor factor responsible for angiogenesis[J].J Exp Med,1971;133:275-288.
3 Gullino P M.Angiogenesis and oncogenesis[J].J Natl Cancer Inst,1978;61:639-643.
4 Folkman J,Klagsbrun M.Angiogenic factors[J].Science,1987;235:442-447.
5 Ferrara N.VEGF and the quest for tumour angiogenesis factors[J].Nature Rev Cancer,2002;2:795-803.
6 Molnar A,Schwach F,Studholme D J et al.miRNAs control gene expression in the single-cell alga Chlamydomonas reinhardtii[J].Nature,2007;447:1126-1129.
7 Pluck thun A.Antibodies from Escherichia coli[J].Nature,1990;347:497-498.
8 Barbas C F,Lerner R A.Combinatorial immunoglobulin libraries on the surface of phage:rapid selection of antigen-specific Fabs[J].Comp Methods Enzymol,1991;2(2):115-124.
- 中国免疫学杂志的其它文章
- 间充质干细胞移植对EAE小鼠Treg细胞功能的影响