间充质干细胞移植对EAE小鼠Treg细胞功能的影响
刘萍萍 李倩如 朱敬松 轩小燕 管莎莎 杜 英
(郑州大学基础医学院微生物与免疫教研室,郑州450001)
实验性自身免疫性脑脊髓膜炎(Experimental autoimmune encephalomyelintis,EAE)是一种主要由T细胞介导的,以中枢神经系统脱髓鞘为主要特征的自身免疫性疾病[1]。有研究表明 EAE小鼠CD4+CD25+Foxp3+调节性 T细胞(regulatory T cell,Treg)细胞数量和免疫抑制功能均降低,给EAE小鼠输入功能性Treg能改善其病理状况[2,3]。间充质干细胞(Mesenchymal stem cell,MSCs)是骨髓中除造血干细胞外的另一种成体干细胞,具有强大的自我更新和多向分化能力,能分化成多种组织细胞,如神经细胞、软骨细胞和脂肪细胞等,并且MSCs具有显著的免疫调节活性,能抑制T细胞、B细胞和NK细胞增殖,能诱导产生 Treg[4-7]。本研究旨在通过观察MSCs移植EAE小鼠前后体内免疫器官中Treg数量及功能的变化,探讨 MSCs移植在治疗EAE小鼠中的作用。
1 材料与方法
1.1 试验动物及主要试剂 SPF级雌性C57BL/6J小鼠70只,6~8周龄,体重(20±2)g,购自郑州大学实验动物中心。MOG多肽由联美生物科技有限公司合成,结核菌素购自美国DIFCO公司,百日咳毒素购自中国药品生物制品检定所,不完全弗氏佐剂(IFA)购自Sigma公司,抗小鼠荧光标记单抗:PE-Foxp3、FITC-CD4、APC-CD25 及同型对照,antimouse CD28、anti-mouse CD3均购自美国 eBioscience公司,SYBR PrimeScriptTMRT-PCR试剂盒购自TaKara公司,CD4+CD25+细胞免疫磁珠分选试剂盒购自德国Miltenyi Biotec公司。
1.2 EAE模型的建立 60只C57BL/6J小鼠,随机分为EAE模型组、EAE模型MSCs移植组、正常对照组,每组20只。EAE模型组及EAE模型MSCs移植组自小鼠腋下至尾部皮下多点注射免疫乳剂100 μl,免疫乳剂含 MOG 50 μg、结核菌素 500 μg、不完全弗氏佐剂50 μl。分别于致敏第2天、第4天,小鼠腹部皮下注射百日咳毒素200 ng。致敏第7天再次注射免疫乳剂。致敏后小鼠常规饲养。
1.3 小鼠神经功能评分 EAE诱导后,每日观察小鼠症状、体征和体重变化,参照Kono等的评分标准进行神经功能评分:0分为无症状,1分为出现尾巴无力,2分为尾部和后肢无力,3分为后肢瘫痪,4分为后肢瘫痪加前肢无力,5分为濒死状态或死亡。免疫原致敏14~20天,凡评分≥1分者可作为EAE模型。
1.4 骨髓MSCs的分离和培养 无菌分离正常C57BL/6J小鼠股骨和胫骨,暴露骨髓腔,用生理盐水冲洗骨髓腔,将收集的细胞液经200目不锈钢网过滤,1 000 r/min离心15分钟收集细胞,红细胞裂解液裂解红细胞,用含10%胎牛血清和20 ng/ml bFGF的DMEM培养液重悬细胞,细胞浓度调至5×105ml-1,置37℃、5%CO2培养。24小时后去除未贴壁的细胞,将贴壁细胞继续培养,每日观察细胞生长情况,待细胞融合至贴满瓶壁的80%以上,用胰蛋白酶-EDTA液进行消化,传代。利用MTT法检测细胞生长状况。
1.5 MSCs的移植 将培养的MSCs经胰酶消化,PBS离心洗涤3次,加入PBS重悬细胞后,调整细胞浓度为1×106ml-1,经小鼠尾静脉注射EAE模型MSCs移植组(每只0.2 ml),共2次,间隔2天。正常对照组及EAE模型组小鼠尾静脉注射0.2 ml PBS。
1.6 流式细胞术分析Treg的数量 在MSCs移植后第20、40、60天,随机处死各组小鼠5只,分别无菌获取胸腺、脾脏、淋巴结,通过机械研磨、裂解红细胞后,PBS洗3次,制成单个核细胞悬液。加入FITC-CD4、APC-CD25、PE-Foxp3 抗小鼠 mAb及同型对照抗体三标记细胞,流式细胞仪FACSCalibur(BD公司)检测。
1.7 Real time RT-PCR法检测Foxp3和相关细胞因子mRNA表达 MSCs移植后分别于第20、40、60天获取小鼠脾脏和淋巴结,加入Trizol试剂(Invitrogen公司)提取总RNA,用RT Kit(Takara公司)反转录成 cDNA,用 SYBR green I real time PCR Kit(TaKaRa公司)试剂盒扩增目的基因,引物由上海生工合成,FoxP3:sence 5'agg aga aag cgg ata cca 3',anti-sence 5'tgt gag gac tac cga gcc 3';IL-10 sence 5'ttt caa aca aag gac cag 3',anti-sence 5'gga tca ttt ccg ata agg 3';TGF-β1:sence 5'cta atg gtg gac cgc aac aac g 3',anti-sence 5'gca ctg ctt ccc gaa tgt ctg 3';IL-4:sence 5'tcc tgc tct tct ttc tcg 3',anti-sence 5'ttc tcc tgt gac ctc gtt3';GAPDH(内参照):sence 5'gtt gtc tcc tgc gac ttc a 3',anti-sence 5'ggt ggt cca ggg ttt ctt a 3'。
1.8 检测Treg对CD4+CD25-T细胞(Teff)增殖的抑制作用 免疫磁珠法分选各组小鼠脾脏CD4+CD25+及CD4+CD25-细胞,分选方法参照免疫磁珠分选试剂盒说明书。用CD3单抗包被96孔培养板,先将正常对照组小鼠的CD4+CD25-细胞重悬到含10%胎牛血清、100 U/ml IL-2、1 μg/ml CD28 mAb的RPMI1640培养液,调整细胞浓度为1×106ml-1,取100 μl加入到各包被孔中,然后分别加入正常对照组、EAE组、EAE模型 MSCs移植组的CD4+CD25+细胞各100 μl(细胞浓度1 ×106ml-1),每组设3个复孔,置5%CO2饱和湿度37℃培养24小时。MTT法检测各组细胞的增殖情况。
2 结果
2.1 MSCs体外培养、增殖特征 初分离的骨髓单个核细胞在倒置显微镜下呈现为小球形,诱导培养3~4天后部分细胞贴附于培养瓶壁,形状似纺锤形,有较强折光性。培养至7~10天,绝大多数细胞贴附于瓶壁,并逐渐生长形成分散的或条索状聚集状态,细胞体积显著增大。继续传代培养,通过MTT法检测MSCs增殖活性,显示第4、5代细胞增殖能力最强,随传代次数增加,MSCs增殖能力逐渐减弱,并出现细胞内颗粒、细胞碎片等老化现象,因此利用传4~5代的MSCs进行细胞移植,见图1。
2.2 MSCs移植对EAE小鼠神经功能评分的影响MSCs移植前,EAE模型组、EAE模型MSCs移植组小鼠于EAE诱导14天均出现显著异常表现,85%EAE诱导小鼠出现神经功能评分增加,达到2分以上,部分小鼠出现尾部瘫痪、弓背,部分小鼠表现为后肢无力、甚至瘫痪。MSCs移植后,EAE模型MSCs移植组小鼠神经功能评分显著降低,神经功能持续改善,与EAE对照组相比有显著差异,P<0.05,见表1。
2.3 各组小鼠脾脏、淋巴结、胸腺 CD4+CD25+Foxp3+T细胞的数量 流式细胞术检测结果显示,MSCs移植后第20天,EAE模型MSCs移植组和正常对照组胸腺、脾脏和淋巴结中的 CD4+CD25+Foxp3+T细胞比例均显著高于EAE模型组(P<0.05),见图2。
2.4 各组小鼠淋巴器官 Foxp3、TGF-β1、IL-10 mRNA的水平 RT-PCR检测结果显示Foxp3在正常对照组胸腺、脾脏和淋巴结稳定表达,EAE模型组小鼠各淋巴器官Foxp3 mRNA水平逐渐降低,与正常对照组相比有显著差异,P<0.05。EAE模型MSCs移植组在MSCs移植前胸腺、脾脏和淋巴结Foxp3 mRNA呈现低表达,MSCs移植20天后,逐渐升高,IL-10、TGF-β1 mRNA 水平亦逐渐升高,移植后第50天,上述细胞因子mRNA水平均与EAE模型组相比有显著差异,P<0.05(见表2,图3)。

图1 体外培养传代MSCs形态(×200)Fig.1 Themorphology of MSCs subcultured in vitro(×200)

表1 MSCs移植对EAE小鼠神经功能评分的影响(n=20)Tab.1 The influence of MSCs transplantation on clinical score of EAE mice(n=20)

图2 MSCs移植对小鼠脾脏、淋巴结、胸腺CD4+CD25+Foxp3+T细胞的数量的影响Fig.2 The effection of MSCs transplantation on the frequency of CD4+CD25+Foxp3+T in spleen,lymph node and thymus of mice
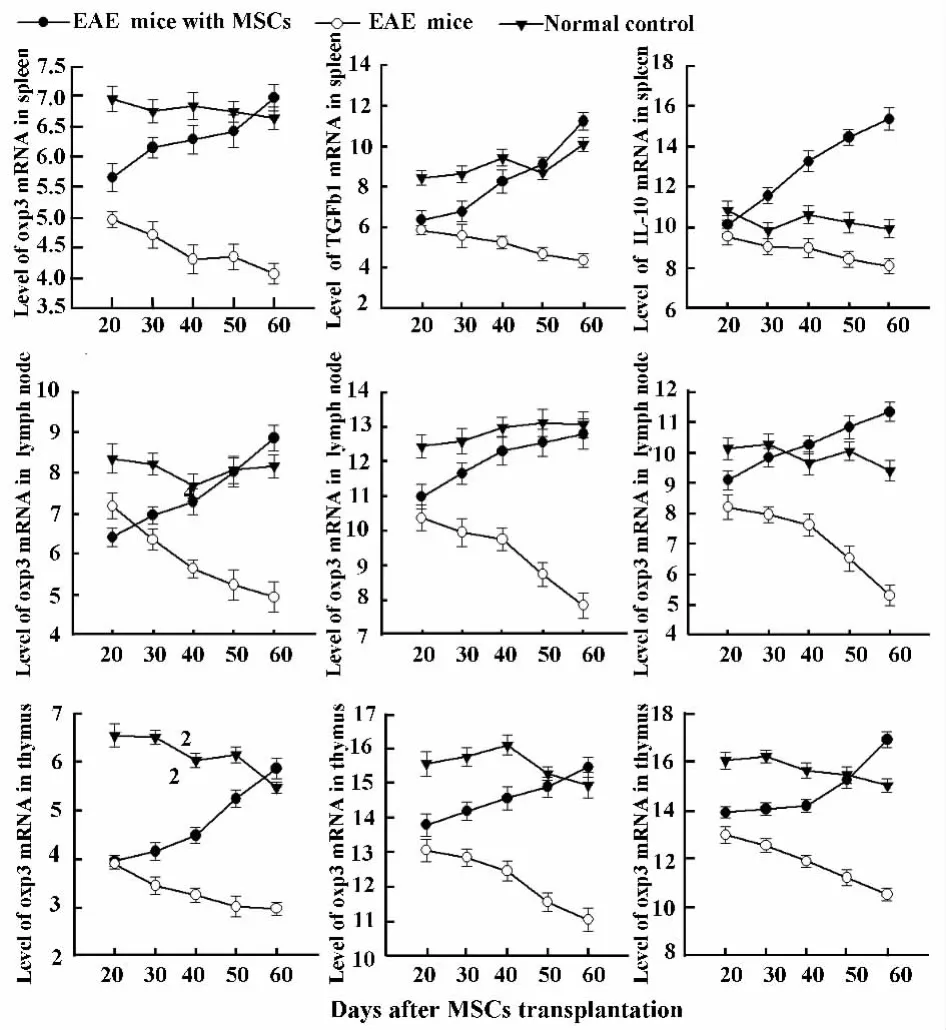
图3 MSCs移植对各组小鼠淋巴器官Foxp3、TGF-β、IL-10 mRNA水平的影响Fig.3 The influence of MSCs transplantation on the mRNA level of Foxp3,TGF-β and IL-10 in lymph organs of mice
表2 MSCs移植后50天各组细胞因子mRNA水平(±s)Tab.2 The level of cytokines mRNA on 50d after MSCs transplantation(±s)

表2 MSCs移植后50天各组细胞因子mRNA水平(±s)Tab.2 The level of cytokines mRNA on 50d after MSCs transplantation(±s)
Note:Compared with EAE mice,1)P <0.05.
Group.35 6.52±0.42 EAE mice with MSCs 5.24±0.181)14.88±0.281)14.26±0.351)6.42±0.271)9.12±0.351)14.45±0.411)8.02±0.351)12.54±0.401)10.84±0.371)1 IL-10 EAE mice 3.01±0.21 11.56±0.26 11.23±0.32 4.35±0.21 4.67±0.34 8.46±0.41 5.23±0.38 8.74±0 Thymus Spleen Lymph node Foxp3 TGF-β1 IL-10 Foxp3 TGF-β1 IL-10 Foxp3 TGF-β 3 13.12±0.39 10.05±0.29 Normal control 6.14±0.16 15.26±0.19 15.46±0.33 6.74±0.17 8.71±0.32 10.23±0.52 8.06±0.3

图4 CD4+CD25+Treg对CD4+CD25-Teff增殖的抑制作用Fig.4 The suppression of CD4+CD25+Treg on the proliferation of CD4+CD25-Teff
2.5 Treg对Teff增殖的抑制作用 与正常对照组相比,EAE组小鼠Treg对Teff增殖的抑制作用显著降低,P<0.05,MSCs移植组Treg对Teff增殖作用显著增强,与EAE组相比有显著差异,P<0.05,见图4。
3 讨论
EAE的临床表现、病理特征及免疫异常等均与MS相似,故被作为研究MS发病机制和治疗策略的动物模型。MS和EAE中枢神经系统的脱髓鞘病变与效应性T细胞过度活化、炎症细胞在CNS浸润、前炎症细胞因子和介质的产生高度相关[8]。
Treg是体内一群具有免疫抑制功能的T细胞亚群,其数量减少或功能缺失可导致多种自身免疫病的发生[9]。Foxp3被认为是Treg的重要标志,是Treg发育和发挥功能的关键因素,可能影响Treg的发育及其免疫调节过程[10]。Treg与效应细胞之间的相互接触也可通过Treg分泌的细胞因子IL-10、TGF-β实现。有研究表明去除Treg的小鼠易发生EAE,过继转移Treg细胞则有助于预防EAE的发生[11]。本研究结果显示,MOG诱导的EAE小鼠模型,伴有胸腺、脾脏、淋巴结中CD4+CD25+Foxp3+T细胞比例减少、Foxp3表达降低,说明Foxp3 mRNA表达水平降低直接影响CD4+CD25+Foxp3+Treg在胸腺和脾脏、淋巴结的数量,且与免疫功能紊乱相关,与EAE的发生有关。
已有大量实验证实EAE小鼠通过输入MSCs其临床症状明显减轻,中枢神经系统炎症病灶及脱髓鞘程度均降低[12,13],移植的 MSCs可以在 EAE 小鼠淋巴结被发现,认为MSCs是通过抑制CD4+Th1细胞而起作用。本研究发现同基因MSCs移植能使MOG免疫的EAE小鼠症状好转、神经功能评分降低,提示MSCs移植能显著改善EAE临床进程,与文献报道结果一致。在临床评分降低的同时,MSCs移植还能使EAE小鼠CD4+CD25+Foxp3+T细胞比例增加,脾脏、淋巴结、胸腺Foxp3 mRNA表达上调。提示MSCs移植治疗EAE的机制可能通过诱导Foxp3 mRNA表达增加和CD4+CD25+Foxp3+T细胞数量增加有关。
已有数据表明,MSCs能通过产生TGF-β和IL-10发挥免疫抑制活性,Foxp3与Treg介导的免疫抑制调节作用通过诱导 TGF-β和 IL-10的产生有关[14,15]。本研究结果显示,EAE 组 Foxp3 mRNA 的表达在上述各器官的表达量显著低于正常对照组,当EAE组分别给予同基因MSCs移植后,Foxp3 mRNA表达比EAE组显著增加。提示MSCs移植能诱导Foxp3 mRNA的表达。同时,TGF-β1 mRNA和IL-10 mRNA表达在MSCs移植组也比EAE组显著增加,说明MSCs移植也能改变TGF-β1、IL-10的表达。MSCs移植后,Foxp3、TGF-β1和 IL-10 mRNA在胸腺、脾脏、淋巴结表达的增加,并且Treg对Teff增殖的抑制活性得以恢复,MSCs可能通过这些机制发挥其免疫调节活性,改变EAE临床进程。
1 Whitha R,Bourdette D,Hashim G et al.Lymphocytes from SJL/J mice immunized with spinal cord respond selectively to a peptide of proteolipid protein and transfer relapsing demyelinating experimental autoimmune encephalomyelitis[J].J Immunol,1991;146(1):101-107.
2 Kohm A P,Carpentier P A,Anger H A et al.Cutting edge:CD4+CD25+regulatory T cells suppress antigen-specific autoreactive immune responses and central nervous system inflammation during active experimental autoimmune encephalomyelitis[J].J Immunol,2002;169:4712-4716.
3 Zhang X,Koldzic D N,Izikson L et al.IL-10 is involved in the suppression of experimental autoimmune encephalomyelitis by CD25+CD4+regulatory T cells[J].Int Immunol,2004;16:249-256.
4 Pittenger M F,Mackay A M,Beck S C et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999;284:143-147.
5 Reyes M,Dudek A,Jahagirdar B et al.Origin of endothelial progenitors in human postnatal bone marrow[J].J Clin Invest,2002;109:337-346.
6 Krampera M,Glennie S,Dyson J et al.Bone marrow mesenchymal stem cells inhibit the response of naive and memory antigen-specific T cells to their cognate peptide[J].Blood,2003;101:3722-3729.
7 Corcione A,Benvenuto F,Ferretti E et al.Human mesenchymal stem cells modulate B-cell functions[J].Blood,2006;107:367-372.
8 Segal B M.Experimental autoimmune encephalomyelitis:cytokines,effector T cells,and antigen-presenting cells in a prototypical Thl mediated autoimmune disease[J].Curr Allergy Asthma Rep,2003;3:86-93.
9 Von Herrath M G,Harrison L C.Antigen-induced regulatory T cells in autoimmunity[J].Nat Rev Immunol,2003;3(2):223-232.
10 Sakaguchi S.The origin of FOXP3-expressing CD4 regulatory T cells:thymus or periphery[J].J Clin Invest,2003;112:1310-1312.
11 McGeachy M J,O'Connor R,Stephens L A et al.Antigen-based therapy and immune-regulation in experimental autoimmune encephalomyelitis[J].Methods Mol Biol,2007;380:313-326.
12 Kassis I,Grigoriadis N,Gowda-Kurkalli B et al.Neuroprotection and immunomodulation with mesenchymal stem cells in chronic experimental autoimmune encephalomyelitis[J].Arch Neurol,2008;65(6):753-761.
13 Zappia E,Casazza S,Pedemonte E et al.Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T-cell anergy[J].Blood,2005;106(5):1755-1761.
14 Nasef A,Chapel A,Mazurier C et al.Identification of IL-10 and TGF-beta transcripts involved in the inhibition of T-lymphocyte proliferation during cell contact with human mesenchymal stem cells[J].Gene Expr,2007;13:217-226.
15 Fontenot J D,Gavin M A,Rudensky A Y.Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Irnrnunol,2003;4:330-336.
