内质网应激对微囊化HepG2细胞脂代谢影响及调控研究
肖 静 张 英 于玮婷 王 为 马小军*
1(中国科学院大连化学物理研究所生物医用材料工程组,大连 116023)
2(南通大学公共卫生学院职业卫生与环境毒理学教研室,南通 226019)
引言
自20世纪80年代初,Lim提出并制备具有良好生物相容性的海藻酸钠微胶囊以来[1],该模型已在细胞移植治疗、规模化培养、药物筛选控释等方面广为应用[2-3]。同时研究者也在不断对微囊环境进行探索,以解决目前仍困扰微囊应用的诸如囊内细胞延迟期长、代谢率降低及中心坏死等问题。对囊内细胞生长代谢规律、微囊微环境和细胞作用方式的充分认识是解决以上问题的关键。微囊微环境是微囊制备培养过程中各种因素共同作用的结果,其中包括多种“胁迫”应激因素,如热“胁迫”、氧化“胁迫”、渗透压“胁迫”等[4],这些应激因素可通过诱导基因表达和信号传递,影响细胞生长代谢。目前发现,微囊化细胞脂代谢通量增加,并能间接影响细胞生长和生物合成[5-6],究其原因可能与细胞应激反应有关,但具体作用机制尚不清楚。
鉴于内质网应激(endoplasmic reticulum stress,ERS)在细胞应激反应中的关键作用,以及内质网在脂类代谢中的重要地位,本研究拟以HepG2为模型,以平面细胞为参照,考察微囊化对细胞内质网应激相关基因表达影响,并以拮抗剂进行干预,探讨内质网应激在微囊化细胞脂代谢异常中的作用和对细胞合成功能的影响,以便为优化微囊化细胞培养,研究微囊环境与细胞作用规律提供实验依据。
1 材料和方法
1.1 材料
人肝癌细胞株HepG2购自ATCC,海藻酸钠、聚赖氨酸、胰蛋白酶、Hoechst 33258、四苯基乙酸购自Sigma公司,白蛋白检测试剂盒购自Bethyl公司,甘油三酯微量检测试剂盒、总胆固醇微量检测试剂盒购自BioVision公司,Trizol裂解液、RT-PCR 试剂盒购自TaKaRa公司,MEM培养液购自Hyclone公司,胎牛血清购自北京元亨圣马生物技术研究所,其他试剂均为国产分析纯。实验仪器包括YD-4型微胶囊静电液滴发生器(中国科学院大连化学物理研究所)、CX31数码图像采集系统(Olympus公司,日本)、PCR仪(Eppendorf公司,德国)、微量紫外定量分析仪(NanoDrop公司,日本)、全自动酶标仪(Labsystems公司,芬兰)、LS55荧光分光光度计(PerkinElmer公司,英国)。
1.2 方法
1.2.1 细胞培养
平面细胞:HepG2细胞用MEM培养液(15%胎牛血清、100 U/mL青霉素、100 U/mL链霉素、1 mM丙酮酸钠)5%CO2细胞培养箱中常规培养。微囊化细胞:细胞生长至对数期,用0.25%胰酶消化离心收集,悬浮于1.5%(w/v)海藻酸钠溶液,细胞密度2×109/L。利用微囊静电液滴发生器喷入0.1 M CaCl2溶液形成海藻酸钙胶珠,电压400 V,频率0.05 Hz、脉宽2 ms、然后用 0.05%(w/v)多聚赖氨酸包裹,再与0.15%(w/v)海藻酸钠溶液反应,最后用55 mM柠檬酸钠溶液液化,微囊直径为(300±50)μm。获得微囊化HepG2细胞37℃,5%CO2培养箱中培养。
1.2.2 细胞形态学观察
用相差显微镜观察微囊化细胞生长状态。
1.2.3 MTT法测定细胞活性
平面细胞:HepG2细胞悬液200 μL接种于96孔板中,最终细胞量5×104/孔,另设两平行样共3个检测孔。培养24 h待细胞贴壁后在待测孔加入20 μL MTT 溶液(5 mg/mL、PBS 溶液配制,4 ℃避光保存),继续培养4 h后镜下观察有不溶性甲臜颗粒生成,弃上清加入200 μL DMSO溶解结晶。微囊化细胞:微囊化HepG2细胞悬液2 mL接种于24孔板中,最终细胞量5×104/孔,另设两平行样共3个检测孔。培养24 h后在待测孔加入100 μL MTT溶液,37℃ 孵育24 h后筛网过滤收集微囊,溶于1 mL DMSO溶液。检测时取平面或微囊化细胞紫色DMSO溶解上清100 μL,置酶标仪测定每孔OD值,测定波长570 nm,参考波长620 nm。
1.2.4 DNA分析法测定细胞数量
平面细胞胰酶消化后用含proteinase K裂解液50℃孵育12 h,释放DNA;微囊化细胞用PBS清洗破囊,加入含proteinase K裂解液释放DNA。加入荧光染料Hoechst 33258,测定荧光光度值变化(Ex=355 nm,Em=460 nm),根据细胞数和DNA荧光光度标准曲线确定细胞数。
1.2.5 ELISA检测白蛋白分泌水平
白蛋白检测依试剂说明书,每检测孔加100 μL样品或标准品,用酶标仪测定450 nm的吸光度值。
1.2.6 脂代谢水平检测
微囊化细胞在不同培养时间破囊收集细胞,贴壁细胞在对数生长期消化收集细胞。乙烷-丙酮法[7]抽提总胆固醇和甘油三酯,试剂盒测定其含量。
1.2.7 4-苯基丁酸干预评价
配置含不同浓度4-苯基丁酸(4-phenylbutyric acid,4-PBA)(0.1、0.5、1 mmol)培养液。于培养不同时间留取上清,检测白蛋白含量和脂代谢水平,MTT法测定细胞活性,DNA分析测定细胞数,同时测定基因表达。
1.2.7 Real Time-PCR检测基因表达
提取细胞总RNA,两步法反转录和实时PCR,反转录条件37℃ 15 min、85℃ 15 s;实时PCR条件:预变性95℃ 30 s,PCR反应95℃ 5 s、60℃ 20 s,扩增40个循环,引物设计如表1。
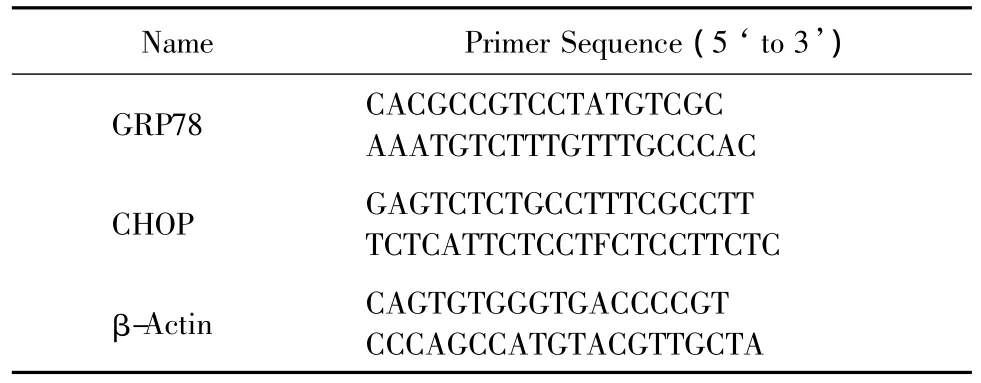
表1 基因引物设计Tab.1 Prime sequences of different gene detected by PCR
1.3 统计学分析
2 结果
2.1 微囊化对HepG2细胞生长代谢的影响
为了解微囊化对细胞影响,以平面细胞为对照,对ERS相关基因表达和胞内脂代谢产物含量进行考察。如图1(a)所示,微囊细胞中ERS基因葡萄糖调节蛋白 78(glucose regulating protein 78,GRP78)和 C/EBP同源蛋白(C/EBP homologous protein,CHOP)表达均显著增高,分别为平面细胞3.6倍(P=0.016)和 1.9倍(P=0.010)(P<0.05)。同时胞内总胆固醇(total cholesterol,CHO)和甘油三酯(triglyceride,TG)含量也出现了增高,分别为 29.53±2.21 μg/106细胞和 83.17±6.49 μg/106细胞,为平面细胞1.7倍(P=0.016)和3.2倍(P=0.014)(P<0.05)(见图1(b))。
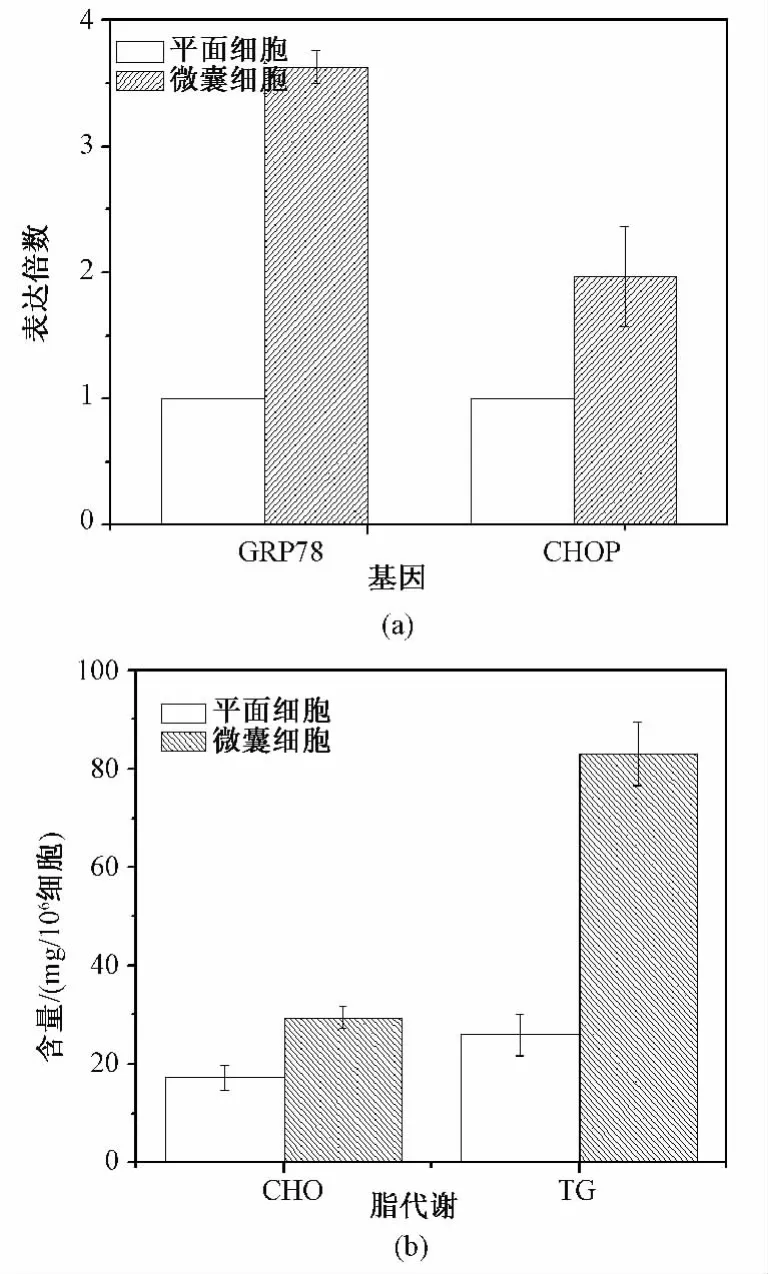
图1 微囊化对HepG2细胞的影响。(a)对内质网应激基因表达影响;(b)对脂代谢影响Fig.1 The influence of microencapsulation on HepG2 cells.(a)The influence on ERS gene expression;(b)The influence on lipid metabolism.
2.2 4-PBA干预对细胞活性的影响
为验证ERS和微囊化细胞脂代谢调节的关系,采用ERS拮抗剂4-PBA对其进行干预,若干预后ERS途径被抑制的同时,细胞脂代谢也随之改变,则说明两者之间存在一定关联。首先在不同培养方式下,对4-PBA有效作用剂量进行考察。
如图2所示,在平面细胞和微囊化细胞培养过程中分别添加不同浓度的4-PBA。对平面细胞而言,4-PBA各浓度组细胞活性均未见明显改变(见图2(a))。而在微囊化细胞中,4-PBA在0.5 mM时即使细胞活性有所改善但差异并不显著,当浓度提高到1 mM时微囊化细胞活性显著提高(P=0.003)(见图2(b))。同时对微囊化细胞干预前后形态进行了观察,如图3所示未添加4-PBA微囊化细胞在制备初期生长相对缓慢,以数个分散细胞团方式聚团汇集。随培养时间延长,形成大小不同的细胞聚集体向囊中心迁移,直到培养第15 d细胞团大小才达到100 μm左右((a)~(d))。而在加入1 mM 4-PBA后细胞成团速度有所提升,在培养第15 d时,干预组细胞团均大于100 μm,个别囊内细胞团已超过300 μm((d)~(f))。
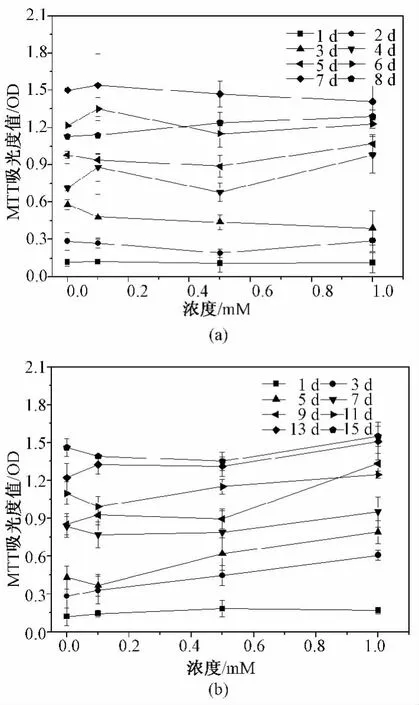
图2 四苯基丁酸对HepG2细胞活性影响。(a)平面细胞;(b)微囊化细胞Fig.2 The effect of 4-PBA on HepG2 cell viability.(a)Monolayer cells;(b)Microencapsualted cells.
2.3 4-PBA干预对微囊细胞ERS基因表达和脂代谢影响
鉴于4-PBA对微囊化细胞的有效浓度为1 mM,因此比较此浓度下,微囊化细胞ERS表达、脂代谢水平的变化。结果如图4(a)中可知,4-PBA处理后微囊化细胞ERS基因GRP78和CHOP表达明显下降(P=0.031,P=0.024),较对照组分别降低了50%和30%。同时胞内总胆固醇和甘油三酯含量较对照降低30%和15%(P=0.008,P=0.033)。
2.4 4-PBA干预对微囊细胞生物合成功能影响
实验同时考察了 4-PBA处理前后微囊化HepG2细胞白蛋白水平的变化,结果如图5所示,4-PBA干预组明显改善细胞合成分泌白蛋白能力,且趋势随培养时间延长而更为显著,自培养第10 d起,干预组白蛋白水平较对照组显著提高(P=0.008)。
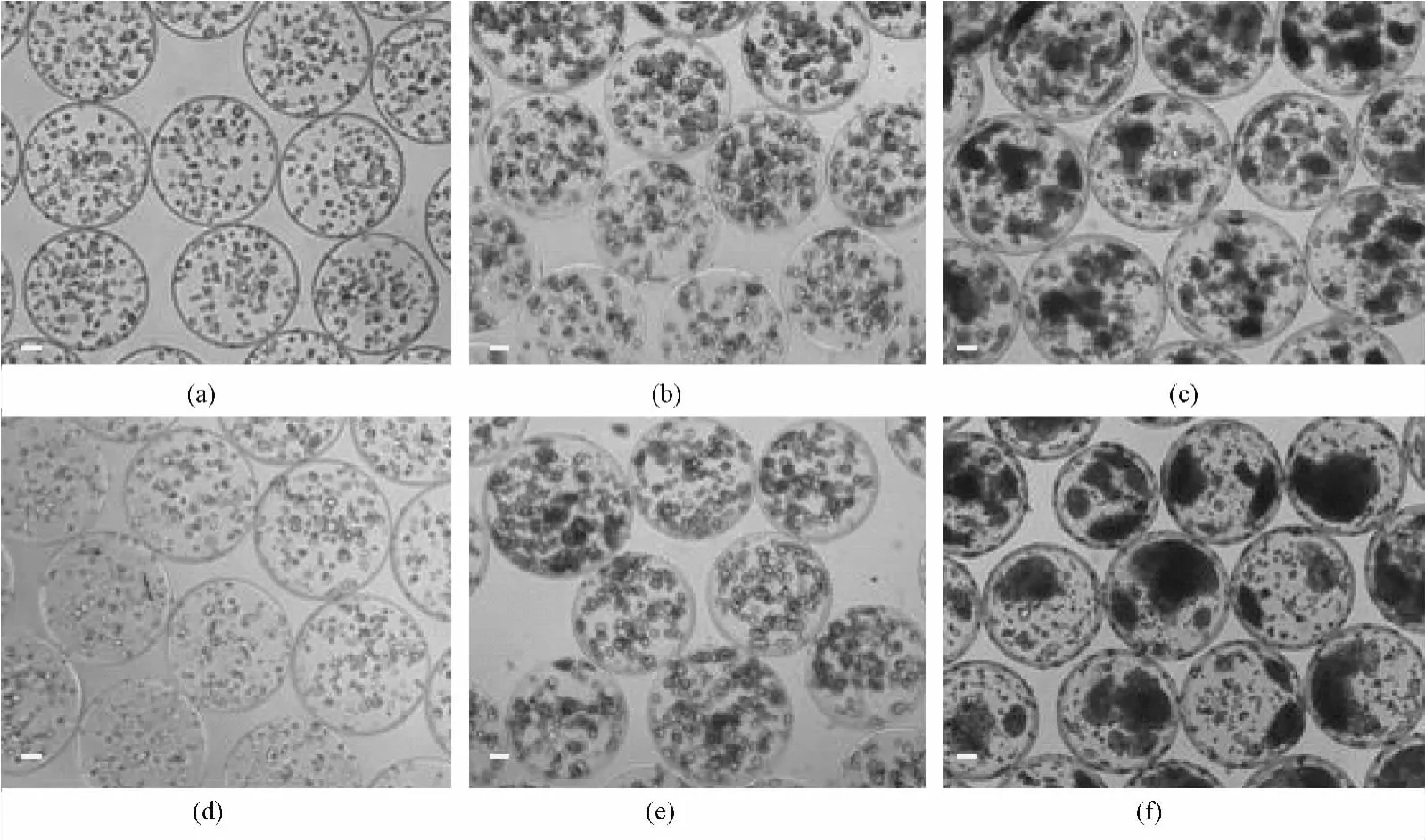
图3 微囊化HepG2细胞形态(标尺为100 μm)。(a)对照组培养第2 d;(b)对照组培养第7 d;(c)对照组培养第15 d;(d)1 mM 4-PBA处理组培养第2 d;(e)1 mM 4-PBA处理组培养第7 d;(f)1 mM 4-PBA处理组培养第15 dFig.3 The growth of microencapsulated HepG2 cells:(a)Control group day 2;(b)Control group day 6;(c)Control group day 13;(d)1 mM 4-PBA-treated group day 2;(e)1 mM 4-PBA-treated group day 7;(f)1 mM 4-PBA-treated group day 15(bars=100 μm)
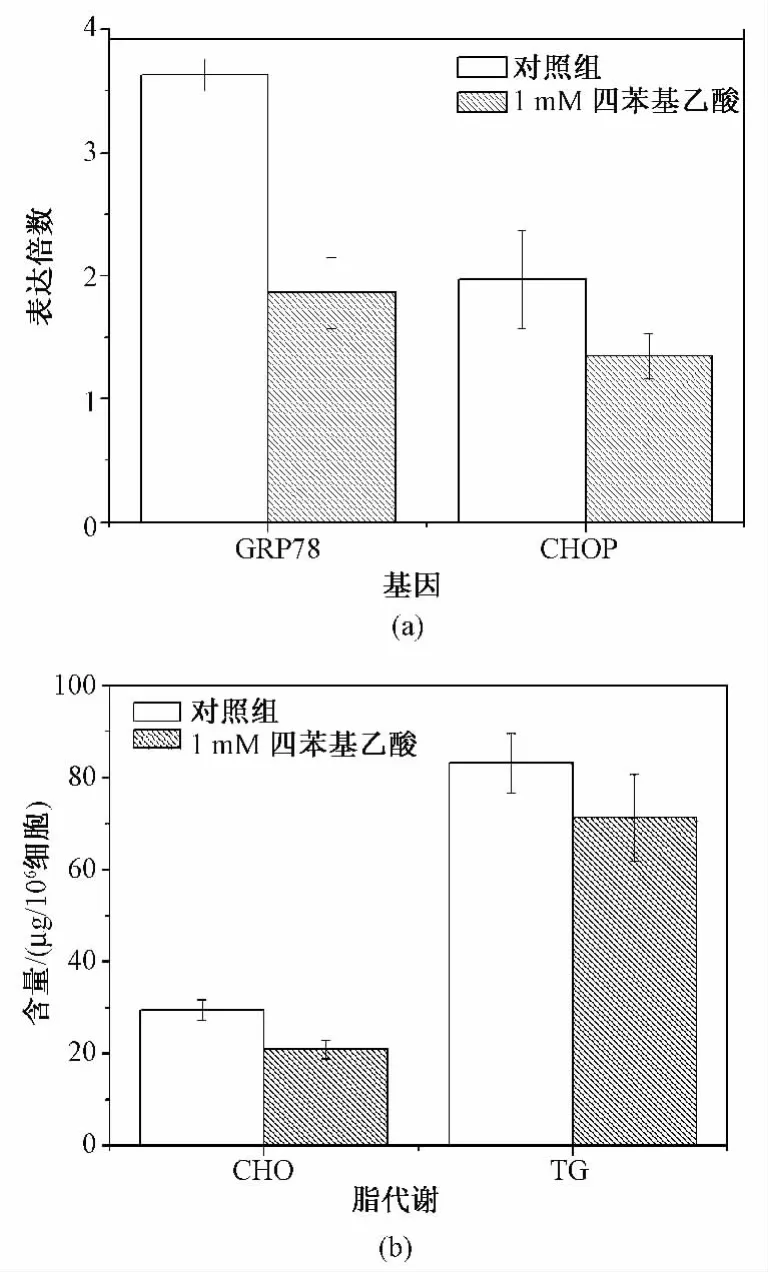
图4 四苯基丁酸对微囊化细胞的影响。(a)对内质网应激基因表达的影响;(b)对脂代谢的影响Fig.4 The influence of 4-PBA on microencapsulated cells.(a)The influence on gene expression;(b)The influence on lipid metabolism
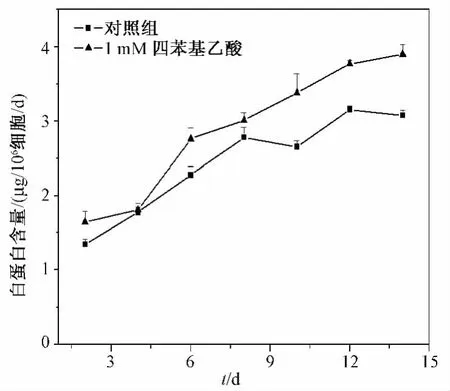
图5 四苯基丁酸对微囊化细胞白蛋白水平影响Fig.5 The influence of 4-PBA on alb content in microencapsulated HepG2 cells
3 讨论
微囊环境是受限于生物半透膜所形成的复杂场所,由于半透膜所具有的特殊性质,使囊内细胞在形态、生化特性、基因表达等多方面有异于平面细胞,因此在生物医学相关领域广泛应用。但微囊细胞长期培养中存在的代谢速率降低、生物合成功能减退等仍是该技术应用中需要面对的问题,解决这些难题的关键在于对微囊微环境的了解,尤其是对囊内细胞与微囊环境作用规律的充分认识。有研究发现微囊化细胞脂代谢水平增加,并能间接对细胞线粒体功能和生物合成产生抑制[6],本课题组前期结果也显示脂代谢亢进和微囊化细胞培养后期的功能减退存在关联[8],但其中机制尤其引起脂代谢上调的原因目前尚不明确。
近年研究发现ERS在脂代谢失调及相关病理改变中发挥重要作用。内质网是胞内重要亚细胞器,与蛋白、氨基多糖、脂类及钙信号代谢息息相关。环境诱因如氧化应激、ATP耗竭、缺氧、钙超载及营养物质失衡等都有诱发 ERS 的可能[9-10]。ERS可通过级联反应对固醇调节元件结合蛋白(Sterol regulatory element binding proteins,SREBPs)等转录因子进行调控,进而对下游包括胆固醇合成酶系基因、脂肪酸合成酶系基因及转运蛋白相关基因表达产生影响,加剧胞内甘油三酯和胆固醇异常积聚,其过程伴有GRP78和CHOP等ERS标志蛋白的表达改变[11]。晏春根等发现在同型半胱氨酸介导的ERS中,出现内源性胆固醇调节通路失调,并使肝细胞合成摄取TG和CHO显著增加[12]。此外在动物模型中同样发现GRP78表达增加和脂代谢异常有关,通过基因敲除方式干扰ERS途径后,大鼠肝细胞出现明显脂肪变性,研究者认为该模型中ERS是造成肝细胞脂代谢亢进的基础[13]。此外Chikka等也发现ERS标志蛋白CHOP表达增加与脂代谢亢进关系密切,因CHOP能直接作用于基因启动子区,影响包括Cebpa、Ppara和Srebf1在内的多个脂代谢调节基因,对代谢过程产生干扰[14]。鉴于以上研究基础,Shin等采用酪氨酸蛋白激酶抑制剂来考察ERS拮抗剂对脂代谢调节的影响,实验通过抑制 GRP78等蛋白表达,使脂代谢相关基因FAS、SCD1、GPAT和ACC等表达和转录水平显著降低,因此认定ERS发生和脂代谢调节关联密切,且ERS拮抗对脂代谢失调有明显改善作用[15],类似结果在Peng和Liang等人研究中也有报道[16-17]。
本次实验发现微囊化细胞GRP78和CHOP表达显著增加,说明微囊内存在ERS。而其诱因首先可能与微囊制备中的高压脉冲电场有关。高压脉冲静电可使水分子分解,形成超氧负离子自由基引起内质网膜脂质超氧化,造成内质网蛋白结构的破坏,并通过触发线粒体膜孔开放引起瀑布样级联反应,进入恶性循环使应激长期持续[18]。电场也可以通过破坏生物膜电荷平衡使之相变,打破内质网稳态诱发应激[19]。其次,微囊制备所需钙化过程也可能是造成ERS出现的原因。Charleta等实验表明CaCl2对内质网等细胞器有显著影响,Ca2+会导致细胞器在胞内聚集使相应分子浓度增加,干扰细胞稳态引起应激发生[20],而GRP78作为Ca2+结合蛋白,在此状态下表达量可增高10~25倍,以维护内质网内环境稳定[21]。同时Ca2+的存在也可通过影响线粒体结构和功能,间接引起ERS[22]。但除微囊制备对细胞的影响外,以三维方式生长的细胞本身也有诱发ERS的可能[23]。Yuan等研究发现,共培养方式形成的三维细胞团随培养时间延长,会出现GRP78等ERS基因表达的显著增高[24],这可能与细胞生长过程中营养梯度变化及中心氧浓度降低后低糖、缺氧及酸中毒的微环境出现,从而导致错误折叠和未折叠蛋白增多有关[9-10,23]。因此微囊制备过程并非造成ERS发生的唯一原因。实验中除ERS相关基因表达改变外,微囊细胞胞内CHO和TG也显著增加,为验证这一脂代谢增强反应是否与ERS有关,采用ERS拮抗剂4-PBA对培养过程进行干预,比较干预前后各指标的变化。4-PBA是一种低分子量化学伴侣,能降低内质网腔内突变或错误定位蛋白导致的内质网负荷增加,是一种有效的ERS拮抗剂[25]。实验中未发现4-PBA对平面细胞的影响,当其作用于微囊化细胞时,在0.5 mM即使细胞活性出现了增加,且在1 mM时改善效果更为显著,这一结果也从反面验证微囊内存在ERS。与此同时,4-PBA能明显减低GRP78和CHOP的表达,这可能由于4-PBA作为分子伴侣可促进蛋白正确折叠,减轻内质网未折叠蛋白反应从而抑制GRP78、CHOP与膜受体的解离,因此使其表达降低。在作用于微囊化细胞ERS的同时,发现4-PBA干预组脂代谢水平即胞内CHO和TG含量较对照组显著降低,这可能由于ERS被4-PBA所拮抗后,对SREBP-1c等因子的调控作用减弱有关。但也注意到,干预组脂代谢水平仍远高于平面细胞,说明微囊内还存在其他干扰代谢平衡的因素。同时,4-PBA在0.1 mM时使个别天数下微囊细胞活性出现了降低,这可能由于4-PBA虽然具有拮抗ERS的作用,但同时会对细胞周期调控产生影响,造成G1/G0期阻滞影响细胞增殖,直到随着浓度增高4-PBA对ERS的正面拮抗作用抵消了对细胞周期调控的负面影响,才使细胞活性出现显著增加[26]。另外,在添加4-PBA后微囊化HepG2细胞白蛋白水平出现了显著升高,这可能由于4-PBA干预缓解了脂代谢亢进对线粒体的抑制,使蛋白合成过程能量供给得以恢复,同时4-PBA起到了恢复内质网正常功能的作用,使其加工处理蛋白的效率得到恢复,因此使白蛋白含量有所增加。
4 结论
总结以上实验结果认为,微囊环境可诱使细胞出现ERS,并通过ERS相关通路,对细胞脂代谢产生影响,造成微囊化细胞的脂代谢增强;微囊化对细胞的以上影响能被ERS拮抗剂所缓解,使相关基因表达降低、脂代谢通量下调,同时起到改善囊内细胞生物合成的作用。以上实验结果将有助于了解微囊微环境对细胞生长代谢影响的具体机制,为微囊化技术改进和实际应用提供实验依据。
[1]Lim F,Sun AM. Microencapsulated isletsasbioartificial endocrine pancreas[J].Science,1980,210(4472):908 -910.
[2]Li Yuanqiu,Wang Jian,Wen Xinyu,et al.Transplantation of co-microencapsulated hepatocytes and HUVECs for treatment of fulminant hepatic failure[J].Int J Artif Organs,2012,35(6):458-465.
[3]Li Shuangyue,Sun Zhijie,Lv Guojun,et al.Microencapsulated umbilical cord blood cells repair mouse hepatic injury by intraperitoneal transplantation[J].Cytotherapy,2010,11(8):1032-1040.
[4]Sun Zhijie,Lv Guojun,Li Shuangyue,et al.Probing the role of microenvironment for microencapsulated Sacchromyces cerevisiae under osmotic stress[J].J Biotechnol,2007,128(1):150 -161.
[5]Khalil M,Shariat PA,Tootle R,et al.Human hepatocyte cell lines proliferating as cohesive spheroid colonies in alginate markedly upregulateboth synthetic and detoxificatory liver function[J].J Hepatol,2011,34(1):68 -77.
[6]Leonard HD,Sam C,Sarah FC,et al.Altered mitochondrial function and cholesterol synthesis influences protein synthesis in extended HepG2 spheroid cultures[J].Arch Biochem Biophys.2004,432(2):167-177.
[7]Shariat OK,Lynn EG,Chung YH,et al. Homocysteine stimulates the production and secretion of cholesterol in hepatic cells[J].Biochim Biophys Acta,1998,393(4):1317 -1324.
[8]肖静,张英,于玮婷,等.微囊化HepG2细胞脂代谢与线粒体功能和蛋白的合成[J].中国组织工程研究与临床康复,2010,38(9):7082-7087.
[9]Christopher LG,Melinda F,Michael J.et al.Pagliassotti endoplasmic reticulum stress and the unfolded protein response in nonalcoholic fatty liver disease[J].Antioxid Redox Signal.2011,15(2):505-521.
[10]Suneng F,StevenMW,GökhanS.etal. Theroleof endoplasmic reticulum in hepatic lipid homeostasis and stress signaling[J].Cell Metabolism,2012,15(5):623-634.
[11]Botm GJ,Van DD,VieiraD,etal. Sterolregulatorye elementbinding protein inhibits upstream stimultory factor stimulated hepatic lipase gene expression [J].Atherosclerosis,2005,179(1):61- 67.
[12]晏春根,任光圆,朱冬芳,等.同型半胱氨酸介导的内质网应激对肝细胞脂质代谢的影响[J].中国病理生理杂志,2007,23(12):2414-2418.
[13]Rutkowski DT,Wu J,Back SH,et al.UPR pathways combine to preventhepaticsteatosis caused by ER stress-mediated suppression of transcriptional master regulators[J].Dev Cell,2008,15(6):829-840.
[14]Madhusudana R.Chikka DD,Heather MT,et al.C/EBP homologous protein(CHOP)contributes to suppression of metabolic genes during endoplasmic reticulum stress in the Live[J].J Biol Chem,2013,288(6):4405-4415.
[15]Eui SS,Hyoung HL,Si YC,et al.Genistein downregulates SREBP-1 regulated gene expression by inhibiting site -1 protease expression in HepG2 cells[J].J Nutr,2007,137(5):1127 -1131.
[16]Peng Ge,Li Ling,Liu Yang,et al.Oleate blocks palmitateinduced abnormallipid distribution,endoplasmic reticulum expansion and stress,and insulin resistance in skeletal muscle[J].Endocrinology,2011,152(6):2206 -2218.
[17]Liang Bing,Wang Shu,Wang Qi,et al.Aberrant endoplasmic reticulum stress in vascular smooth muscle increases vascularcontractility and blood pressure in mice deficient of AMP-activated protein kinase-α2 in vivo [J]. Arteriosclerosis,Thrombosis,and Vascular Biology,2013,33(3):595-604
[18]陈家森,叶士璟,陈树德,等.电场对水结构的影响[J].物理,1995,24(4):424-428.
[19]Knorr D,Angersbach A.Impact of high intensity electric field pulses on plant membrane permeabilization[J].Trends food Sci Technol,1998,9(4):185-191.
[20]Arghya P,Yin G,Satya P,et al.Microencapsulated stem cells for tissue repairing:implications in cell-based myocardial therapy[J].Regenerative Medicine,2009,44(5):733 -745.
[21]Yang GH,Li S,Pestka JJ.Down-regulation of the endoplasmic reticulum chaperone GRP78Bip by vomitoxin(Deoxynivalenol)[J].Toxicol Appl Pharm Acol,2000,162(3):207 -217.
[22]Kezhong Z,Randal JK.From endoplasmic-reticulum stress to the inflammatory response[J].Nature,2008,454(7203):455 -462.
[23]Li JZ,Lee AS.Stress induction of GRP78/BiP and its role in cancer[J].Curr Mol Med,2006,6(1):45 -54.
[24]Yuan YH,Li CZ,Jiarui H,et al.Functional investigation of NCI-H460-inducible myofibroblasts on the chemoresistance to VP-16 with a microfluidic 3D co-culture Device [J].PLoS ONE,2012,3(13):23-31.
[25]Sana B,Šárka L,Arya M.et al.The chemical chaperone 4-phenylbutyrate inhibits adipogenesis by modulating the unfolded protein response[J].J Lipid Res,2009,50(12):2486 -2501.
[26]Sharon AM,Jennifer L.G1 phase growth arrest and induction of p21Waf1/Cip1/Sdi1 in IB3-1 cells treated with 4-sodium phenylbutyrate[J].J Pharmacol Exp Ther,2000,294(3):941-947.
——疾病防治的新靶标

