纳米颗粒对猪GV期卵母细胞低温保存效果的影响
李维杰 周新丽* 刘宝林 戴建军 吕福扣 张德福 徐 利
1(上海理工大学生物热科学研究所,上海 200093)
2(上海农业科学院畜牧兽医研究所上海农业遗传育种重点实验室动物遗传工程研究室,上海 201106)
引言
生殖细胞的低温保存是低温生物医学研究的重要内容,可以使得优秀或濒危的动物品种突破时间和空间的限制,得以繁衍生息;可为不孕不育患者提供帮助。卵母细胞作为哺乳动物的雌性配子由于体积大,对温度敏感,1987年才真正得以保存,但效果并不理想[1]。目前保存卵母细胞效果最好的方式为Cryotop玻璃化保存卵母细胞,该方法利用体积最小的原理,将体积小于0.1μL的低温保护液连同卵母细胞滴加到Cryotop载体上,迅速插入液氮,实现细胞快速降温,由于使用的低温保护剂溶液体积小,降温过程中直接插入液氮,降温速度高,玻璃化程度高,对细胞损伤较小,因此存活率较高,但是仍然不十分理想。
为了突破制约当前低温保存的技术瓶颈,近年来出现了将纳米技术与低温工程学相结合的低温保存策略——纳米低温保存。它是将具有生物相容性的纳米颗粒加入低温保护剂中,对细胞或组织实施离体保存。纳米颗粒是直径为1~100 nm的粒子,由于自身的小体积效应,纳米颗粒在强化传热、促进成核、低温保护剂性能改善等方面起到重要作用。郝保同等在低温保护剂中加入纳米微粒[2],发现纳米颗粒可以改变低温保护剂的传热系数和黏度,同时也可以改变冰晶的形成状况,降低低温保护剂的反玻璃化温度,有利于细胞的低温保存。徐海峰等认为添加纳米颗粒可以改变低温保护剂的结晶焓[3]。李方方数值模拟了纳米冷冻过程温度场和应力场分布[4],发现纳米颗粒能强化散热,增强力学性能,减少组织的温度梯度,提高应力承受能力。通常情况下低温保护剂中加入纳米微粒,可以有效提升保护剂的热导率和黏度[5]。Hao等采用DSC测量了含有不同浓度纳米颗粒的聚乙烯吡咯烷酮低温保护剂的比热容、玻璃化温度和反玻璃化温度[6],结果表明其均随纳米颗粒的浓度增大而降低,溶液的导温系数也能升高,玻璃化转变温度却降低4~7℃。常温下,向乙二醇溶液中加入纳米微粒能够提高溶液的导热系数[7]。Han发现添加0.2%(w/w)钻石纳米微粒到乙二醇溶液[8],冷冻速率提高一倍,而导热系数增加不超过5%,比热容和潜热量稍有降低,但成核温度却显著升高。改变溶液的结晶性质可以通过添加纳米粒子来完成[9]。
学术界一直研究纳米颗粒有利于细胞低温保存的机理,很少应用于实践,本研究首先比较了粒径20 nm的羟基磷灰石(HA)、二氧化硅(SiO2)、三氧化二铝(Al2O3)、二氧化钛(TiO2)纳米颗粒在不同浓度下对卵母细胞的毒性,其次在安全浓度0.1%下,将各种纳米粒子添加到低温保护剂中,使用Cryotop法冷冻猪GV卵母细胞,比较颗粒种类、粒径、浓度等因素对细胞复温后存活率的影响,然后对复温后的细胞培养42 h,比较发育到MⅡ期的发育率。
1 材料与方法
1.1 实验设备与材料
1.1.1 主要仪器和设备
BC-J160S CO2培养箱:上海博讯实业有限公司,中国;TS100倒置荧光显微镜:Nikon,日本;YDS-35-20 液氮罐:东亚压力容器,中国;SW-CJ-1CU 超净工作台:松泰净化科技有限公司,中国;Cryotop载板:KITAZATO,日本。
1.1.2 主要试剂
实验中所用的试剂除特别说明外,均来自美国Sigma公司。TCM199培养液,磷酸盐缓冲液(phosphate buffer solution,PBS),胎牛血清(fetal bovine serum,FBS):Gibco公司,美国。纳米颗粒(包括20 nm、40 nm 和60 nm HA纳米颗粒,20 nm SiO2纳米颗粒,20 nm Al2O3纳米颗粒,20 nm TiO2纳米颗粒):南京欧瑞纳米科技有限公司,中国。
1.1.3 玻璃化冷冻/解冻液
基础液:TCM199+20%FBS;预平衡液:基础液+8%Me2SO+8% 乙二醇(ethylene glycol,EG);玻璃化冷冻液(vitrification solution,VS):基础液 +15%Me2SO+15%EG+0.5 mol/L蔗糖;解冻液:分别以基础液+0.5 mol/L蔗糖,基础液+0.25 mol/L蔗糖构成不同蔗糖浓度的解冻液。
1.2 实验方法与步骤
1.2.1 猪卵母细胞的采集及GV期卵母细胞的获得
卵巢采集于上海市长宁区复兴屠宰场。在猪屠宰后立即取卵巢组织,将采集的猪卵巢放入含1000 μg/mL双抗生理盐水中(35~37℃),2 h内运回实验室。用95%酒精对卵巢表面进行喷洒消毒,再用灭菌的生理盐水洗涤2~3次。选择直径为2~8 mm的卵泡,使用带有大号针头、20 mL的一次性注射器(注射器中装有少量的TCMl99)将卵母细胞复合体连同卵泡液一起吸出。将抽出的卵泡液置于50 mm的培养皿中,在39℃恒温台上静放10 min,移除上清液。取有3层以上卵丘细胞包裹且胞质均匀的卵丘卵母细胞复合体,洗涤3次进行实验。
1.2.2 纳米颗粒毒性判定
分别添加0.05%、0.1%、0.5%,1%的粒径为20 nm 的 HA、SiO2、Al2O3、TiO2,4 种纳米颗粒到TCM199,将含有纳米粒子的保护剂分别滴加到多孔板中,石蜡油液封,放在培养箱中预热2 h,将GV期的卵母细胞加入含有纳米颗粒的TCM199中,每孔加入卵50枚左右。培养42 h。成熟培养后的卵母细胞净透明质酸酶消化以去除卵丘细胞,用TCM199洗3~5遍备用。卵母细胞用荧光素双醋酸酯(fluorescein diacetate,FDA)染色 3 min,再用基础液洗3~4遍,在倒置显微镜下观察是否着色。胚胎有荧光反应的为活卵,没有荧光反应的为死卵。
1.2.3 卵母细胞玻璃化冷冻及解冻程序
对照实验组所用冷冻保护剂为玻璃化冷冻液,实验组冷冻保护剂为玻璃化冷冻液中添加一定比例的纳米颗粒,超声震荡,使其充分分散。
冷冻:将10枚卵母细胞为一组,从基础液中移至预平衡液中平衡3 min,然后移至50 μL的玻璃化冷冻液中平衡30 s。用吸管将细胞滴加载到Cryotop载板上,再用毛细管移去一部分多余的冷冻保护剂,之后将带有细胞的Cryotop快速插入液氮中,实施冷冻。
解冻:细胞冷冻72 h后,进行细胞解冻。解冻采用三步法解冻。迅速将Cryotop装置连同细胞一起从液氮中取出,先直接浸入37℃的基础液+0.5 mol/L蔗糖液解冻,浸没时间大约3 min。将卵母细胞快速移入37℃的基础液+0.25 mol/L蔗糖液解冻,浸没时间3 min。将卵母细胞快速移入37℃的TCM199基础液。以此3个步骤,逐级脱除冷冻保护剂,实现卵母细胞的完全解冻。
1.2.4 卵母细胞体解冻后存活率和发育率判断
观察解冻的细胞,对于卵丘覆盖良好、形态完整的细胞可以认为是存活的,反之,则认为细胞死亡。存活细胞数与细胞总数之比为存活率。
经洗涤后的卵丘卵母细胞复合体放入在培养箱内已平衡4 h以上的成熟液(TCM199+10%FBS+10% 猪卵泡液 +激素)中,成熟培养42 h。成熟培养后的卵母细胞净透明质酸酶消化以去除卵丘细胞,用TCM199洗3~5遍备用。卵母细胞用FDA染色3 min,再用基础液洗3~4遍,在倒置显微镜下观察是否着色。有荧光反应的为发育后的卵,没有荧光反应的为死卵。发育到MII的存活细胞数与细胞总数之比为发育率。
1.2.5 数据统计
实验结果采用SPSS Statistics 17.0数据处理软件进行显著性分析,实验组之间采用配对样本t检验,P<0.05为显著性差异标准。
2 结果
2.1 不同纳米颗粒毒性
颗粒直径为 20 nm 的 HA、SiO2、Al2O3、TiO2纳米颗粒按照0.05%、0.1%、0.5%、1%的浓度(w/w)添加到细胞培养液中,经过42 h的培养,纳米颗粒均发生了很严重的沉降和团聚现象,吸附在细胞表面,使用毛细管口吸器可以将吸附在表面的纳米颗粒打散,之后统计细胞发育率如表1。在较低浓度(<0.1%)纳米颗粒中培养的细胞均未死亡,都顺利培养到MⅡ期。而当浓度为0.5%时,HA依旧对细胞无毒性,而其它纳米颗粒(SiO2、Al2O3、TiO2)会影响细胞的发育,当纳米颗粒的浓度达到1%时,所有的纳米颗粒均影响细胞发育。

表1 不同纳米颗粒对猪GV期卵母细胞的毒性Tab.1 The toxicity of different nanoparticles on the porcine GV-stage oocytes
2.2 不同的纳米颗粒对细胞冷冻效果的影响
将浓度为0.1%、粒径为20 nm的 HA、SiO2、Al2O3、TiO2的纳米颗粒添加到玻璃化冷冻液中,使用Cryotop法进行冷冻,发现添加纳米颗粒之后低温保存效果差异较大,结果如表2。解冻后直接观察发现细胞存活率较高,卵母细胞出现破裂、变形等情况的概率不大,大部分卵形态完整,值得注意的是添加了Al2O3纳米颗粒的卵的形态完好性较低为92%,而未添加和添加其他纳米的组都在98%以上,但是各组差异不显著。对冷冻后的卵培养42 h观察发现,加入HA纳米颗粒的组比不加入纳米颗粒的组发育率有了显著的增加,高达22%,而对照组仅为14%,添加SiO2尽管也有提高(16%)但不显著,而Al2O3和TiO2居然有反作用,存活率分别为2%和6%,远低于对照。

表2 不同种类纳米颗粒对猪GV期卵母细胞的冷冻效果Tab.2 The effect of different nanoparticles on cryopreservation of porcine GV-stage oocytes
2.3 不同粒径的纳米颗粒对冷冻效果的影响
将浓度为0.1%粒径为20、40、60 nm的HA纳米颗粒添加到冷冻保护液中,使用Cryotop法冷冻,结果如表3。添加了纳米颗粒的实验组冷冻后卵的形态完整性较未添加组有所提高,但不显著。当培养42 h后,卵由GV期发育为MⅡ期的比例有所增加,比对照的14.2%,有显著增加,其中40、60 nm颗粒的效果较好,发育率均为28.7%,而20 nm实验组发育率相对较低为26.7%,而各实验组之间没有显著差异。
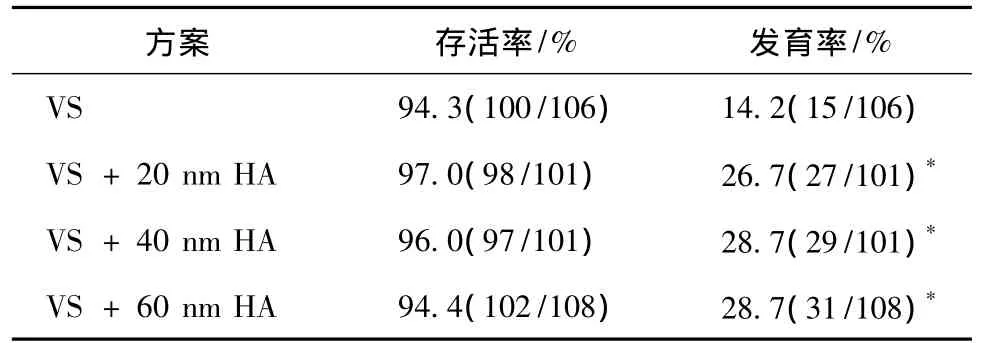
表3 纳米颗粒粒径对对猪GV期卵母细胞的冷冻效果Tab.3 The effect of particle size on cryopreservation of porcine GV-stage oocytes
2.4 羟基磷灰石浓度对卵母细胞低温保存效果的影响
将60 nm的 HA以 0.01%、0.02%、0.05%、0.1%、0.5%浓度添加到玻璃化保存液中,进行冷冻、复温、培养,实验重复3次,每组50个左右,结果如表4。添加了60 nmHA颗粒之后,复温后卵细胞形态完整性较未添加有所提高,但不显著。当培养42 h后,差异性十分明显,分别添加 0.01%、0.02%、0.05%和0.1%的组发育率显著提高,但组别之间区别不显著,其中添加0.05%的组发育率最高,达到30.4%比对照组的一倍还多。而添加0.5%的组也有提高,但与对照差异不显著。

表4 HA浓度对对猪GV期卵母细胞的冷冻效果Tab.4 The effect of HA concentration on cryopreservation of porcine GV-stage oocytes
3 讨论
添加纳米颗粒到培养液中会影响细胞的发育,这是由于颗粒本身体积较小,具有表面吸附等小体积效应,可以吸附培养基中的化学成分,改变pH值和营养组成,造成细胞死亡,同时,由于颗粒较小,在培养过程中可能进入细胞内部,和细胞器以及染色体相结合,影响细胞器的发育[10-11]。由于HA自身稳定性等原因的影响,毒性相对较低,在0.5%时未对细胞培养造成影响[12]。当纳米粒子浓度达到1%,所有的细胞都受到了不同程度的影响,只是HA的毒性相对较小,对细胞的影响不大,而其它三种尤其Al2O3的毒性较大,成活率太低。可以认为,纳米颗粒低浓度时对细胞毒性小,高浓度对细胞毒性大。当纳米粒子浓度高于0.5%时也会发生很严重的团聚现象,影响培养、冷冻等操作过程,而低浓度时团聚现象不明显,便于操作。此外考虑到纳米颗粒在分子水平对细胞染色体的损伤不能通过FDA染色观察到,因此尽量在低浓度区间进行后续实验,同时,为了保证纳米粒子在冷冻过程中的效果,浓度亦不能太低。
纳米颗粒的种类影响着冷冻和复温过程的结晶和重结晶过程。冷冻过程是一个复杂的物理过程,而加入纳米颗粒可以使体系的玻璃化和重结晶过程更加复杂。一方面加入纳米颗粒可以强化散热,增加导热系数,减少反玻璃化结晶[13],有利于细胞保存,另一方面可以促进溶液成核,不利于玻璃化。在成核与反玻璃化的博弈中,当玻璃化占优势时,就能提升细胞的存活率,反之可能降低存活率。由于纳米颗粒的物理性质与种类相关,其对细胞玻璃化保存效果的影响也有所不同。
研究HA纳米颗粒的粒径对细胞发育率的影响时发现,粒径对发育率影响不大,这是由于商品化的纳米颗粒并不是都保证为一个尺寸,其尺寸范围为一个很广的区间,标示60 nm的颗粒,其成分中含有20 nm和40 nm的成分,只是60 nm占主要,同理其它粒径的纳米颗粒的粒径分布也很广,因此样本的差异性并不很大,实验结果差异性不大也在所难免。此外,纳米颗粒对冰晶的结晶性质的影响是一个复杂的过程[2],是多方因素共同作用的结果,纳米颗粒的粒径对于结晶性质只是一个很小的影响因素。
羟基磷灰石的加入提高了GV期卵母细胞的冷冻存活率和发育率。当HA浓度达到0.05%时,反玻璃化效果最好,保存效果亦最好。原因可能是低温保护剂中添加适当浓度的纳米颗粒,可以改善溶液结晶性,减少冰晶数量,有利于细胞低温保存效果,也可能是低温保护剂中添加纳米颗粒减少了复温过程的重结晶。在一定的浓度范围内,纳米颗粒对细胞低温保存有效果,超过该范围反而对细胞有毒性。不同的颗粒的范围可能不同,由于实验量和精力的限制,只找到了HA纳米颗粒的较有益浓度。由于其它的纳米颗粒和HA的理化性质不同,在其它的浓度范围内,可能会对细胞冷冻保存也有积极作用。
4 结论
不同种类的纳米颗粒对细胞的毒性不同,一般低浓度时毒性低,高浓度时毒性高,会杀死细胞。在低温保护剂中添加适宜浓度的HA纳米颗粒,可以减少复温过程中的重结晶现象,促进细胞的冷冻存活率和发育率,保存效果与浓度相关,而与纳米颗粒的粒径关系不大。
[1]Al-HasaniS,Diedrich K,Van der Ven H,etal.Cryopreservation of human oocytes [J].Human reproduction,1987,2(8):695-700.
[2]郝保同,刘宝林.纳米微粒在细胞低温保存中的应用[J].中国组织工程研究与临床康复,2008,(41):8140-8142.
[3]徐海峰,高志新,刘宝林,等.纳米微粒对低温保护剂溶液结晶性质的影响[J].低温与超导,2010,(11):53-57.
[4]李方方.生物材料纳米冷冻过程的理论与实验研究[D].北京:中国科学院研究生院,2010.
[5]Wang Buxuan,Zhou Leping,Peng Xiaofeng.Viscosity,thermal diffusivity and prandtl number of nanoparticle suspensions[J].Progress in Natural Science,2004,(10):82-86.
[6]Hao Baotong,Liu Baolin. Thermal properties of PVP cryoprotectants with nanoparticles [J]. Journal of Nanotechnology in Engineering and Medicine,2011,2(2):021015.
[7]Kang HU,Kim SH,Oh JM.Estimation of thermal conductivity of nanofluid using experimental effective particle volume[J].Experimental Heat Transfer,2006,19(3):181 -191.
[8]Han X,Ma HB,Wilson C,et al.Effects of nanoparticles on the nucleation and devitrification temperatures of polyol cryoprotectant solutions [J].Microfluidics and nanofluidics,2008,4(4):357-361.
[9]Wilmut I.The effect of cooling rate,warming rate,cryoprotective agent and stage of development on survival of mouse embryos during freezing and thawing [J].Life sciences. Pt.2:Biochemistry,General and Molecular Biology,1972,11(22):1071-1079
[10]韩爽,李庆宁,夏天,等.医用金属及金属氧化物纳米材料的毒性研究[J].生物物理学报,2012,10:805-814.
[11]吴秋云,唐萌,谢彦昕,等.不同粒径纳米二氧化硅的体外细胞膜毒性作用[J].中国生物医学工程学报,2010,29(3):437-445.
[12]孟纯阳,安洪,蒋电明,等.新型纳米骨重建和修复材料羟基磷灰石/聚酰胺体内植入的生物相容性及安全性[J].中国临床康复,2004,8(29):6330-6333.
[13]Seki S,Mazur P.Effect of warming rate on the survival of vitrified mouse oocytes and on the recrystallization of intracellular ice[J].Biology of Reproduction,2008,79(4):727 -737.

