纳米羟基磷灰石/壳聚糖(n-HA/CS)复合材料对SD大鼠代谢器官的影响
王丽婷 周 钢 樊瑜波*
1(北京航空航天大学生物与医学工程学院,北京 100191)
2(国家康复辅具研究中心,北京 100176)
引言
随着纳米生物技术的飞速发展,纳米生物材料对组织器官的负面作用逐渐成为人们关注的问题之一。纳米羟基磷灰石复合材料因其良好的力学特性和骨诱导性[1],成为纳米骨组织工程支架的常用材料。但是复合材料进入体内,随着植入时间的延长,人体的频繁活动所致的应力环境以及生理环境的腐蚀、磨损,复合材料植入体表面会不断降解,因而造成降解成分以及磨损粒子向周围组织扩散,逐渐沉积到各个器官,经过机体代谢排出体外。纳米的尺度效应是否带来相应的负面作用,还需要深入的研究证实。Scheel等观察HA材料在鼠巨噬细胞中的生物相容性[2],发现ROS形成增加明显增强了细胞毒性,肿瘤坏死因子-a(TNF-alph)的释放增加。Liao发现纳米HA/胶原(nHAC)复合物使中性粒细胞释放乳酸脱氢酶(LDH)和TNF-alpha显著增加[3]。使用共沉淀和粒子沥滤法制备多孔结构的壳聚糖/HA纳米复合材料[4],植入SD大鼠背部皮下,3周后,发现有轻微炎症,新生血管和巨细胞的出现。以上研究表明,纳米HA复合材料通过诱导细胞炎症,导致细胞坏死对机体产生了相应的作用。
本研究使用共沉淀法制备了纳米羟基磷灰石与壳聚糖 n-HA/CS(70:30)的复合材料[5],并采用红外光谱分析(IR)、X射线衍射(XRD)等手段表征该材料。通过体外细胞培养以及动物模型观察该复合材料对细胞生长的作用以及在体内代谢后的安全性,探索此类纳米颗粒对组织器官的作用机理。
1 材料和方法
1.1 材料制备及表征
壳聚糖粉末购自济南海得贝海洋生物工程有限公司,相对分子质量约 45万,N-脱乙酰度为95%。所用试剂均为分析纯。通过以下步骤合成n-HA/chitosan复合材料。把壳聚糖溶解到2 wt%的乙酸中搅拌5 h,制备成浓度为3 wt%的脱乙酰壳聚糖溶液。然后,将10 wt%的H3PO4溶液与脱乙酰壳聚糖溶液混合。根据 70/30的 n-HA /chitosan重量比调整这些试剂。把chitosan/H3PO4溶液缓慢滴入到4%的乙醇溶液中,搅拌后用氢氧化钙调节pH值至10,滴入速度大约为4 mL/min。继续搅拌24 h,将得到的浆液老化24 h。最后过滤沉淀物,用去离子水洗涤,在80℃的真空烘箱中干燥。材料制备完成后,用XRD(XPert Pro MPDX射线衍射仪,荷兰帕纳科)和IR(Nicolet 170SX FT-IR光谱仪,美国)等方法进行表征。
1.2 方法
1.2.1 细胞培养和MTT比色
成骨细胞系(MC3T3-E1)细胞在37℃、5%CO2的条件下孵育,培养液用含10%胎牛血清(FCS)的培养基DMEM(Gibco),加入1%青链霉素。含10%胎小牛血清的培养液配成单个细胞悬液,以1×104/mL的细胞浓度接种到96孔板,每孔体积200 μL,每孔接种的细胞数约为2×103。培养24 h后,加入不同浓度梯度的材料:10 μg/mL、100 μg/mL、1 mg/mL、10 mg/mL,并设立正常对照组。纳米材料粉末紫外线照射12 h,用培养液稀释。继续在37℃,5%CO2条件下,培养细胞24 h。每孔加MTT 溶液20 μL(用 PBS 配制,pH=7.4),继续孵育4 h,终止培养,小心吸弃孔内培养上清液,每孔加150 μL DMSO(Sigma,USA),振荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫监测仪(Bio-Rad,USA)上测定各孔光吸收值。以时间为横坐标,OD值为纵坐标,绘制细胞的生长曲线。
1.2.2 动物试验
选取成年SD大鼠,一次性给予大鼠腹腔注射纳米羟基磷灰石/壳聚糖(n-HA/CS)复合材料,按照骨缺损材料400 mg/kg体重计算。根据不同的时间点分别设立对照组、1周组、2周组、4周组、8周组、每组8只。分别取血及肝脏、肾脏等组织。观察复合材料的代谢产物随血循环进入各重要组织的分布情况,以及其对机体肝、肾等主要器官的毒性作用。
1.2.3 血清生化检查
大鼠各时间点心脏取血,4000 r/min离心10 min,取上清。日本东芝7170A型全自动生化分析仪进行血清生化指标检测(北京友谊医院)。具体指标包括乳酸脱氢酶(LDH)、谷丙转氨酶 (ALT)、谷草转氨酶(AST)、总胆红素(T-B)、间接胆红素(IB)、血清尿素氮 (BUN)、肌酐 (CR)等。
1.2.4 病理切片
动物的肝脏、肾脏等组织被取出后,固定在10%福尔马林溶液中。蜡块包埋,切成5~6 μm薄片,用标准的组织切片技术处理,HE染色。光学显微镜观察(U-III Multipoint Sensor System尼康,美国)。
1.2.5 统计分析
所有的数据用均数 ±标准差(SD)表示。用SPSS 11.5版本进行方差分析(ANOVA)和L.S.D.测试来分析实验组与对照组的差异性(P<0.05)。
2 结果
2.1 材料的合成及形貌
图1各子图中曲线A~曲线C分别表示n-HA、CS 和 n-HA/CS 复合材料。图 1(a)是 n-HA、CS 和n-HA/CS复合材料的红外光谱(FT-IR),曲线 A 除了特征PO43-、OH-、HO2的特征谱带外,还观察到了 874 cm-1和大约 1420 ~1480 cm-1处出现了CO32-谱带,表明此为含碳酸羟基磷灰石。类似于天然骨磷灰石的组成。曲线B的光谱中显示1655 cm-1处出现壳聚糖的酰胺Ⅰ特征谱带,在1599 cm-1处的肩峰是由胺基的弯曲振动引起。而在HA/CS复合材料中(如曲线C所示)可以同时观察到羟基磷灰石和壳聚糖的特征吸收峰,说明复合前后两种单组分材料的化学组成未发生显著变化。但壳聚糖的酰胺Ⅰ特征峰和HA的OH特征峰都向低波数方向发生了不同程度的位移。这说明CS的CO与HA中的—OH之间形成了氢键。
图1(b)显示了n-HA、CS和它们复合材料的X-射线衍射图。曲线A中2θ=25.9°和30.8°两处出现了羟基磷灰石晶面的特征衍射峰。曲线B中显示了壳聚糖的两个主要衍射峰。分别在2θ=10°和20°处。可以明显看出,以上两种单组分的特征衍射峰都存在于两元复合材料中。通过JADE 9软件计算出,复合材料的晶体大小是31.44 nm。
2.2 不同材料对成骨细胞(MC3T3-E1)生长的影响
MTT试验结果表明,不同浓度梯度(10 μg/mL、100 μg/mL、1 mg/mL、10 mg/mL)的 n-HA/CS 纳米材料都抑制了MC3T3-E1细胞的生长,而且随着纳米材料浓度的升高,抑制作用更加明显,呈现剂量依赖性,见图2所示。
2.3 动物一般状况
动物腹腔注射材料后,出现背毛松散,蜷缩成团,发抖,不食,嗜睡的状况。1周处死的动物可见腹腔粘连严重,2周和4周处死的动物中,腹腔粘连逐渐减轻。但是到8周时,出现动物死亡的情况。大鼠脱毛现象严重,出现倦怠、厌食等现象。
2.4 血清生化
由于大鼠AST的正常范围是96~200单位,AST数据变化始终在正常生理范围,说明肝功能处于代偿状态(见表1)。反映胆管系统病变的T-B、IB早期稍有降低,但在8周时均出现明显增高,具有显著性差异。如图3所示,X轴表示不同的降解时间,Y轴表示生化指标数值。
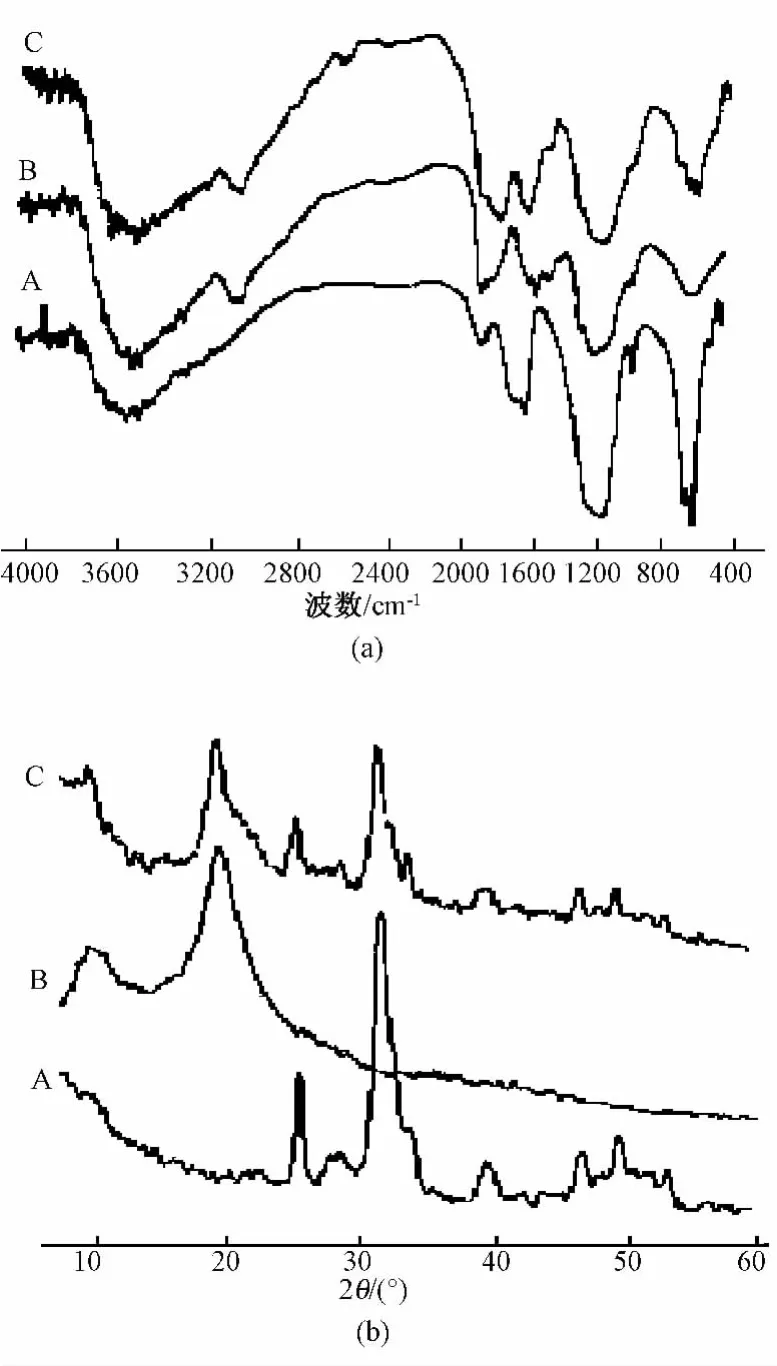
图1 n-HA、CS和n-HA/CS复合材料表征。(a)红外光谱(IR);(b)X-射线衍射图(XRD)Fig.1 n-HA,CS and n-HA/CS composite material characterization.(a)Infrared Spectroscopy(IR);(b)X-ray diffraction(XRD)patterns
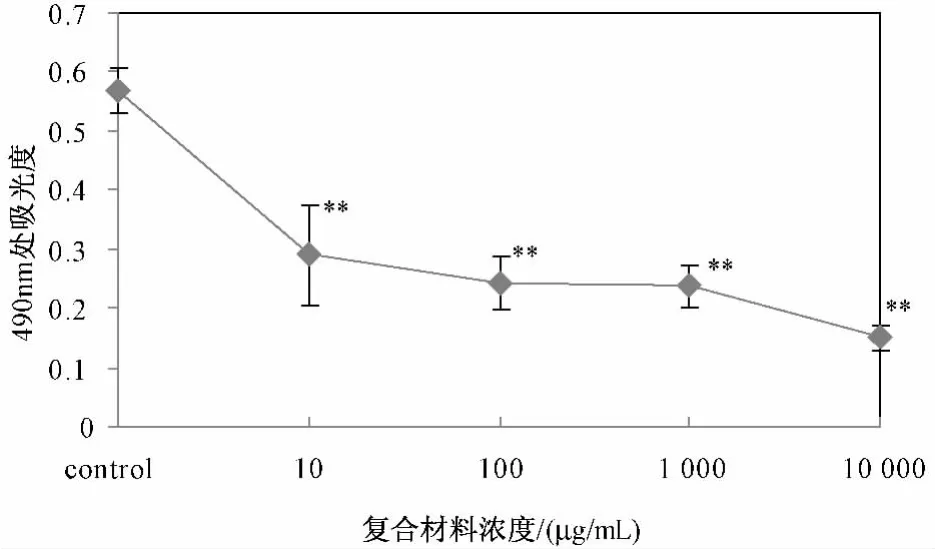
图2 MC3T3-E1细胞在不同浓度的n-HA/CS复合材料作用下的生长曲线(**:与对照组相比 P<0.01)Fig 2 Different concentration of n-HA/CS composites on MC3T3 -E1 cells growth(**:compared with the control,P <0.01)
肾脏相关指标的改变,CR在1~4周变化不明显,但8周时,出现明显升高。差异有显著性 (P<0.01)。而对于BUN,2周、4周时开始出现升高趋势,并且相比于对照组,差异具有显著性(P<0.05),到8周时,BUN升高明显,相比于对照组,具有非常显著的差异(P<0.01)。
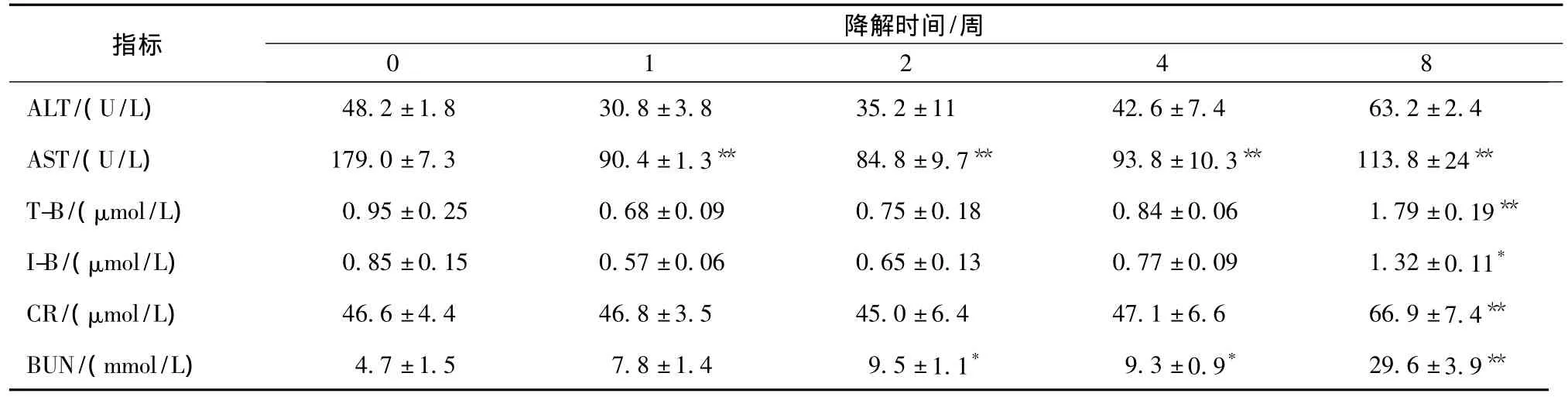
表1 n-HA/CS复合材料在大鼠体内降解不同时间后生化指标的改变(n=8)Tab.1 Changes of serum biochemical indicators after n-HA/CS composites degradation for different times(n=8)
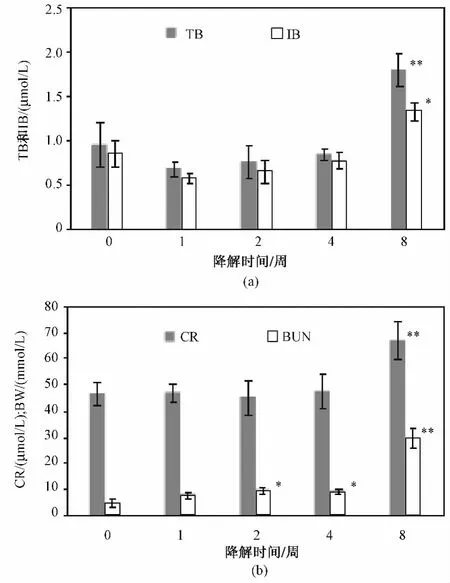
图3 n-HA/CS复合材料对代谢器官的作用(各组分别与对照组相比,*:P<0.05,**:P <0.01)。(a)TB 和IB;(b)BUN和CRFig 3 Effects of n-HA/CS composites on metabolize organs(Compared with the control,*:P <0.05,**:P<0.01)(a)T-BI-B;(b)BUNCR
2.5 病理切片
n-HA/CS复合材料经腹腔注射入大鼠体内,通过血液循环将吸收入体内的纳米材料重新分布,材料在大鼠体内分别代谢2、4、8周后,肝脏、肾脏的组织病理改变见图4所示。n-HA/CS复合材料在体内代谢2周开始,肝、肾组织中开始出现凋亡细胞,胞浆水分脱失,嗜酸性染色增强,细胞核固缩。而肾脏组织中,细胞凋亡现象更为明显,凋亡细胞周围未发现炎症细胞浸润。箭头为组织中的凋亡细胞。
随着作用时间的延长,肝、肾等代谢器官细胞凋亡程度逐渐增加。4周后,肾小管上皮凋亡细胞明显增多,当材料在体内代谢至8周时,出现广泛分布的凋亡细胞和大片嗜酸性染色区域,组织损伤严重,但凋亡细胞周围仍无明显炎症细胞浸润。
3 讨论
纳米生物材料对机体的负面影响可能涉及机体的很多系统,但其致病机理尚不明确。Watari F认为由于纳米颗粒特异表面区域的尺寸效应引起了化学反应的增加,导致材料毒性[6]。Motskin认为,纳米材料使细胞质内钙离子的负荷增加,可能是导致细胞死亡的原因[7]。Lu研究证实,纳米硅颗粒进入小鼠体内诱发了炎症和氧化应激反应,最终导致了由中性粒细胞介导的肝细胞坏死[8]。氧化应激反应的增加可能是纳米铜颗粒诱导肾足细胞凋亡的关键机制[9]。此外,纳米材料对机体的其他作用机制还涉及蛋白质变性退化,DNA损伤以及免疫反应等。Yeo发现,纳米银离子导致与凋亡相关的P53基因途径的表达发生改变,促进了凋亡的产生[10]。凋亡是由基因调控的细胞自主性、程序性死亡。作为细胞死亡的两种不同方式,凋亡和坏死具有特征性的区别,具有其独特的形态和生物化学特征。本研究通过血液生化指标的改变,以及病理切片组织的形态表现,从不同角度说明n-HA/CS复合材料在体内分布后,导致肝脏和肾脏细胞出现了凋亡现象。
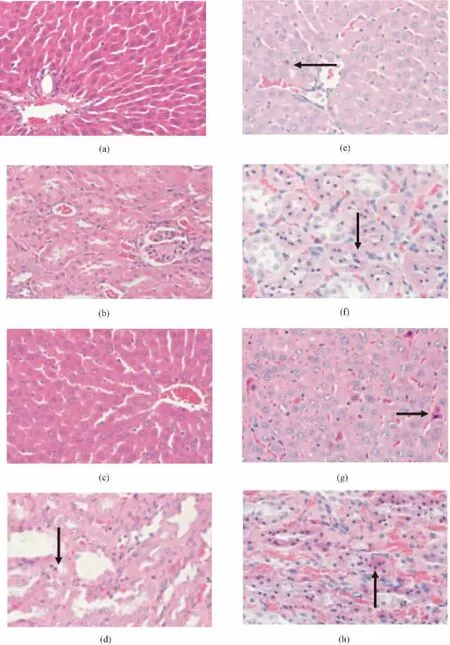
图4 纳米n-HA/CS复合材料对大鼠代谢器官的组织改变(100×,箭头指凋亡细胞)。(a)正常肝组织;(b)正常肾组织;(c)2周后肝组织;(d)2周后肾组织;(e)4周后肝组织;(f)4周后肝组织;(g)8周后肝组织;(h)8周后肾组织Fig.4 Changes of n-HA/CS composites on tissue in metabolize organs(100 ×,Arrows indicate apoptotic cells).(a)Normal liver;(b)Normal renal;(c)Liver for 2 weeks;(d)Renal for 2 weeks;(e)Liver for 4 weeks;(f)Renal for 4 weeks;(g)Liver for 8 weeks;(h)Renal for 8 weeks
而对于纳米颗粒造成细胞凋亡的研究目前多集中于抗癌药物载体的研究,对于常用的生物医学材料的凋亡研究还十分不足。本研究选取人工骨替代常用的复合材料,探索该材料在体内代谢后对SD大鼠的主要代谢器官的影响。
本研究发现,n-HA/CS复合材料经腹膜吸收入血,随血循环重新分布,通过对肝脏、肾脏相关的生化指标检测以及病理切片分析,观察该纳米材料进入大鼠体内代谢不同时间后,对肝、肾等代谢器官功能的影响。结果显示,含量为100 mg/kg的 n-HA/CS复合材料在体内降解8周,AST与ALT始终在大鼠生理值范围之内,说明肝细胞没有出现明显的坏死和炎症,未影响肝脏功能。但肾脏及胆管功能相关的指标却出现明显改变,2周时血尿素氮(BUN)水平开始增高,8周时 BUN、血肌酐(CR)及胆红素水平明显增高,说明此时肾脏及胆管功能已明显受损。同时,组织病理切片的结果与生化指标的意义相一致,肝、肾组织中发现细胞凋亡,但无细胞坏死和炎症细胞浸润。肾脏组织中细胞凋亡的程度随材料蓄积时间的延长而逐渐增加。虽然有研究发现,纳米材料可导致肝细胞坏死[11],这可能由于不同材料毒性作用机制不同而导致的。
如何理解细胞与纳米生物材料相互作用的分子机制,使纳米生物材料的基础结构与自然骨的力学特性相匹配;同时又能正确评估纳米材料的生物安全性,以保障纳米技术在纳米医学和纳米生物学方面的更好应用,这是纳米生物材料工作者要面临的重要挑战。
4 结论
n-HA/CS复合材料能抑制MC3T3-E1成骨细胞的生长,在体内经过SD大鼠的肝脏、肾脏以及胆管等代谢器官时,可诱导组织细胞发生凋亡,当凋亡细胞的数量超过一定限度,脏器功能出现失代偿而引发一系列全身症状。但该材料诱导细胞凋亡的具体途径还需进一步研究证实。
[1]Ou KL,Wu J,Lai WF,et al.Effects of the nanostructure and nanoporosity on bioactive nanohydroxyapatite /reconstituted collagen by electrodeposition [J].J Biomed Mater Res A,2010,92(3):906-912.
[2]Albrecht C,Scherbart AM,Berlo DV,et al.Evaluation ofcytotoxic effects and oxidative stress with hydroxyapatite dispersions of different physicochemical properties in rat NR8383 cells and primary macrophages[J].Toxicol In Vitro,2009,23(3):520-530.
[3]Liao S,Tamura K,Zhu Y,et al.Human neutrophils reaction to the biodegraded nano-hydroxyapatite/collagen and nanohydroxyapatite/collagen/poly(L-lactic acid)composites[J].J Biomed Mater Res A,2006,76(4):820-825.
[4]Kashiwazaki H,Kishiya Y,Matsuda A,et al.Fabrication of porous chitosan/hydroxyapatite nanocomposites:Their mechanical and biological properties[J].Biomed Mater Eng,2009,19(2):133-140.
[5]Zhou Gang,Li Yubao,Zhang Li et al.,Preparation and characterization ofnano-hydroxyapatite/ chitosan / konjac glucomannan composite[J].Journal of Biomedical Material Research Part A,2007,83A:931-939.
[6]Watari F,Abe S,Koyama C,et al.Behavior of in vitro,in vivo and internal motion of micro/nano particles of titanium,titanium oxides and others[J].Journal of the Ceramic Society of Japan,2008,116(1349):1-5.
[7]Motskin M,Wright DM,Muller K,et al.Hydroxyapatite nano and microparticles:correlation ofparticle properties with cytotoxicity and biostability[J].Biomaterials,2009,30(19):3307-3317.
[8]Lu Xiaoyan,Jin Tingting,Jin Yachao,et al.Toxicogenomic analysis of the particle dose- and size-response relationship of silica particles-induced toxicity in mice [J].Nanotechnology,2013,24(1):015106.
[9]Xu Pengjuan,Xu Jing,Liu Shichang,et al.Nano copper induced apoptosis in podocytes via increasing oxidative stress[J].J Hazard Mater,2012,241 -242:279 -286.
[10]Yeo MK,Pak SW.Exposing zebrafish to silver nanoparticles during caudal fin regeneration disrupts caudal fin growth and p53 signaling[J].Molecular&Cellular Toxicology,2008,4(4):311-317.
[11]Chen Jinyuan,Dong Xia,Zhao Jing,et al.In vivo acute toxicity of titanium dioxide nanoparticles to mice after intraperitioneal injection[J].J Appl Toxicol,2009,29(4):330 -337.

