卵巢miRNA的表达与功能研究进展
张建芳,张水文,李建华,郭军红,徐 野
(北京军区总医院生殖医学中心,北京 100700)
微小RNA(microRNA,miRNA)已经成为近年来生物学研究的热点之一。miRNA对动物生长、发育、成熟的时序调控、组织细胞的增殖、凋亡与分化以及人类疾病的发生中均发挥着重要作用。本文就miRNA在卵巢中的表达及可能的功能做一文献综述。
1 miRNA概述
微小RNA(microRNA,miRNA)是一类内源性非蛋白质编码的RNA分子,约含有19~25个核苷酸(3’端可有1~2个碱基长度的变化)。lin-4是Lee等[1]在研究秀丽隐杆线虫(Caenorhabditis elegans)的发育中最早发现的小分子,它能够通过与其3’UTR结合,调控线虫细胞的时序发育。随后,在线虫(C.elegans和C.briggsae)、果蝇(Drosophila melanogaster)、斑马鱼(Danio rerio)、HeLa 细胞、拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)及人类等多种真核生物中克隆出了上百种类似lin-4的小分子 RNA[2-4],命名为微小 RNA(microRNA,miRNA)。
miRNA有其自身的生物学生特性,研究发现大约50%的miRNA基因彼此相邻、排列成簇,带有自己独立的转录启动子[5];其次,从低等的线虫到人类,miRNA在进化上呈非常显著的保守趋势,let-7是最具有保守性的miRNA,miRNA的这一特征为生物的进化提供了有力的证据[3];此外,miRNA的表达具有时序性和组织特异性,细胞和组织特异性以及表达水平的显著变化,都提示我们miRNA可能参与了发育过程的调控,在复杂的调控网络中发挥重要作用。
2 miRNA生物合成及其作用机制
目前,对于动物(尤其是人类)miRNA的生物合成过程已经初步得到了诠释。首先,miRNA基因的初级转录产物(pri-miRNA)在细胞核中被RNaseⅢDrosha 切割成前体 miRNA(pre-miRNA)[6,7],在最初的剪切后,pre-miRNA在转运蛋白exportin-5的作用下由核内转运到胞质中,然后由另一种RNase IIIDicer进一步切割产生成熟的miRNA。这些成熟的miRNA与其他蛋白质一起组成RISC(RNA-induced silencing complex)复合体,从而引起靶mRNA的降解或者翻译抑制[8],miRNA生物合成过程如图1所示。
miRNA对基因表达转录后调控通过翻译促进、翻译抑制和mRNA的降解这三种作用方式实现,多种生理功能(如细胞增殖、凋亡、分化以及代谢等)均受到miRNA对基因调控的影响。降解途径主要发生在植物中,miRNA在动物中则主要通过翻译抑制实现[9]。Vasudevan等的研究结果显示,肿瘤坏死因子 α(tumor necrosis factor α,TNFα)受 miR-369-3的调控促进作用是通过翻译抑制而实现的[10]。
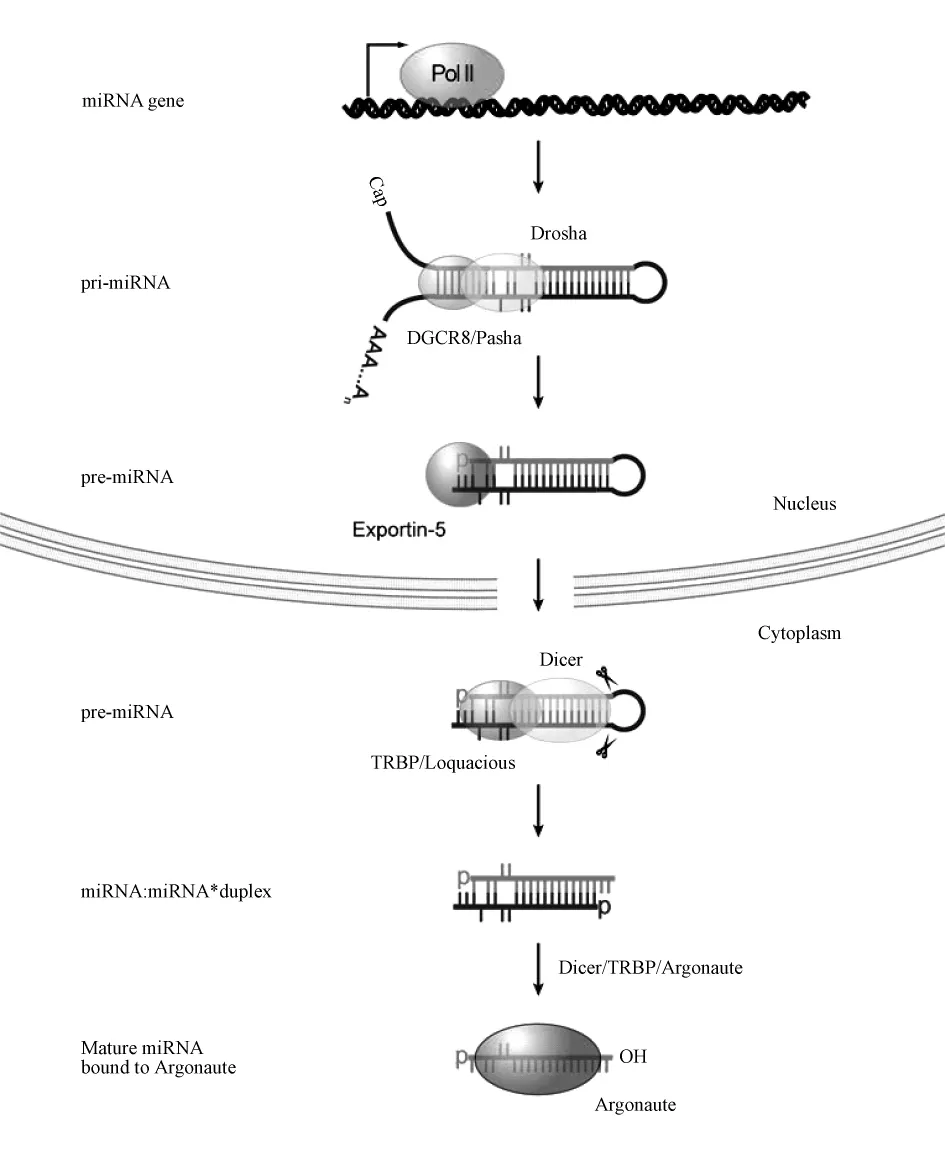
图1 miRNA的生物合成[11]
3 miRNA在卵巢中的表达与功能
3.1 miRNA在卵巢中的表达
哺乳动物卵巢最重要的功能是卵母细胞发育和排卵。在卵巢中,颗粒细胞是产生雌激素的主要部位并将内分泌信号传输到相应靶器官。卵巢体细胞为卵母细胞生长和发育提供支持和营养,颗粒细胞分泌LH,在LH峰到来时引起排卵。这些响应包括卵母细胞减数分裂、类固醇激素合成、卵泡发育、卵丘扩展、颗粒细胞黄体化和产生孕激素,最终促进卵母细胞成熟[12,13]。
卵巢上miRNAs通过RNase分解酶III的作用,使pre-miRNA转化为成熟miRNA参与卵巢功能的调控。目前,利用Dicer敲除模型可进行miRNA在小鼠卵巢的功能研究。Dicer-/-导致卵巢卵子发生、卵母细胞成熟、排卵和不育等生殖障碍[14,15]。关于miRNAs在卵母细胞发育和成熟中的功能仍不十分清楚。然而,有研究表明卵巢中miRNAs通过作用于颗粒细胞发挥功能将在后面章节中详细介绍。表达于小鼠卵巢的 miRNA有上百种,特定miRNA的功能及其靶基因还有待进一步研究。
目前,利用基因芯片和克隆技术,检测了卵巢中miRNA的表达,结果显示,在成年小鼠卵巢中表达122种miRNAs,而在新生小鼠卵巢中表达的miRNA有177种(进一步研究发现其中4种miRNAs在 Nobox-/-卵巢中显著下调[16-18]。对小鼠颗粒细胞中miRNAs检测结果表明,经过hCG刺激后有3种miRNA显著上调,以miR-132和miR-212上调最为显著,同时有10种miRNA显著下调,将体外培养的颗粒细胞用环腺苷酸(cyclic adenosine monophosphate,cAMP)处理,结果发现cAMP同样可促进miR-132和miR-212的表达,进一步研究显示,在颗粒细胞中miR-132和miR-212通过转录后调控的方式调控可与类固醇激素生成因子(steroidogenic factor 1,SF-1)相互作用的转录抑制子C-末端结合蛋白1(C-terminal binding protein1,CtBP1)蛋白水平的表达进而调控类固醇激素的合成和分泌[19]。在猪卵巢中,共检测到58种miRNA,miR-31和miR-92在猪卵巢中呈高表达[16]。
在敲除动物模型中,利用经典的AMH II型受体启动子Cre(Amhr2Cre+)特异性敲除雌性生殖系统中的Dicer1,产生的Dicer1f1/f1;Amhr2Cre+雌鼠不育,而雄性小鼠具有正常的生育能力。而在进一步研究中发现,Dicer1f1/f1;Amhr2Cre+雌鼠具有正常的交配能力,且具有正常的发情周期,卵子也可以正常受精,只是排卵率明显下降。所以单纯卵巢特异性敲除Dicer1并不能引起不育,Dicer1f1/f1;Amhr2Cre+雌鼠不育的主要原因可能与其输卵管的表型变化有关[20]。
3.2 miRNA与生殖细胞和胚胎性腺发育
胚胎性腺发育是许多基因精密调控的结果,在性腺发育中miRNA可能通过参与调控某些基因的表达而发挥其生物学功能。Katsuhiko等[21]在9.5~13.5 dpc胚胎原始生殖细胞中,检测到 4种miRNA表达下调,包括 miR-141,-200a,-200c和-323,miR-141和-200c都编码于小鼠6号染色体(~2000 kb)中包含 Nanog,Stella/PGC7/Dppa3和Gdf3的片段,而且在人和小鼠中,miR-141和-200c的序列完全匹配,提示二者可能来源于相同的前体RNA(pri-RNA),而且在小鼠和人的生殖细胞发育中具有相似的功能[22]。在11.5 ~13.5 dpc 胚胎性腺中,let-7家族成员let-7a,d,e,f和g在11.5 dpc性腺中表达上升,13.5 dpc时表达量最高,而这种上调作用仅在雄性原始生殖细胞中出现,这一结果提示miRNAs与原始生殖细胞中性别分化过程相关,而从13.5 dpc到出生前后的雄性生殖细胞中,miR-17-92维持高的表达水平,提示miR-17-92可能参与了雄性生殖细胞的进一步增殖[23]。
另外,miR-17-92家族成员(除了miR-17-3p外)均可在生殖细胞中检测到,且呈高表达,而这种高的表达水平在生殖细胞发育中一直持续,表明miR-17-92家族可能与原始生殖细胞增殖有关密切的关系。此外,miR-17-92对哺乳动物癌症细胞具有普遍的促进细胞增殖和存活的作用[24]。
在鸡胚中,miR-202参与鸡胚性别决定,而且miR-202*与鸡胚性腺分化为睾丸具有密切的相关性。体内注射17-β雌二醇导致雌性雄性化以及雄性性腺中miR-202*表达降低到与雌性相似的表达水平。雌激素合成阻断后,雌性性腺雄性化,这与miR-202*表达增加和下调卵巢FOXL2基因表达以及上调睾丸相关基因SRY和SOX9表达相关[25]。
我们前期的研究结果发现,miR-143参与小鼠原始卵泡的形成过程,通过抑制前颗粒细胞增殖和调控细胞周期蛋白的表达实现的[26]。
目前,关于miRNAs在卵母细胞发育和成熟过程中的功能及其合成途径仍不十分清楚。有研究显示Dicer-/-导致卵泡发育、卵母细胞成熟以及排卵等 生 殖 障 碍[14,15,27]。miRNA 合 成 特 有 的 酶DGCR8敲除能特异性阻断miRNA作用通路[28],而定向敲除卵母细胞中的DGCR8,卵母细胞成熟不受影响[29]。对牛卵母细胞研究显示NOBOX是miR-196a潜在的靶基因,在牛早期胚胎发育中,miR-196a调控内源性NOBOX的表达,此时miRNAs不仅抑制转录,而且还可能诱导了目标 mRNA的清除[30]。
3.3 miRNA与颗粒细胞功能及卵巢激素调控
Yao等研究结果显示miR-224通过促进cyp19a1基因表达促进小鼠腔前卵泡颗粒细胞17β-雌二醇的分泌,对孕酮分泌没有显著影响,进一步研究显示,miR-224通过介导TGF-b1/Smad4信号通路调控小鼠颗粒细胞增殖[31]。此外,在研究miRNAs影响人卵巢细胞性腺类固醇激素分泌中,特异性抑制孕酮、睾酮和雌二醇的作用的miRNA分别为36、51和57种,而特异性促进孕酮和雌二醇的分泌的miRNA分别为10和1种,结果表明具有抑制性腺类固醇激素分泌的miRNA占多数[32];其中miR-378通过下调颗粒细胞芳香化酶活性抑制雌激素合成[33]。
颗粒细胞中LH诱导排卵和黄体化。研究结果表明,小鼠在注射hCG/LH 4 h后,颗粒细胞中显著上调的 miRNA有14种,其中 miR-132、miR-212和miR-21表达量上升最为明显,进一步研究显示,当miR-21的表达下降到基础水平的2/7时诱导颗粒细胞凋亡[34],体内实验也证实miR-21具有抑制颗粒细胞凋亡的功能。Ma等[35]研究表明miR-378在黄体颗粒细胞凋亡中通过靶基因γ-干扰素受体1(interferon gamma receptor 1,IFNGR1)发挥抑制功能。
在哺乳动物卵巢中,卵巢颗粒细胞在雌激素和孕激素分泌中发挥重要作用,而雌激素和孕酮的周期性变化对于正常雌性生殖活动的维持是必需的,目前研究结果显示,性腺激素与miRNA的相互作用对于卵巢功能的维持发挥着至关重要的作用[36]。
关于激素与miRNA之间的关系,LH/hCG调控miRNAs的表达是近年来普遍认可的观点,LH/hCG可上调卵巢颗粒细胞中miR-132和miR-212的表达,miR-132是通过靶基因C-terminal结合蛋白(C-terminal binding protein 1,CTBP1)在转录后调控颗粒细胞的功能。在卵巢中,follicle stimulating hormone(FSH)卵子发生中不仅促进颗粒细胞的增殖和分化[37],而且促进腔前卵泡发育为排卵前卵泡,在颗粒细胞中,FSH可上调17种miRNA的表达,被FSH下调的miRNA有14种,同时FSH可促进颗粒细胞孕激素的分泌。miR17-5p和let-7b缺乏可导致小鼠黄体化不足和不孕,这种效应可通过卵巢注射内miR17-5p和let7b被逆转,表明miRNAs在黄体形成和功能维持中发挥重要作用[38]。
最近研究表明,许多miRNA参与人卵巢细胞的类固醇激素合成,其中有19种miRNAs对孕激素、雄激素和雌激素合成起抑制作用(miR-108、miR-135、miR-146、miR-19a、miR-20、miR-27、miR-28、miR-29、miR-125b、miR-126、 miR-137、miR-184、miR-31、miR-105、miR-128、miR-129、miR-132、miR-140和miR-188),推测这些miRNA对内分泌器官活性发挥生理抑制功能;有7种miRNA促进孕酮分泌(miR-18、miR-24、miR-25、miR-32、miR-122、miR-125和miR-182)[36]。Kuokkanen 等通过对子宫 miRNA的研究结果显示,在分泌期子宫中表达上调的12种miRNAs包括 miR-29b/c、miR-30b/d、miR-31、miR-193a-3p、 miR-203、miR-204、miR-200c、miR-210、miR-345和miR-582-5p,而在分泌期子宫中,孕酮是重要的促进因子,此时被上调的miRNAs的靶基因预测结果显示大多是参与细胞周期调节的一些蛋白,如 cyclins、Cdks和/或转录因子 E2F3 等[31]。
3.4 miRNA与卵巢病理
近年来,通过对肿瘤中miRNA的研究结果显示,miRNAs可能作为某些特定肿瘤组织的生物学标记物,在许多病理诊断中提供有用的检测手段。在卵巢中,Iorio等[39]通过对肿瘤组织和正常组织比较分析,结果显示miRNA在卵巢上皮组织中表达差异,其中,卵巢癌组织中过表达的miRNA包括miR-200a、miR-141、miR-200c 和 miR-200b,而明显下调的有 miR-199a、miR-140、miR-145 和 miR-125b1。卵巢功能早衰(premature ovarian failure,POF)组织中,miR-202、miR-146a、miR-125b-2* 、miR-139-3p、miR-654-5p、miR-27a、miR-765、miR-23a、miR-342-3p和miR-126过表达,而let-7c和miR-144表达低于正常组织[40]。
4 展望
目前对miRNA的研究还远不够深入,许多奥秘有待探索。随着研究的不断展开和深入,对于卵巢中表达的miRNA,如何参与卵巢功能调控,以及调控靶基因预测,以及利用多种分析手段研究miRNA与卵巢疾病之间的关系,为miRNA在干预生殖与发育调节、治疗生殖相关疾病、辅助生殖等领域提供新策略,也为不孕不育患者带来新的希望。
[1] Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J].Cell,1993,75(5):843 -854.
[2] Lagos-quintana M,Rauhut R,Lendeckel W.Identification of novel genes coding for small expressed RNAs[J].Science,2001,294(5543):853-858.
[3] Lau NC,Lim LP,Weinstein EG.An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans[J].Science,2001,294(5543):858 -862.
[4] Lee RC,Ambros V.An extensive class of small RNAs in Caenorhabditis elegans[J].Science,2001,294(5543):862-864.
[5] Pasquinelli AE.miRNAs:deviants no longer[J].Trends Genet,2002,18(4):171 -173.
[6] Lee Y,Kim M,Han J,et al.MicroRNA genes are transcribed by RNA polymerase II[J].EMBO J.2004,23:4051 -4560.
[7] Cai X,Hagedorn CH,Cullen BR.Human microRNAs are processed from capped,female fertility and normal development of the female reproductive system [J].Endocrinology,2004,149(12):6207-6212.
[8] Bartel DP.MicroRNA genomics,biogenesis,mechanism,and function.Cell,2004,116(2):281 -297.
[9] Esquela-Kerscher A,Slack FJ.Oncomirs-microRNAs with a role in cancer.Nat Rev Cancer[J],2006,6(4):259 -269.
[10] Vasudevan S,Tong Y,Steitz JA.Switching from repression to activation:microRNAs can up-regulate translation[J].Science,2007,318(5858):1931-1934.
[11] Bushati N,Cohen SM.microRNA functions[J].Annu Rev Cell Dev Biol,2007,23:175 -205.
[12] Gallo RV.Pulsatile LH release during the ovulatory LH surge on proestrus in the rat[J].Biol Reprod,1981,24:100 -104.
[13] Jamnongjit M,Gill A,Hammes SR.Epidermal growth factor receptor signaling is required for normal ovarian steroidogenesis and oocyte maturation[J].Proc Natl Acad Sci U S A,2005,102:16257-16262.
[14] Lei L,Jin S,Gonzalez G,et al.The regulatory role of Dicer in folliculogenesis in mice[J].Mol Cell Endocrinol,2010,315:63-73.
[15] Otsuka M,Zheng M,Hayashi M,et al.Impaired microRNA processing causes corpus luteum insufficiency and infertility in mice[J].J Clin Invest,2008,118:1944 -195.
[16] Kim HJ,Cui XS,Kim EJ,et al.New porcine microRNA genes found by homology search [J].Genome,2006,49(10):1283-1286.
[17] Ro S,Song R,Park C,et al.Cloning and expression profiling of small RNAs expressed in the mouse ovary[J].RNA,2007,13:2366-2380.
[18] Fiedler SD,Carletti MZ,Hong X,et al.Hormonal regulation of MicroRNA expression in periovulatory mouse mural granulosa cells[J].Biol Reprod,2008,79:1030 -1037.
[29] Dammer EB,Sewer MB.Phosphorylation of CtBP1 by cAMP-dependent protein kinase decrease target mRNA levels[J].Nature,2008,466(7308):835-840.
[20] Hong X,Luense LJ,McGinnis LK,et al.Dicer1 is essential for female fertility and normal development of the female reproductive system[J].Endocrinology,2008,149:6207 -6212.
[21] Hayashi K,Chuva de Sousa Lopes SM,Kaneda M,et al.MicroRNA Biogenesis Is Required for Mouse Primordial Germ Cell Development and Spermatogenesis[J].PLoS ONE,2008,3(3):1738-1747.
[22] Hart AH,Hartley L, ParkerK, etal. Thepluripotency homeobox gene NANOG is expressed in human germ cell tumors[J].Cancer,2005,104:2092 -2098.
[23] Johnson SM,Grosshans H,Shingara J,et al.RAS is regulated by the let-7 microRNA family [J].Cell,2005,120:635-647.
[24] Zhang B,Pan X,Cobb GP,et al.MicroRNAs as oncogenes and tumor suppressors[J].Dev Biol,2007,302:1 -12.
[25] Bannister SC,Tizard ML,Doran TJ,et al.Sexually dimorphic microRNA expression during chicken embryonic gonadal development[J].Biol Reprod,2009,81:165 -176.
[26] Zhang JF,Ji XW,Zhou DD,et al.miR-143 is critical for the formation of primordial follicles in mice[J].Front Biosci,2013,1(18):588-597.
[27] Nagaraja AK,Andreu-Vieyra C,Franco HL,et al.Deletion of Dicer in somatic cells of the female reproductive tract causes sterility[J].Mol Endocrinol,2008,22:2336 -2352.
[28] Wang Y,Medvid R,Melton C,et al.DGCR8 is essential for microRNA biogenesis and silencing of embryonic stem cell selfrenewal[J].Nat Genet,2007,39:380 -385.
[29] Suh N,Baehner L,Moltzahn F,et al.MicroRNA function is globally suppressed in mouse oocytes and early embryos[J].Curr Biol,2010,20:271 -277.
[30] Tripurani SK,Lee KB,Wee G,et al.MicroRNA-196a regulates bovine newborn ovary homeobox gene(NOBOX)expression during early embryogenesis[J].BMC Dev Biol,2011,11:25.
[31] Yao G,Yin M,Lian J,et al.MicroRNA-224 is involved in transforming growth factor-beta-mediated mouse granulosa cell proliferation and granulosa cell function by targeting Smad4[J].Mol Endocrinol,2010,24:540 -551.
[32] Sirotkin AV,Ovcharenko D,Grossmann R,et al.Identification of microRNAs controlling human ovarian cell steroidogenesis via a genome-scale screen[J].J Cell Physiol,2009,219:415 -420.
[33] Xu S,Linher-Melville K,Yang BB,et al.Micro-RNA378(miR-378)regulates ovarian estradiol production by targeting aromatase[J].Endocrinology,2011,152(10):3941 -3951.
[34] Carletti MZ,Fiedler SD,Christenson LK.MicroRNA 21 blocks apoptosis in mouse periovulatory granulosa cells[J].Biol Reprod,2010,83:286-295.
[35] Ma T, JiangH, GaoY, etal. Microarray analysisof differentially expressed microRNAs in nonregressed and regressed bovine corpus luteum tissue;microRNA-378 may suppress luteal cell apoptosis by targeting the interferon gamma receptor 1 gene.J Appl Genet,2011,52(4):481 -486.
[36] Lam EW,Shah K,Brosens J.The diversity of sex steroid action:the role of microRNAs and FOXO transcription factors in cycling endometrium and cancer[J].J Endocrinol,2012,212(1):13-25.
[37] 周莹,朱英哲,张素华,等.卵巢早衰microRNA的差异表达及其作用[J].中国优生与遗传杂志,2011,19(5):20-22.
[38] Otsuka M,Zheng M,Hayashi M,et al.Impaired microRNA processing causes corpus luteum insufficiency and infertility in mice[J].J Clin Invest,2008,118(5):1944 - 1954.
[39] Rosenfeld N, AharonovR, MeiriE, etal. MicroRNAs accurately identify cancer tissue origin [J].Nat Biotechnol,2008,26(4):462-469.
[40] Iorio MV,Visone R,Di Leva G,et al.MicroRNA signatures in human ovarian cancer[J].Cancer Res,2007,67:8699-8707.

