小鼠细粒棘球蚴感染早期对NK细胞影响的初步研究①
印双红 陈小林 徐芳洁 张旭勇 吴向未 侯 隽 陈雪玲
(石河子大学医学院免疫学教研室,石河子832002)
包虫病(Hydatid disease)又称棘球蚴病,是棘球蚴寄生于中间宿主引起的一种严重影响人畜健康的寄生虫疾病。包虫病在手术治疗过程中或者在正常患者体内,由于包囊意外破裂,部分原头节可能进入组织内,造成再次感染,也给包虫病的治疗带来很大困难[1]。虫体之所以能在宿主体内长期生存,有赖于对宿主的免疫逃避功能。目前关于虫体免疫逃逸的研究主要是Th1/Th2的漂移可能产生的免疫逃避[2]。对于NK细胞(Natural killer cell)在包虫免疫逃逸中的作用,有临床研究显示其NK细胞活性明显下降,目前实验研究的资料较少[3]。本文主要探讨细粒棘球蚴感染小鼠后,对小鼠NK细胞的影响。
1 材料与方法
1.1 材料
1.1.1 实验材料 雌性BALB/c小鼠,6~8周,购自新疆医科大学第一附属医院实验动物中心。
1.1.2 主要试剂和仪器 流式抗体Anti-Mouse CD49b-FITC(DX-5)、Anti-Mouse CD314-PE(NKG2D)购自 eBioscience公司;流式细胞仪(FACS AriaⅢ)购自BD公司;小鼠淋巴细胞分离液购自Solarbio;Yac-1细胞购自上海锐聪科技;酶标仪购自BIO-RAD公司。
1.2 方法
1.2.1 细粒棘球蚴原头节的制备 从感染细粒棘球蚴病的羊肝上,无菌抽取无钙化、无感染、完整的单囊型细粒棘球蚴包囊内容物,置于无菌离心管内,原头节(Protoscole,PSC)自然沉淀,再用含有100 U/ml青霉素和链霉素双抗的无菌PBS(pH7.3)漂洗3次,除去育囊碎片使其自然沉淀,经0.5%伊红染色5分钟,在显微镜下鉴定具有活性的虫体数(>90%),用含双抗的无菌 PBS稀释制成含有原头节10 000个/ml的原头节悬液,备用。
1.2.2 建立细粒棘球蚴感染小鼠动物模型 将60只健康BALB/c小鼠,随机分成实验组和对照组。实验组:腹腔接种浓度为10 000个/ml原头节,加入100 U/ml青霉素和100 U/ml链霉素0.2 ml/只;对照组:腹腔接种PBS加入100 U/ml青霉素和100 U/ml链霉素0.2 ml/只,分别在1、3、5、7、9、12 天的时候颈椎脱臼法处死小鼠,无菌摘取脾脏,制备脾细胞悬液。
1.2.3 小鼠脾脏细胞分离 脱颈处死小鼠,无菌摘取小鼠脾脏,用1支5 ml和1支1 ml注射器在含有少许PBS的小平皿中刮出脾细胞。用1 ml注射器抽吸刮出的脾细胞3~5次,使脾细胞尽量分散。向一新离心管加入3 ml的小鼠淋巴细胞分离液,再将约1.5 ml的脾细胞悬液缓慢加入(V分离液∶V脾细胞悬液=2∶1),2 000 r/min离心20分钟。取出中间的云絮层(淋巴细胞层)用3 ml PBS,1 000 r/min离心5分钟洗涤2~3次。最后将沉淀细胞悬浮于1 ml 1640液中。细胞计数,配成(2~3)×107ml-1备用。
1.2.4 LDH法检测NK的杀伤活性 取效应细胞淋巴细胞1×107个/ml和靶细胞Yac-1 cells 1×105个/ml各0.1 ml(E∶T=100∶1)加入细胞培养板中,设3复孔,同时设靶细胞自然释放孔(0.1 ml靶细胞+0.1 ml 10%FCS-RPMI1640培养液)和最大释放孔(0.1 ml靶细胞+0.1 ml 1%NP40液),1 000 r/min低速离心2分钟。置37℃,5%CO2孵育2小时。1 000r/min离心5分钟。吸取各孔上清0.1 ml加至新96孔板中,37℃,10分钟。每孔再加入0.1 ml新配制的LDH底物溶液,室温避光反应10~15分钟。加入30 μl 1 mol/L柠檬酸终止液终止酶促反应。酶联监测仪在570 nm波长下读各孔A值。计算:根据下列公式计算NK细胞活性:NK细胞活性
1.2.5 流式细胞染色及检测 取1×106个脾细胞,向各管中加入小鼠血清孵育15分钟,再分别加入 Anti-Mouse CD49b-FITC(DX-5),Anti-Mouse CD314-PE(NKG2D)抗体,4℃下避光孵育30分钟,进行表面染色;PBS洗涤1次,加入0.5 ml PBS重悬细胞,用FACS AriaⅢ流式细胞仪进行检测。
1.3 统计学分析 所有数据用SPSS17.0软件进行统计学分析,多组样本之间用方差分析,两组间比较采用两样本均数的t参数检验或q检验。
2 结果
2.1 细粒棘球蚴感染小鼠不同时间,对小鼠NK细胞杀伤活性的影响 乳酸脱氢酶法(LDH)检测结果显示:经统计分析小鼠腹腔接种细粒棘球蚴后1、3、5、7、9、12天的NK细胞对Yac-1细胞的裂解率(NK细胞杀伤活性)与对照组比较差异均有统计学意义(P<0.05),其中在小鼠感染后的1、3、5、9 天,P <0.001,见图1。随着时间的推移感染组小鼠NK细胞的杀伤活性呈下降的趋势,经q检验分析,各组之间均有统计学意义(图1);由第1天的最高值(17.7%±0.561%)到第12天下降至(8.10%±0.745%),并且低于对照组(9.25%±0.401%)(如图2)。
2.2 小鼠细粒棘球蚴感染早期对NK细胞表面激活受体NKG2D表达的影响 流式细胞术(FCM)检测细粒棘球蚴感染早期小鼠对NK细胞表面激活受体NKG2D的表达,细粒棘球蚴感染早期小鼠后,随着时间的延长NK细胞的活性受体NKG2D的表达量呈下降的趋势,第1天最高,且显著高于对照组(P<0.001);第12天最低,明显低于对照组(P<0.001)。与对照组比较,感染后 1、3、9、12 天NKG2D的表达量都有统计学差异(P<0.05或P<0.001)(图3、4)。

图1 细粒棘球蚴感染早期小鼠对NK细胞活性的影响Fig.1 The influence of spleen NK cytotoxic activity in early Echinococcus granulosus infected BALB/c mice
2.3 小鼠细粒棘球蚴感染早期对NK细胞数量的影响 通过流式细胞术(FCM)检测小鼠脾细胞上DX-5的表达情况,了解细粒棘球蚴感染早期小鼠后对NK细胞数量的影响。结果显示,NK细胞数量在感染后有所升高,感染后第1天最高达到7.76%,但随着时间的延长NK细胞数量呈下降的趋势,第5天开始低于感染前,至第12天下降至3.86%最低;经q检验发现,与感染前比较,感染后第 1、3、9、12天NK数量差异都有统计学差异(表1、图5)。
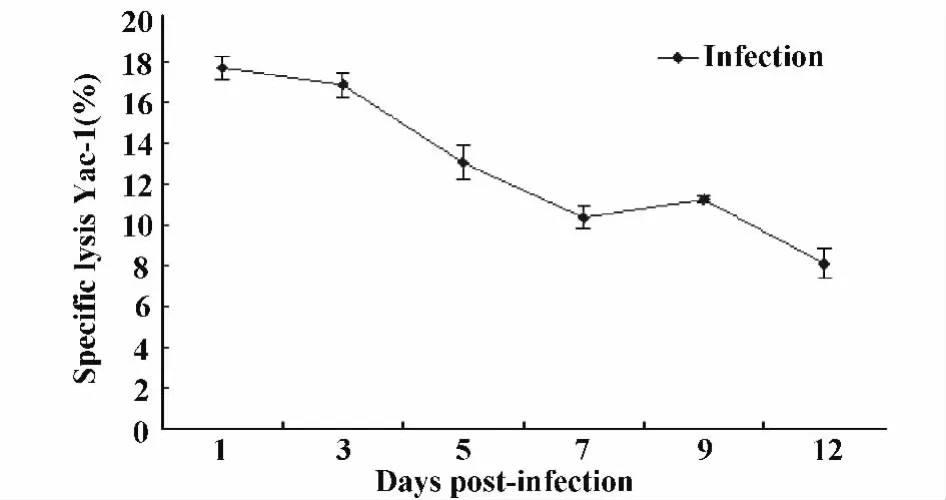
图2 LDH法检测细粒棘球蚴感染早期小鼠不同时间NK细胞杀伤活性的变化趋势Fig.2 Trends of spleen NK cytotoxic activity analyzed by LDH in early stages of infection

图3 流式细胞术检测细粒棘球蚴感染早期小鼠后NKG2D的表达Fig.3 The expression of NKG2D on spleen cells were analyzed by flow cytometry in early stages of infection
2.4 相关性分析 细粒棘球蚴感染小鼠早期,通过对NK细胞的活性及其活性受体NKG2D的表达检测显示:随着感染时间的延迟,NK细胞活性受体NKG2D的表达和NK细胞杀伤活性均呈下降的趋势。相关性分析结果显示,细粒棘球蚴感染小鼠早期,NK细胞的杀伤活性与其活性受体NKG2D的表达呈正相关,相关系数r=0.679(图6)。

表1 FCM检测E.g感染早期BALB/c小鼠对NK细胞数量的影响(%)Tab.1 The number of changes of CD4+CD25+T cells were detected by FCM in the early of E.g infection in BALB/c mice(%)

图4 流式细胞术检测感染组小鼠NKG2D在不同时期NK细胞表达的变化趋势Fig.4 Trends of the levels of NKG2D on spleen cells analyzed by flow cytometry in early stages of infection

图5 FCM检测E.g感染早期BALB/c小鼠NK细胞数量在感染前后的变化Fig.5 Results diagram of the number of NK cells were detected by FCM in the early of E.g infection in BALB/c mice
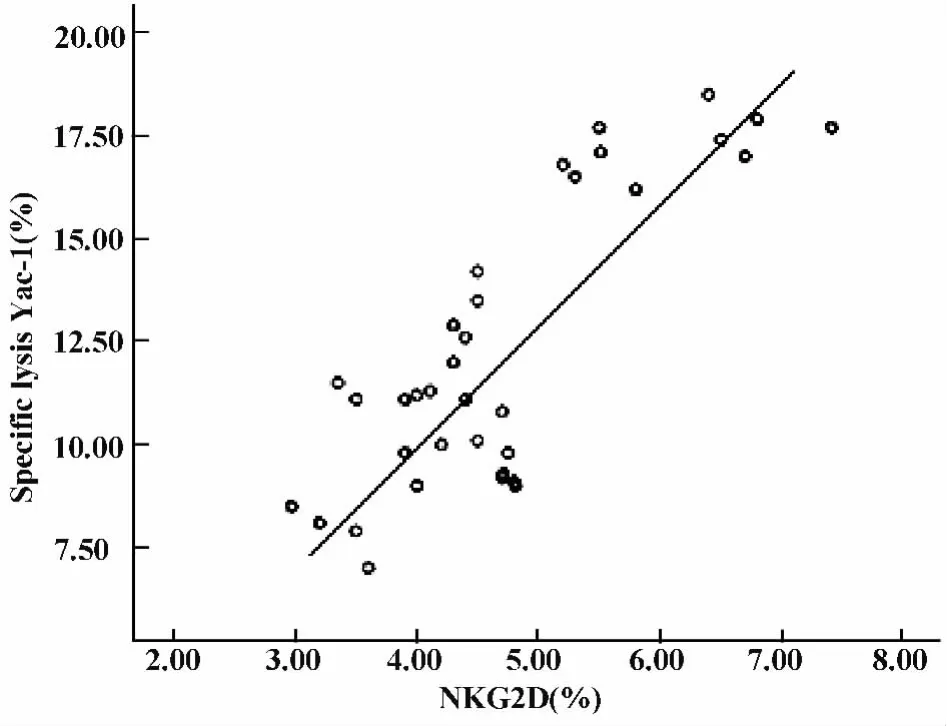
图6 NK细胞杀伤活性与NK细胞活性受体NKG2D的表达相关性分析相关系数(r=0.679)Fig.6 Correlation between NK cytotoxic activity and receptor expression(r=0.679)
3 讨论
细粒棘球蚴感染宿主后能够在宿主体内长期存活的机理虽未完全清楚,NK细胞作为识别病原入侵的第一道防线,没有充分发挥天然免疫,应该是发病的重要原因之一[4]。
对于NK细胞方面的研究,现阶段主要集中在泡球蚴(AE)临床患者的外周血中比例下调现象的研究。Nicod[3]研究AE患者外周血单个核细胞时发现,NK细胞活性明显下降,且NK细胞活性降低与PBMC中NK细胞比例低有关。李富荣[5]也通过检测患者外周血发现,AE患者的NK细胞比例比正常人的降低,同时张琰等[6]的研究也表明,维吾尔族和汉族包虫病病例组中NK细胞比例水平均较健康人组显著降低,提示包虫感染后,可能会抑制NK细胞的一些免疫功能。本实验结果表明,在小鼠细粒棘球蚴感染早期中,小鼠NK细胞及其活性受体NKG2D均呈下降的趋势,感染后第1天最高(显著高于对照组),第5天降至对照组的水平,至第12天时远低于对照组。这可能是由于细粒棘球蚴感染后,小鼠NK细胞数量及其活性受体NKG2D应激性增高,但随着感染时间的延迟,又呈下降趋势至低于正常水平,而处于抑制状态,这与人感染泡球蚴后对NK细胞活性的抑制结果相同[7]。
NKG2D属H型跨膜蛋白,广泛分布于人NK细胞、DC、巨噬细胞、T细胞,是NK细胞表面的活性受体。在小鼠体内,NKG2D主要分布于NK细胞和部分CD8+T细胞。NKG2D无需抗原呈递即可直接识别肿瘤细胞表面表达的配体分子,进而激活或协同刺激免疫效应细胞,从而发挥对肿瘤细胞的杀伤作用[8]。随着活化受体 NKG2D及其配体的发现和研究的深入,发现NK细胞能够识别靶细胞表面压力(热休克、病毒或细菌感染、恶性转化等)诱导下所表达的配体而启动活化信号。这种活化可以不受NK细胞抑制性信号的控制,即NKG2D的单独活化足以刺激NK细胞的活化,并能克服抑制性受体的强势信号。这种被称为“压力诱导(induced-self)”的识别模式使NK细胞能够及时识别各种危险信号[9-11]。NK细胞的杀伤活性与其表面的活性受体NKG2D的表达量呈正相关[12]。有研究报道:HIV病毒的 Nef和 Vif蛋白能部分下调细胞表面NKG2DLs,而降低NKG2D受体介导的NK细胞对靶细胞(杀伤被感染细胞)的杀伤能力[13,14]。弓形体能提高NKG2D的表达和NK细胞的活性,导致怀孕女性和孕鼠妊娠异常[11]。Nicod[3]研究 AE 患者发现,NK细胞活性明显下降;此后,又发现AE也能够通过 MICA/B和 TGF-β的持续表达而抑制了NKG2D的表达,然后改变宿主免疫,利于多房棘球绦虫的侵入[7]。在细粒棘球蚴感染的研究中我们也得到相似结果:我们通过对小鼠感染细粒棘球蚴早期(感染后1~12天),观察NK细胞数量,NK细胞的杀伤活性及其表面的活性受体NKG2D的表达量。结果显示,随着时间的延迟,NK细胞数量和NK细胞杀伤活性下降,NKG2D表达量也降低,NK细胞杀伤活性下降与NKG2D呈正相关,使得棘球蚴逃避宿主的免疫应答,而能在宿主体内长期生存。
1 Adrian Baz,Gustavo,Sylvia Dematteis et al.Complexity and function of cytokine responses in experimental infection by echinococcus granulosus[J].Immunobiology,2006;3(9)3-8.
2 Jankovic D,Liu Z,Gause W C.Th1-and Th2-cell commitment during infectious disease:asymmetry in divergent pathways[J].Trends in Immunology,2001;22(8):450-457.
3 Nicod L,Bresson-Hadni S,Vuitton D A et al.Specific cellular and humoral immune responses induced by different antigen preparations of Echinococcus multilocularis metacestodes in patients with alveolar echinococcosis[J].Parasite,1994;1(3):261-270.
4 Rigano R,Profumo E,Di Feli C E G et al.In vitro production of cytokines by peripheral blood mononuclear cells from hydatid patients[J].Clin Exp Immunol,1995;99(3):433-439.
5 Li F R,Shi Y E,Shi D Z et al.The significance of lymphocyte variations in alveolar echinococcosis patients[J].Chin J Zoonosis,2003;19(3):91-94.
6 张 琰,温 浩,林仁勇et al.细粒棘球蚴病患者淋巴细胞及细胞因子变化的初步观察[J].中国寄生虫学与寄生虫病杂志,2007;25(3):209-212.
7 Zhang S,Hüe S,Sène D et al.Expression of major histocompatibility complex class I chain-related molecule A,NKG2D,and transforminggrowth factor-beta in the liver of humans with alveolar echinococcosis:new actors in the tolerance to parasites?[J].J Infect Dis,2008;197(9):1341-1349.
8 臧怡雯,周易明,陈宗祐.NKG2D及其配体在肿瘤免疫中的研究进展[J].复旦学报,2011,38(4):367-371.
9 Raulet D H.Roles of the NKG2D immunoreceptor and its ligands[J].Nat Rev Immunol,2003;3(10):7812790.
10 Watzl C.The NKG2D receptor and its ligands-recognition beyond the“missing self”[J].Microbes and Infection,2003;5(1):31-37.
11 魏海明,邬 鹏,田志刚.NK细胞识别的新模式:压力诱导模式[J].中国肿瘤生物治疗杂志,2005;12(2):85-88.
12 Xu X,Zhao M,Liu X et al.Toxoplasma gondii infection regulates the balance of activating and inhibitory rece ptorson decidual natural killer cells[J].PLoS One.2013;8(2):e55432.
13 Norman J M,Mashiba M,McNamara L A et al.The antiviral factor APOBEC3G enhances the recognition of HIV-infected primary T cells by natural killer cells[J].Nat Immunol,2011;12(10):975-983.
14 Cerboni C,Neri F,Casartelli N et al.Human immunodeficiency virus 1 nef protein downmodulates the ligands of the activating receptor NKG2D and inhibits natural killer cell-mediated cytotoxicity[J].J Gen Virol,2007;88(Pt 1):242-250.

