caspase-1影响乳腺癌的生长及其对髓源性抑制细胞发育的调控作用①
陈勇军 郑 薇 牛志远 吴 珍 沈萍萍
(南京大学生命科学学院,医药生物技术国家重点实验室,南京210093)
肿瘤是一个由多种细胞组成的异质性组织。除了肿瘤细胞之外,在肿瘤微环境中还存在多种类型的非肿瘤细胞,包括血管内皮细胞、基质成纤维细胞以及一些骨髓来源的免疫细胞(如髓源性抑制细胞、肿瘤相关巨噬细胞、肥大细胞和嗜中性粒细胞等)[1]。其中髓源性抑制细胞(Myeloid-derived suppressor cells,MDSCs)是一类不成熟的髓细胞,由单核细胞、粒细胞和髓系祖细胞等构成[2]。小鼠的MDSCs细胞表面能特征性地表达CD11b和Gr-1。根据形态上的差别,MDSCs可进一步分为单核的髓源性抑制细胞(Monocytic-MDSCs,M-MDSCs)和多形核的髓源性抑制细胞(Polymorphonuclear-MDSCs,PMN-MDSCs)[3]。MDSCs在肿瘤病人和荷瘤小鼠中会大量扩增,并在血液、骨髓、淋巴结、脾脏和肿瘤等部位积累。MDSCs能抑制T细胞的功能,削弱机体的免疫监视和抗肿瘤免疫,从而促进肿瘤生长[4]。肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)是肿瘤微环境普遍存在的一类非实质细胞,几乎所有的实体瘤都能招募TAMs。TAMs具有与M2型巨噬细胞类似的表型,能够促进血管新生、基质重塑。TAMs具有促肿瘤的能力;肿瘤病人中TAMs的密度与不良的预后密切相关[5]。
caspase-1属于胱天蛋白酶家族中的一员,它能够调控细胞凋亡和炎症反应,与肿瘤发生发展中有密切联系。临床研究发现,caspase-1的表达在结肠癌、前列腺癌和卵巢癌等肿瘤中是下调的,而过表达caspase-1则能诱导肿瘤细胞的凋亡[6-8]。caspase-1作为典型的炎症相关caspase,还能够调控肿瘤微环境中的炎症反应和机体的抗肿瘤免疫。在肠炎相关的结肠癌模型中,炎症小体(Inflammasome)介导caspase-1的激活和IL-18的释放可以有效保护上皮细胞的完整性,并能防止肠炎和结肠癌的发生[9-11]。而坏死的肿瘤细胞释放出的危险信号可以激活NLRP3炎症小体和IL-1β的释放,并诱发IL-1β依赖性的获得性免疫,进而抑制肿瘤的生长[12]。这些结果揭示caspase-1具有重要的抗肿瘤功能。然而caspase-1对于肿瘤微环境中各种对肿瘤发展起促进作用的骨髓来源细胞(如MDSCs、TAMs)的调控作用还不是清楚。
本研究中我们利用4T1细胞成功构建了原位种植性乳腺癌模型,并在此模型中发现,caspase-1特异性抑制剂Ac-YVAD-CMK(YVAD)能够促进肿瘤的生长。进一步研究发现,YVAD能够促进荷瘤小鼠外周血、脾脏和肿瘤部位MDSCs的积累;而不影响肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)的浸润和分化。因此,这些结果揭示caspase-1能够通过负调控肿瘤微环境中MDSCs细胞的发育而抑制肿瘤的生长。
1 材料与方法
1.1 材料 BALB/c雌性小鼠(8~10周龄)购自北京维通利华实验动物技术有限公司。免疫组化试剂盒购自福州迈新生物公司。CD11b-PE、F4/80-FITC抗体和anti-F4/80抗体购自eBioscience,Gr-1-PerCP-Cy5.5购自 BD Bioscience,Ac-YVAD-CMK购自Bachem,M-CSF购自Peprotech,Collagase IV和DNase I购自 Sigma。
1.2 原位种植性乳腺癌模型和给药 BALB/c雌性小鼠(8~10周龄)饲养于南京大学医学院SPF级动物房中。小鼠乳腺癌细胞4T1培养在含10%胎牛血清的DMEM(购自Invitrogen)中,收集对数生长期的4T1细胞,用PBS重悬,控制其密度为1×107cells/ml。取10 ml细胞悬液接种于BALB/c小鼠左侧的前肢和后肢脂肪乳腺脂肪垫处。肿瘤接种后第5天开始给药Ac-YVAD-CMK,剂量为5 mg/kg,每天腹腔注射一次(YVAD组);溶剂对照组注射相同量的DMSO(DMSO组)。另设未接种4T1肿瘤细胞的、注射DMSO的正常小鼠组(None)。在指定时间处死小鼠,进行后续实验分析。
1.3 骨髓细胞的分离 运用短颈法处死小鼠,并用酒精消毒。在超净台内用手术剪在股骨关节外侧靠近脊柱位置剪下其后肢,然后剃出肌肉和结缔组织。将股骨和胫骨间的两端的关节剪开,用注射器吸取RPMI 1640(购自Invitrogen),并将骨髓细胞吹到培养皿里面。用40 μm滤网进行过滤,并将细胞悬液转移至15 ml离心管中。1 200r/min,离心10分钟,弃上清,加入1 ml红细胞裂解液裂解红细胞,并再次离心。用RPMI1640重悬细胞,加入M-CSF(100 ng/ml)诱导分化为巨噬细胞,或用于后续的流式细胞仪分析。
1.4 肿瘤细胞的分离 取出肿瘤组织,置于培养皿中,PBS洗涤一次,然后剪碎。加入适量的胶原酶液(含 1 mg/ml collagase IV 和 300 U/ml DNase I的Hanks溶液),用注射器的末端充分研磨,放在37℃细胞培养箱进行消化,共消化大约30分钟,每隔十分钟摇晃一下。将上述组织液用100 μm的滤网过滤至50 ml的离心管中,再用40 μm滤网过滤一次。低速离心一次(500 r/min,1分钟),然后1 200 r/min离心10分钟,并用PBS重复洗涤一次。PBS重悬细胞用于后续的流式细胞分析。
1.5 流式分析 收集细胞于1.5 ml Eppendorf(EP)管中,1 800 r/min离心5分钟 (4℃),再用含2%BSA的PBS洗涤一次。然后加入100 μl抗体工作液(1∶20稀释),重悬细胞;阴性对照样品中加入相应的同型IgG荧光抗体。冰上避光孵育30分钟,期间不断摇动EP管,以防止细胞沉积。用预冷的PBS洗涤3次,1 800 r/min离心5分钟。加500 μl PBS重悬细胞后上样进行流式分析。
1.6 免疫组化 取出肿瘤组织样本,保存于4%多聚甲醛溶液中,然后石蜡包埋并进行切片处理。后续操作步骤按照免疫组化试剂盒的操作说明进行。首先对切片进行脱蜡水化处理和抗原修复处理,并使用3%过氧化氢去除内源性过氧化物酶。然后使用山羊血清室温封闭10分钟,加入 F4/80抗体(1∶50稀释),室温孵育1小时;洗涤后加入对应二抗(1∶50稀释),室温孵育10~15分钟。接着使用DAB显色5~10分钟,苏木精复染3~4分钟,自来水冲洗干净。最后乙醇脱水,二甲苯洗涤3次,中性树脂封片。经免疫组化染色后的切片便可进行显微镜拍照观察和分析。
2 结果
2.1 YVAD促进肿瘤的生长 YVAD能够加剧脾肿大并促进肿瘤生长 小鼠乳腺癌细胞4T1注射到BALB/c雌性小鼠乳腺脂肪垫后,能够在注射部位形成肿瘤原发灶,同时还能产生转移;其病理特征与人体中的乳腺癌十分相近,是研究乳腺癌的理想动物模型[13]。我们在8~10周龄BALB/c雌性小鼠左侧乳腺脂肪垫中注入105个4T1细胞,大约一个星期后可以观察到黄豆大小的肿瘤原位灶的形成(结果未显示);而接种后第15天时可观察到体积明显增大的实体肿瘤(图1A)。在接种肿瘤细胞后的第5天,我们将小鼠随机分组,每组6~7只,实验组腹腔注射YVAD(5 mg/kg),对照组则注射相同体积的DMSO。然后分别在肿瘤种植后的第10、15和20天处死小鼠。我们发现第20天时YVAD给药组中肿瘤重量显著高于DMSO组(图1B)。与正常小鼠比较,DMSO组和YVAD组中荷瘤小鼠的脾脏都明显肿大,而YVAD给药组较DMSO组的脾肿大程度更为严重(图1C和 D)。以上结果表明,抑制caspase-1的活性能够加剧乳腺癌荷瘤小鼠的脾肿大程度并促进肿瘤的生长。
2.2 YVAD促进外周血和脾脏中PMN-MDSCs的积累 YVAD给药会加重荷瘤小鼠体内脾肿大的程度(图1D),这提示caspase-1的活性可能与免疫细胞的发育相关。为了系统性地研究YVAD给药对于荷瘤小鼠体内MDSCs细胞发育的调控作用,我们对其外周血、脾脏和骨髓中的MDSCs细胞数量进行了分析。结果显示,与正常小鼠相比,荷瘤小鼠的外周血中FSChiSSChi细胞所占比例显著增加(P<0.01),而FSClowSSClow细胞数量则显著减少(P<0.01);并且YVAD给药能进一步改变 FSChiSSChi和 FSClowSSClow细胞数量的比例(图2A)。PMN-MDSCs细胞通常表现为FSChiSSChi,于是我们对FSChiSSChi这一群细胞进行了表型分析。我们分别在接种肿瘤细胞后的第15天和第20天对各组小鼠的外周血、脾脏和骨髓中的PMN-MDSCs(CD11b+Gr-1+SSChi)细胞的数量进行了统计分析。第15天时的分析结果表明YVAD给药能够显著增加外周血和脾脏中PMNMDSCs细胞的数量(P值分别为0.009 2和0.004 8),而对于骨髓中PMN-MDSCs细胞没有明显的影响(图2B-D)。而第20天的结果则显示YVAD给药没有显著改变荷瘤小鼠各组织中PMNMDSCs的比例(图2E)。综上,乳腺癌的发展伴随着外周血和脾脏中 PMN-MDSCs细胞的积累,而caspase-1的活性能够调控肿瘤发展早期PMN-MDSCs细胞的发育。
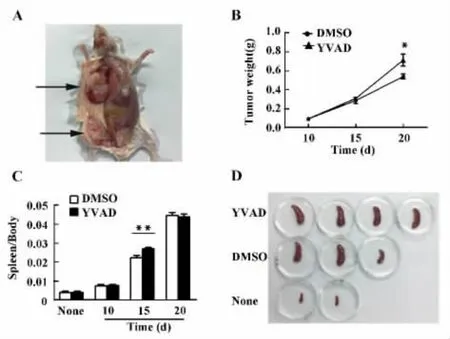
图1 在种植性原位乳腺癌模型中抑制caspase-1的活性能够加剧脾肿大并促进肿瘤的生长Fig.1 Inhibition of caspase-1 aggravated splenomegaly and accelerated tumor growth in orthotopic model of breast cancer
2.3 YVAD能增加肿瘤部位MDSCs的比例 伴随着肿瘤的发展,肿瘤细胞会释放一些细胞因子或化学因子而招募多种炎性细胞至肿瘤微环境中[1]。我们运用H&E染色对不同时间点(10天和15天)的肿瘤组织病理学特征进行了分析。结果显示,DMSO组和YVAD组中肿瘤组织边缘部位均有部分炎性细胞的浸润,并且随着肿瘤的发展炎性细胞的浸润程度增加(图3A)。而肿瘤组织中央部位炎性细胞浸润数量较少;随着肿瘤体积的增大,肿瘤组织内部出现了部分坏死区域(图3B)。以上结果表明,肿瘤的发展伴随了炎性细胞的浸润,同时肿瘤中央部位会出现坏死的状况;然而整体上来看,YVAD给药对于肿瘤组织中炎性细胞的浸润情况和细胞坏死情况没有明显影响。
为了分析肿瘤组织中MDSCs细胞的数量,我们运用流式细胞技术对于细胞表面特征分子CD11b和Gr-1的表达进行了分析。结果显示,CD11b和Gr-1双染后可以将肿瘤微环境中的免疫细胞分为四个亚群;与DMSO组相比,YVAD给药组中MDSCs(CD11b+Gr-1+)比例明显增加,由10.2%增加到19.8%,而 CD11b+Gr-1-细胞数量变化不大(图3C)。对于流式结果统计分析发现,给药组和对照组中MDSCs的数量具有显著的差异(图3D)。这些结果表明caspase-1的活性在MDSCs的发育和积累中发挥负调控的作用。

图2 YVAD促进外周血和脾脏中PMN-MDSCs细胞的积累Fig.2 YVAD treatment promoted expansion of PMN-MDSCs in peripheral blood and spleen
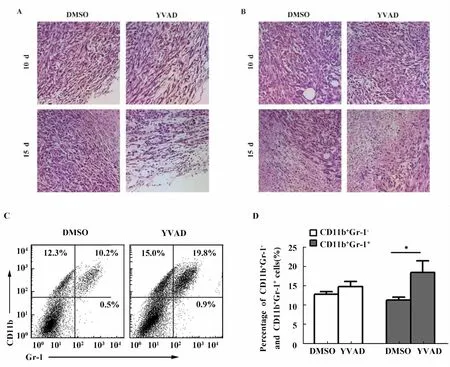
图3 YVAD诱导肿瘤组织中CD11b+Gr-1+细胞的积累Fig.3 Accumulation of CD11b+Gr-1+cells in tumor microenvironment induced by YVAD treatment
2.4 YVAD不影响TAMs的招募和分化 TAMs肿瘤微环境中普遍存在的一类非实质细胞,有研究表明M-MDSCs细胞具有分化为TAMs的能力[5]。为了分析MDSCs比例的变化是否会影响TAMs的比例,我们运用CD11b和F4/80双染的方法检测了肿瘤组织中TAMs(CD11b+F4/80+)的比例。结果显示,对照组和YVAD给药组中TAMs细胞的数量比例分别为8.18%和10.2%。统计学分析流式数据表明,DMSO和YVAD组中TAMs的比例没有显著的差异(P=0.54)(图4A)。我们还运用免疫组化的方法分别检测了第10天和第15天的肿瘤组织中巨噬细胞(F4/80+)浸润情况。结果显示,第15天时TAMs的浸润明显比第10天时增多;而YVAD给药组和DMSO组之间比较,TAMs的浸润情况并无显著差异(图4B)。我们还在体外考察了YVAD对于单核细胞-巨噬细胞分化的调控作用。如图4C所示,DMSO对照组和YVAD给药组(25 μmol/L、50 μmol/L)中 F4/80+细胞的比例分别为 68.9%、62.1%和58.7%。对于平均荧光强度的统计学分析结果表明,YVAD给药对于单核-巨噬细胞的分化过程没有显著地调控(图4D)。因此,YVAD不能调控肿瘤微环境中TAMs的招募和分化。
3 讨论
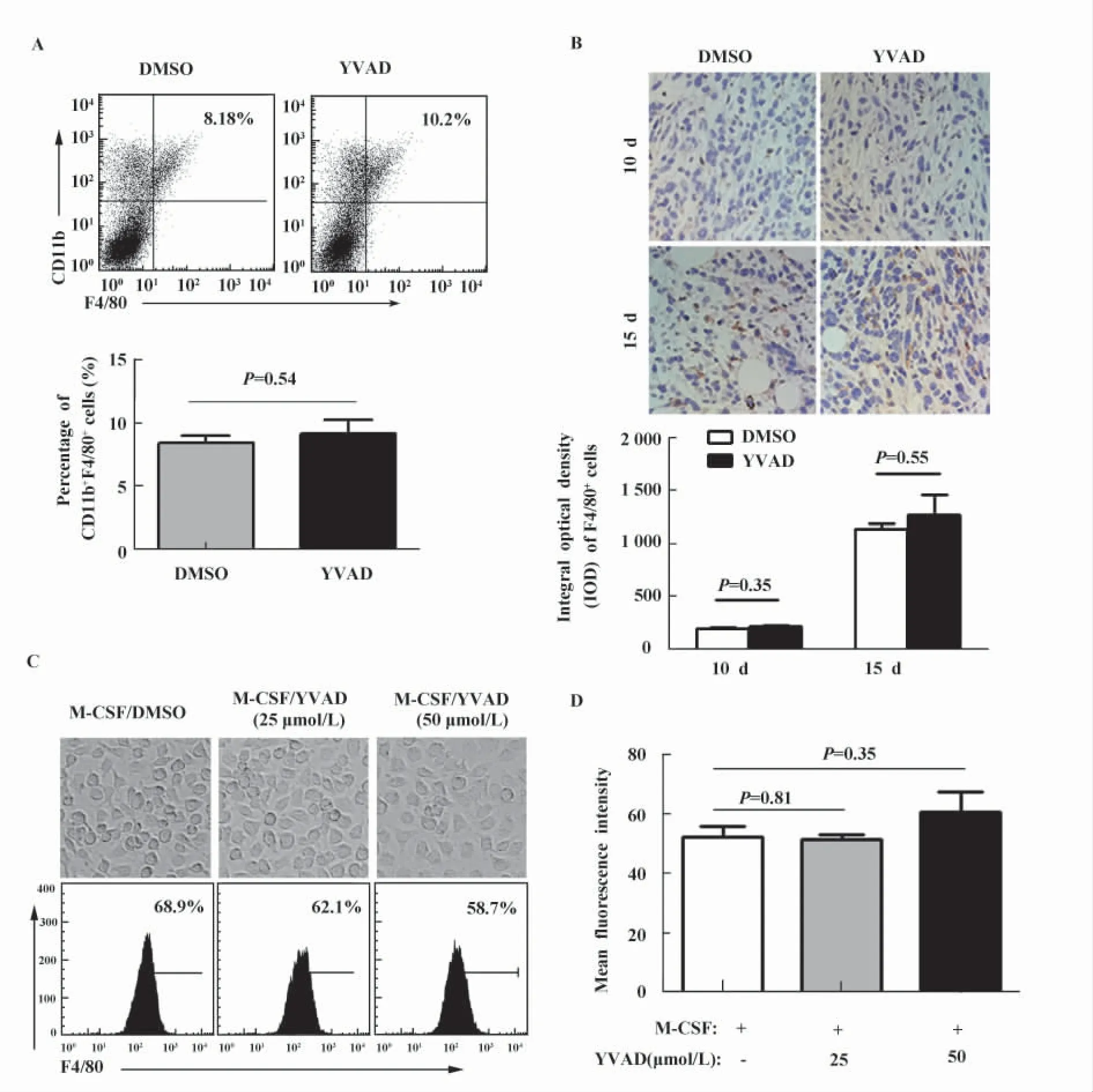
图4 YVAD对肿瘤组织中TAMs的调控Fig.4 Regulation of TAMs recruitment and differentiation by YVAD treatment
MDSCs是由不成熟的髓细胞(Immature myeloid cells,IMCs)发育形成的,多种细胞亚群组成的抑制性细胞。正常情况下,IMCs细胞能够迁移到外周器官,并进一步分化成为巨噬细胞、树突状细胞或粒细胞。但是在肿瘤、炎症或感染等病理情形下,微环境中的细胞因子(如 IL-1β、IFN-γ、GM-CSF 等)可以促进MDSCs的招募和活化,同时阻止其分化为成熟的细胞。肿瘤微环境中的MDSCs可以帮助肿瘤细胞逃脱机体的免疫效应,从而促进肿瘤的发展。因此,通过调控MDSCs细胞的发育过程(促进MDSCs的分化或抑制MDSCs的增殖)可以有效激活机体免疫功能,抑制肿瘤生长[2]。
caspase-1能够通过对一些特异性底物的加工而发挥其生物学功能,其中pro-IL-1β和pro-IL-18是caspase-1最经典的两种底物。研究发现,caspase-1介导的IL-1β的释放能够参与调控多种免疫细胞的发育,如 TH17 细胞和 MDSCs等[14,15]。我们首先证实了caspase-1特异性抑制剂YVAD能够促进乳腺癌的发展,同时还能加剧脾肿大的程度(图1D)。基于该现象,我们展开了关于caspase-1调控肿瘤微环境中免疫细胞发育的功能分析。与文献报道一致[2],在乳腺癌荷瘤小鼠的外周血、脾脏、骨髓以及肿瘤组织中有大量MDSCs细胞的积累,特别是PMN-MDSCs细胞。YVAD给药能够进一步增加外周血、脾脏和肿瘤部位PMN-MDSCs细胞的比例,但是对于骨髓中的PMN-MDSCs细胞影响不大。值得注意的是,在第15天时YVAD给药组和DMSO对照组比较荷瘤小鼠脾肿大程度有显著性差异,而在第20天时这两组间脾肿大程度的差异很小。与此一致,我们发现PMN-MDSCs细胞的比例在第15天时受YVAD给药的影响较大,而在第20天时YVAD给药的调控作用则不明显。这表明caspase-1调控荷瘤小鼠体内免疫细胞发育的效应主要体现在肿瘤发展的早期;而在肿瘤发展的晚期,由于肿瘤细胞坏死导致 caspase-1活性的增强[12],因而 YVAD效应则被部分抑制。
虽然caspase-1在TH17和MDSCs的细胞发育中发挥了关键的调控作用,但是caspase-1对于单核细胞-巨噬细胞的分化却不是必须的。与野生型小鼠相比,caspase-1-/-小鼠体内巨噬细胞的发育情况并没有明显的变化[16]。在肿瘤微环境中,M-MDSCs可以进一步分化TAMs[17]。我们的结果显示YVAD给药虽能一定程度减少M-MDSCs的比例(CD11b+Gr-1+SSClow),但是TAMs比例却没有明显的改变,并且在体外YVAD给药不能抑制单核-巨噬细胞分化的过程。这表明caspase-1不能调控M-MDSCs的分化为TAMs的过程。Youn等[18]的研究发现,无论在体外还是体内M-MDSCs都具有分化为PMN-MDSCs的能力,而这可能是caspase-1调控MDSCs细胞发育的机制所在。
caspase-1对于肿瘤的调控具有两面性[15]。一方面,caspase-1通过诱导肿瘤细胞的凋亡或激活机体的获得性免疫而抑制肿瘤生长;另一方面caspase-1介导IL-1β的释放能通过促进MDSCs的扩增和活化而促进肿瘤发展。本实验基于移植性原位乳腺癌小鼠模型,探讨了caspase-1对于肿瘤微环境中 MDSCs和 TAMs细胞发育的影响,发现caspase-1可以调控PMN-MDSCs的发育,从而间接影响肿瘤的发展。这些结果不仅拓展了我们对于caspase-1相关生理和病理学功能的认识,而且还为以caspase-1为靶点研发肿瘤治疗药物的探索提供了理论依据。
1 Hanahan D,Coussens L M.Accessories to the crime:functions of cells recruited to the tumor microenvironment[J].Cancer Cell,2012;21(3):309-322.
2 Gabrilovich D I,Nagaraj S.Myeloid-derived suppressor cells as regulators of the immune system [J].Nat Rev Immunol,2009;9(3):162-174.
3 Youn J I,Nagaraj S,Collazo M et al.Subsets of myeloid-derived suppressor cells in tumor-bearing mice[J].J Immunol,2008;181(8):5791-5802.
4 Gabrilovich D I,Ostrand-Rosenberg S,Bronte V.Coordinated regulation of myeloid cells by tumours[J].Nat Rev Immunol,2012;12(4):253-268.
5 Qian B Z,Pollard J W.Macrophage diversity enhances tumor progression and metastasis[J].Cell,2010;141(1):39-51.
6 Jarry A,Vallette G,Cassagnau E et al.Interleukin 1 and interleukin 1beta converting enzyme(caspase 1)expression in the human colonic epithelial barrier.Caspase 1 downregulation in colon cancer[J].Gut,1999;45(2):246-251.
7 Winter R N,Kramer A,Borkowski A et al.Loss of caspase-1 and caspase-3 protein expression in human prostate cancer[J].Cancer Res,2001;61(3):1227-1232.
8 Feng Q,Li P,Salamanca C et al.Caspase-1alpha is down-regulated in human ovarian cancer cells and the overexpression of caspase-1alpha induces apoptosis [J].Cancer Res,2005;65(19):8591-8596.
9 Dupaul-Chicoine J,Yeretssian G,Doiron K et al.Control of intestinal homeostasis,colitis,and colitis-associated colorectal cancer by the inflammatory caspases[J].Immunity,2010;32(3):367-378.
10 Zaki M H,Boyd K L,Vogel P et al.The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis[J].Immunity,2010;32(3):379-391.
11 Elinav E,Strowig T,Kau A L et al.NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis[J].Cell,2011;145(5):745-757.
12 Ghiringhelli F,Apetoh L,Tesniere A et al.Activation of the NLRP3 inflammasome in dendritic cells induces IL-1beta-dependent adaptive immunity against tumors[J].Nat Med,2009;15(10):1170-1178.
13 李小颖,马元武,张 旭et al.不同接种量荧光素酶标记小鼠乳腺癌细胞4T1在小鼠体内生长及肺转移的比较[J].中国实验动物学报,2012;20:14-17.
14 Chung Y,Chang S H,Martinez G J et al.Critical regulation of early Th17 cell differentiation by interleukin-1 signaling[J].Immunity,2009;30(4):576-587.
15 Zitvogel L,Kepp O,Galluzzi L et al.Inflammasomes in carcinogenesis and anticancer immune responses[J].Nat Immunol,2012;13(4):343-351.
16 Li P,Allen H,Banerjee S et al.Mice deficient in IL-1 beta-converting enzyme are defective in production of mature IL-1 beta and resistant to endotoxic shock [J].Cell,1995;80(3):401-411.
17 Kusmartsev S,Gabrilovich D I.STAT1 signaling regulates tumor-associated macrophage-mediated T cell deletion [J].J Immunol,2005;174(8):4880-4891.
18 Youn J I,Kumar V,Collazo M et al.Epigenetic silencing of retinoblastoma gene regulates pathologic differentiation of myeloid cells in cancer[J].Nat Immunol,2013;14(3):211-220.

