大孔树脂吸附分离米糠中ACE 抑制肽工艺
张焱,翟爱华
(黑龙江八一农垦大学食品学院,大庆 163319)
高血压发病率在发达国家达到20%以上,我国高血压患者已超过1.2 亿人。在高血压人群中有占95%以上的患者是原发性高血压,通过抑制ACE 活性可有效地降低原发性高血压。随着蛋白质工程和酶工程技术的迅速发展以及对ACE 抑制肽作用机制、生理效果及制备方法研究的深入,食物蛋白源ACE 抑制肽在开发具有降血压功能食品中具有广阔的应用前景。米糠作为精米加工的主要副产物,占稻谷质量的5%~7%,富含近百种营养成分和数十种功能性生物活性因子,具有非常高的保健开发价值,市场前景广阔。米糠约含粗蛋白13%,米糠蛋白因其均衡的氨基酸组成、疏水性氨基酸和芳香族氨基酸的比例高、生物利用高和抗营养因子低是获得生物活性肽的很好资源。
国内外都在对分离方法进行研究。从国内外报道中看到肽类的分离纯化方法主要有大孔吸附树脂[1-4]、凝胶过滤色谱[5-6]、离子交换色谱[7-8]、高效液相色谱[9-11]、疏水相互作用色谱[12-14]、亲和色谱及薄层层析[15]等,凝胶过滤色谱、高效液相色谱和亲和色谱等分离手段虽然精确,但是它们价格相对较高,并不利于工业化生产。目前,对于肽类的工业化分离多采用具有分子筛功能的膜分离系统,因为分离膜抗污染能力差,膜通量衰减严重,分离过程中对操作参数的控制随意性太大。大孔吸附树脂作为一种人工合成的多聚物吸附剂,而且吸附树脂比其他天然吸附剂具有很多的优点:孔径大小任意选择、比表面积任意选择和极性可以任意选择,并且具有吸附快、解吸率高、吸附量大、再生简单等优点,因此这种方法应用于食品中,其前景广阔。
1 材料与方法
1.1 材料、试剂与仪器
米糠蛋白,北大荒希杰食品科技公司。
HY -209,HPD -400,XAD -7HP,XAD761,D -152,007×1 等6 种树脂均购于天津南开大学化工厂。730 型紫外-可见分光光度计,惠普上海光学仪器有限公司;DELTA320 型酸度计,梅特勒-托利多仪器有限公司;HZQ-QX 全温振荡器,哈尔滨东联电子技术开发有限公司;AR2140 电子天平,梅特勒-托利多仪器有限公司;HD-9707 电脑紫外检测仪,上海精科实业有限公司;DBS-100 电脑全自动部分收集器,上海沪西分析仪器厂;HL-2D 定时数显横流泵,上海精科实业有限公司。
1.2 实验方法
1.2.1 米糠蛋白肽粗提液
将米糠蛋白粉(含蛋白65%),加入一定量的水混合,调制成底物质量分数3.6%的米糠蛋白溶液,加入1 mol·mL-1NaOH 溶液调节到溶液pH8.5,加入活性浓度2 000 IU·L-1的碱性蛋白酶,进行水浴(62.0 ℃)振荡水解反应,水解反应过程中持续加入1 mol·L-1NaOH 溶液,保证反应过程中pH 值恒定,记录使用NaOH 体积(mL),消耗的碱量便于水解度的计算(degree ofhydrolysis,DH)。等到水解反应停止调节溶液的pH 为7.0,并且迅速提升到95 ℃(在不断搅拌条件下),此过程持续10 min 对酶进行灭活[13]。将水解液冻干后备用。
1.2.2 蛋白质含量的测定方法
选用12 只试管,在每只试管中加入0.1、0.2、0.4、0.6、0.8、1.0 mL 的酪蛋白标准溶液(10 mg·mL-1),加水补充使溶液达到1.0 mL,接下来在每只试管中加入双缩脲试剂4.0 mL,充分摇匀,室温(20~25 ℃)放置0.5 h,用紫外可见分光光度计(540 nm)比色测定。选用测定结果的平均值,横坐标是酪蛋白的含量,纵坐标以光吸收值,绘制标准曲线,作为计算蛋白质量的依据。使用相同的方法测定其他样品蛋白质含量,样品的浓度低于10 mg·mL-1,如果高于10 mg·mL-1要进行稀释。
1.2.3 选用大孔吸附树脂进行预处理
将新购大孔树脂用95%乙醇浸泡24 h,充分溶胀后用95%的乙醇清洗,至洗出液加等量的蒸馏水无白色浑浊为止,再用蒸馏水洗至蒸馏水澄清且没有乙醇味;浸泡过的树脂先用2~3 倍体积的5%的稀盐酸浸泡3~5 h,再用蒸馏水洗脱至pH 值为中性;最后用2~3 倍体积的5%的氢氧化钠溶液浸泡3~5 h,用蒸馏水洗脱至pH 值为中性,备用[16]。
1.2.4 大孔树脂的筛选
(1)吸附量的测定
选用6 种大孔树脂对吸附率进行测定。用分析天平称取预处理后树脂10 g,进行抽滤到树脂不滴水停止,把树脂加入100 mL 磨口三角瓶内,用移液枪加入浓度为0.5 mg·mL-1米糠蛋白溶液50 mL,在室温25 ℃不变条件下,放在摇床中以120 r·min-1振荡24 h,进行过滤,测定过滤溶液中总肽的含量,计算吸附量的公式如下。
吸附量(mg·g-1)=(C-C0)×(V/m)
注:C0为总肽初始质量浓度(mg·mL-1);Cr 为平衡时总肽质量浓度(mg·mL-1);V 为溶液体积(mL);m 为树脂质量(g)。

注:原液蛋白浓度的单位为mg·mL-1;吸附液蛋白浓度单位为mg·mL-1。
(2)解吸率测定
将在上一个步骤中吸附饱和的大孔树脂加蒸馏水洗到洗脱液无色,使用滤纸吸干大孔树脂表面残留的溶液,用量筒称量体积分数95%乙醇50 mL 加入三角瓶中,接下来浸泡24 h,过滤,测定浸泡后溶液中总肽的含量,计算解吸率。
1.2.5 树脂的静态吸附与解吸实验
将树脂用适量尤水乙醇浸泡24 h,倾倒掉上层乙醇,湿法装柱,继续用无水乙醇以适当流速通过树脂柱,至流出液加水(1∶5)不呈浑浊,再用水以同样流速洗至无醇味。
称取10 mL 湿树脂于具塞磨口三角瓶,加入50 mL 浓度为1 mg·mL-1左右的米糠蛋白水解液,25 ℃振荡4 h(振荡频率200 次·min-1)。过滤、保留滤液,用蒸馏水洗涤树脂,再将树脂浸泡在50 mL 40%的乙醇中,25 ℃振荡吸24 h,测定滤液即吸附上清液和解吸液中蛋白质的浓度。
综合吸附和解吸试验的各组数据,筛选出效果最好的大孔树脂。接下来选用筛选出的效果最好的树脂,进行树脂静态吸附和解吸因素分析试验,目的为了使所选树脂的技术参数进一步优化。
1.2.5.1 树脂静态吸附分析试验
(1)不同温度下的树脂静态吸附试验
准确量取10 mL 湿树脂置与7 组250 mL 三角瓶中,向各组三角瓶内加入浓度为1 mg·mL-1米糠蛋白水解液(pH=8)50 mL,分别于25、30、35、40、45、50、55 ℃条件下摇床振荡4 h,每组试验做三个平行样(n=3),测定吸光度,计算吸附率。
(2)不同pH 下树脂静态吸附试验
准确量取10 mL 湿树脂置5 组于250 mL 三角瓶中,向各组三角瓶内加入pH 分别为2、3、4、5、6、7、8 的浓度为1 mg·mL-1的米糠蛋白水解液50 mL,每组在45 ℃条件下恒温振荡2 h,每组试验做三个平行样(n=3),测定吸光度,计算吸附率。
1.2.5.2 树脂解吸分析试验
(1)洗脱液浓度的选择
准确取吸附肽饱和状态的大孔树脂10 mL,置于5 组250 mL 三角瓶中(n=3)先加入去离子水100 mL振荡10 min,洗去树脂表面的残留液;再向5 组中分别加入浓度为10%、20%、30%、40%、50%、60%、70%、80%、90%、100%的乙醇溶液(pH 8.0)50 mL,使用水浴锅振荡洗脱4 h,测定洗脱液吸光值,根据公式分别计算不同洗脱液洗脱下溶液的吸附率。
(2)洗脱液pH 的选择
设洗脱液浓度为60%乙醇溶液,分别调节洗脱液pH 为3、4、5、6、7、8、9,进行振荡洗脱4 h。收集洗脱液,测定吸光度,计算树脂在洗脱液不同pH 下的解吸率。
(3)洗脱时间的选择
设洗脱液浓度为60%乙醇溶液,分别调节洗脱液时间为10、20、30、40、50、60 min。收集洗脱液,测定吸光度,计算树脂在洗脱液不同pH 下的解吸率。
1.3 动态吸附分析实验
选用规格1.0 cm×100 cm 的层析柱,装入HPD-400 树脂。在温度25 ℃下加玉米糠溶液进行上柱,选用体积分数70%的乙醇溶液为洗脱剂,用电脑紫外检测器于215 nm 波长处检测流出液的吸光度,选用自动检测器对于洗脱峰处的溶液进行收集,然后冷冻干燥。
1.4 ACE 抑制活性的测定
试验选用黎观红建立的体外测定方法[9]并进行了适当调整来测定ACE 抑制活性,此方法简便、灵敏、准确、重复性较好。方法如下:将ACE 底物HHL溶于0.1 mol·L-1的含0.3 mol·L-1NaCl 的硼酸盐缓冲液中(pH8.3)。精确量取5 mol·L-1HHL 溶液50 μL,并且与20 μL ACE 抑制剂进行混合,保持37 ℃温度不变,置于水浴锅中5 min。之后用移液枪加入10 μL 0.1 U·mL-1ACE 溶液,37 ℃反应30 min。反应过程终止前加入100 μL 1 mol·L-1HCl 溶液,之后加入蒸馏水到0.5 mL 为止。在避光条件下加入0.6 mL喹啉,旋涡器上混合10 s 后加入0.2 mL 苯磺酰氯(BSC),立即盖紧离心管管塞在旋涡混合器上混合20 s,反应液在30 ℃恒温水浴锅中避光放置30 min。随后向管中加入3.7 mL 无水乙醇,混匀,继续避光放置30 min 。用紫外分光光度计测定波长492 nm 的吸光值,计算ACE 抑制程度。计算公式如下[17]:

式中:Aa:ACE 及ACE 抑制剂都存在的条件下的吸光度;
Ab:ACE 抑制剂不参与反应的条件下测得的吸
光度;
Ac:ACE 不参与反应的条件下的吸光度。
1.5 蛋白质的检测
酪蛋白的吸光度值与标准液浓度的曲线的回归方程式:Y=0.494 2 X+0.000 8,相关系数R2=0.996 8,可见相关性良好。选用同种方法,在一样的条件下,测定每个样品的吸光度,根据相应标准曲线,查出对应的浓度值,可以计算出每个样品的蛋白质含量。
2 实验结论
2.1 树脂的筛选结果
2.1.1 比较和研究6 种大孔树脂的吸附量及解吸率

图1 酪蛋白标准曲线Fig.1 The standard curve of casein
根据文献资料,选取HY-209、HPD-400、XAD-7HP、XAD761、D-152、007×1 等6 种强碱性阴离子树脂,对它们进行筛选。通过比较它们对水解肽的吸附及解吸性能,得到吸附分离水解肽的性能较强的树脂。筛选树脂的试验主要分为两个步骤:第一,筛选吸附能力较强的树脂而进行的吸附试验;第二,为筛选在相同洗脱剂的情况下解吸效果较好的树脂所要进行解吸试验。
(1)树脂的筛选结果
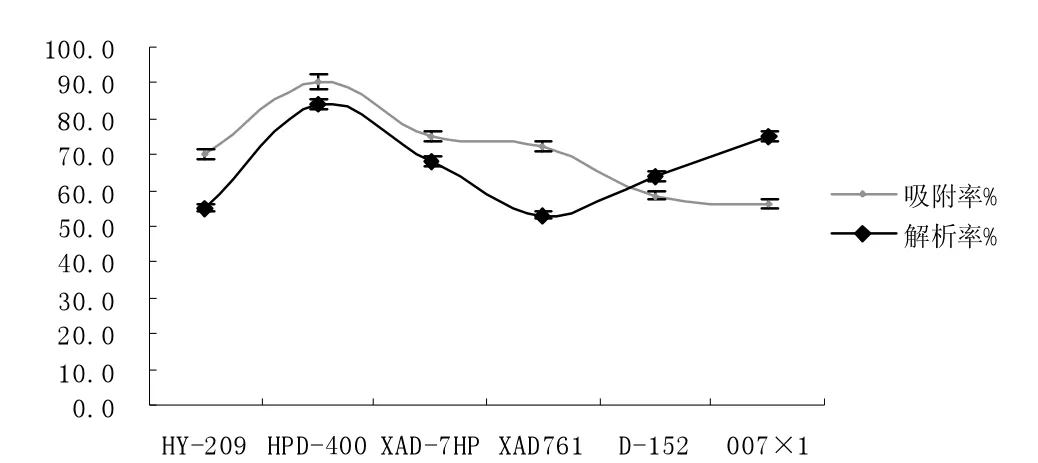
图2 6 种树脂吸附率与解吸率的比较Fig.2 Comparison of adsorption rate and desorption rate of 6 resins
(2)树脂的静态吸附曲线

图3 HPD-400 树脂静态吸附曲线Fig.3 Static adsorption curve of HPD-400 resin
由图3 可以看出,HPD-400 树脂在3 h 中吸附米糠多肽的速度较快,在3 h 过后吸附量跟着时间的持续相对变化不明显,树脂吸附接近饱和状态,HPD-400 树脂对米糠多肽的吸附在4 h 左右到达平衡状态。

图4 HPD-400 树脂静态解吸曲线Fig.4 Static desorption curve of HPD-400 resin
(3)树脂的静态解吸曲线比较树脂的吸附和解吸两种试验的各组数据,从而筛选得出效果最好的树脂是HPD-400。用单因素多水平的试验方法,通过树脂静态吸附肽的因素分析试验以及解吸因素分析试验,对HPD-400 的技术参数进一步优化。
2.1.2 温度影响HPD-400 树脂静态吸附结果

图5 温度影响HPD-400 树脂吸附结果图Fig.5 Effect of temperature on HPD-400 resin adsorption
从图5 中观察到,温度对离子交换树脂的吸附性能影响相对较大。温度在25~45 ℃区间内吸附率逐渐增大,等到45 ℃后吸附率下降显而易见。分析结果表明,温度升高利于分子的扩散速度加快,有利于ACE 抑制肽的吸附,在高温条件下,树脂受到严重影响,所以选择45 ℃,为最佳吸附温度。
2.1.3 pH 影响HPD-400 树脂静态吸附结果图
从图6 中看出,在不同pH 的条件下,米糠蛋白肽提取液影响吸附效果。随着pH 的增加,吸附率随之增长,达到最高点后缓慢下降。在pH 等于4.0 的时侯,吸附效果相对其他pH 较好,吸附率达85.4%。所以选择pH 4.0 为最佳。

图6 pH 影响HPD-400 树脂吸附结果图Fig.6 Effects of pH on HPD-400 resin adsorption
2.1.4 离子交换树脂解吸条件试验
(1)洗脱液浓度的确定

图7 不同解吸剂对HPD-400 树脂解吸性能的比较Fig.7 Comparison of desorption performance of various strippant on HPD-400 resin
由图7 观察到,当乙醇的体积分数低于70%时,随着乙醇浓度的提高,洗脱效果急剧增加;当乙醇的体积分数大于70%时,洗脱效果基本不变,当体积分数95%乙醇的洗脱效果有轻度的降低。在进行树脂吸附的动态洗脱时,只要洗脱后溶液中的乙醇体积分数能达到70%,洗脱效果较佳。
(2)洗脱液pH 的确定

图8 不同解吸pH 对HPD-400 树脂解吸性能的比较Fig.8 Comparison of desorption performance of different pH on HPD-400 resin
由图8 观察到,pH 在6.0 到8.0 之间解吸率不断上升,当pH 超过8.0 增加趋势缓慢,并且当pH 增加,米糠蛋白肽的ACE 抑制活性降低,所以,解吸溶液pH 等于8.0 时为最佳。根据实验结果,确定解吸液为pH 8.0,体积分数为70%乙醇溶液。
(3)洗脱液时间的确定
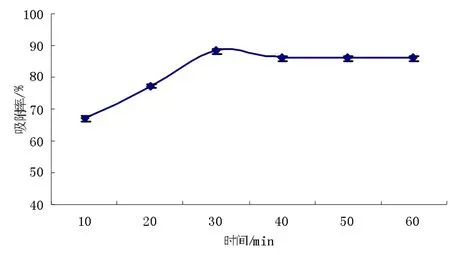
图9 不同解吸时间对HPD-400 树脂解吸性能的比较效果图Fig.9 Comparison of desorption performance of different desorption time on HPD-400 resin
由图观察到,时间在10 min 到30 min 之间解吸率不断上升,当30 min 之后解吸率变化趋势平衡,根据实验结果,确定解吸时间为30 min。
2.2 动态吸附分离纯化条件的确定
2.2.1 米糠蛋白水解液的动态吸附与解吸试验
将30 mL 5%的米糠蛋白水解液通过内径为1.0 cm×100 cm 的不锈钢色谱柱,装柱的XAD-7HP树脂为100 g 用2 倍于柱体积的70%乙醇溶液进行解吸,控制流速为4 mL·min-1,分别以2 min·管-1收集流出液(反复几次收集),用紫外检测器检测其出峰时间,得到米糠蛋白水解液的解吸曲线,并将收集液冷冻干燥并进行活性测定。

图10 动态吸附与解吸试验曲线图Fig.10 Curve graph of dynamic adsorption and desorption tests
由图10 可知,15 min 左右米糠肽就可以被洗脱下来,36 min 左右被吸附的米糠肽基本解吸干净;而且在15 min 左右时,米糠肽在此洗脱流速下解吸曲线上升较快,而在17 min 后,解吸曲线下降缓慢,洗脱速率减慢,这主要是因为相对分子质量较大的组分在70%乙醇溶液中溶解度较低而不容易被解吸下来。
2.2.2 HPD-400 树脂处理后对ACE 抑制肽活性的影响

图11 HPD-400 树脂处理对ACE 抑制率的影响Fig.11 Effect of HPD-400 resin treatment on ACE inhibition rate
收集米糠ACE 抑制肽解吸过程中的溶液,把连续5 管合为一管,接下来冷冻干燥,将混合后的溶液配制为1%的浓度,对其进行活性测定。根据图可得到,1 号样品与其他样品相比ACE 抑制活性低很多,与图9 相结合观察到,在开始的5 min 内并没有米糠肽被洗脱下来,在第2 号样品溶液进行收集,测定有ACE 抑制活性,在2、3、4 号的样品溶液ACE 抑制活性较高。第5、6、7 测定结果表明ACE 抑制活性相对较低。8 号样品相对其他样品差异较显著。通过图11观察到,2 号样品与1 号样品测定ACE 抑制活性结果进行对比,2 号高于1 号。3、4 号样品测定ACE 抑制活性低于2 号样品的活性。分析结果,选用HPD-400 树脂具有吸附效果好,解吸相对其他树脂容易。
3 结论
3.1 HPD-400 树脂,对米糠蛋白肽吸附量更大,解吸更容易,是一种理想的米糠蛋白肽吸附剂,适宜于对米糠蛋白肽的分离纯化。
3.2 用体积分数70%乙醇溶液洗脱HPD-400 树脂吸附的米糠蛋白肽,且洗脱峰单一,对称性好,无明显拖尾现象。
3.3 实验中动态吸附试验,结果表明型号为HPD-400-7HP 树脂吸附能力效果最佳,这种树脂可对米糠ACE 抑制肽进行分离纯化,并且此种树脂解吸相对其他树脂比较容易。通过考察树脂对米糠ACE 抑制肽活性影响,收集高活性时间段的米糠ACE 抑制肽,想对于原液ACE 抑制活性,活性提高一倍左右。
[1] 邱雁临,胡静,缪谨枫,等.大孔树脂分离啤酒酵母中谷胱甘肽的研究[J].现代食品科技,2008,24(2):131-133.
[2] 许世芳,毛丽珍.大孔吸附树脂及其在中药化学成分纯化中的应用[J].浙江省医药科学学报,2001,38(6):45-47.
[3] 何炳林,英文强.离子交换与吸附树脂[M].上海:上海科技教育出版社,1995.
[4] 赵利,钱芳,许建军,等.大孔吸附树脂及其在蛋白质、多肽和氨基酸分离纯化中的应用[J]. 四川食品与发酵,2003,39(2):39-41.
[5] Lee S H,Song K B.Isolation of an angiotensin converting enzyme inhibitory peptide from irradiated bovine blood plasma protein hydrolysates[J].Journal of Food Science,2003,68(8):2469-2472.
[6] Kim M R, Kawamura Y, Lee C H.Isolation and identification of bitter peptides of tryptic hydrolysate of soybean 11 S glycinin by reverse-phase high-performance liquid chromatography [J]. Journal of Food Science,2003,68(8):2416-2422.
[7] Zae-IK S,Rina Y,Soo-AH P,et al.His-His-Leu,an angiotensinⅠconverting enzyme inhibitory peptide derived from korea soybean paste,exerts antihypertensive activity in vivo[J]. Journal of Agriculture and Food Chemistry,2001,49(6):3004-3009.
[8] Wu Jiangping,Ding Xiaolin.Characterization of inhibition and stabil -ity of soy -protein -derived angiotensin I -converting enzyme inhibitory peptides[J].Food Research International,2002,35(4):367-375.
[9] Blanca H L,Isidra R,Mercedes R,et al.Preparation of ovineand caprine β-lactoglobulin hydrolysates with ACEinhibitory activity,Identification factive peptides from caprinen β-lactoglobulin hydroly-sed with tbermolysin[J].International Dairy Journal,2002(12):805-812.
[10] Masafumi M,Naoyuki Y,Toshiaki T. Identification of ananitihy pertensive peptide from casein hvdrolvsate produced by a protein-ase from Lactobacillus helveticus CP790[J].Journal of Dairy Science,1996,79(8):1316-1321.
[11] Dany D,Don E O,Sylvie F G,et al. Enzyme-induced gelation of extensively hydrolyzed whey proteins by alcalase:peptide identification and deternination of enzyme specificity [J].Journal of Agriculture and Food Chemistry,2003,51(21):6300-6308.
[12] Takuo N,Lech O.Purification of glycomacropeptide from non-dialyzable fraction of sweet whey by hydrophobic interaction chromatog -raphyonphenyl -agarose [J].Biotechnology Letters,2000,22(5):413-416.
[13] Kong Baohua,Xiong Youli. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J]. Journal of Agricultural and Food Chemistry,2006,54(16):6059-6068.
[14] 周丽明.芒果多酚的提取、分离纯化及抗氧化、抑菌作用研究[D].武汉:华中农业大学,2007.
[15] 黎观红. 食物蛋白源血管紧张素转化酶抑制肽的研究[D]. 无锡:江南大学,2005.
[16] 关晴.利用阳离子交换树脂对黄豆酱多肽脱盐作用的研究[D]. 大庆:黑龙江八一农垦大学,2012.
[17] 李喆,翟爱华. 米糠蛋白抗氧化肽的制备及初步分离[J].黑龙江八一农垦大学学报,2012,24(6):56-59.

