羊布氏菌病iELISA抗体检测方法的建立及应用
王秀丽,毛开荣,程君生,张立春,丁家波,蒋玉文
(中国兽医药品监察所,北京 100081)
布鲁氏菌病(Brucellosis)是由布鲁氏菌引起的一种危害严重的人畜共患传染性变态反应疾病[1],在世界上160多个国家和地区流行,给世界养殖业造成重大的经济损失[2],并给世界公共卫生造成很大的威胁。其中牛种布鲁氏菌病给养殖业造成的经济损失最大,而威胁人类健康最严重的是羊种布鲁氏菌,它可以穿透完整的皮肤对人造成感染,因此防控羊布鲁氏菌病不仅有重要的经济意义,还具有重大的公共卫生意义。目前为止没有一种诊断羊布氏菌病的标准方法。本研究旨在建立检测羊布氏菌病的iELISA方法,为我国羊布鲁氏菌病的检测提供新方法。
1 材料与方法
1.1 主要菌种和试剂
1.1.1 菌种 羊种布鲁氏菌16M(CVCC 70002)由中国兽医药品监察所菌种保藏室保存。
1.1.2 试剂 明胶、辣根过氧化物酶标记兔抗羊IgG抗体,Sigma公司;脱脂奶粉,B.D.公司;TMB,NUPU公司;试管凝集抗原、虎红平板凝集试验抗原,中国兽医药品监察所。
1.1.3 血清 阳性参照血清、阴性参照血清由本实验室制备;血清样本1,共385份,由山东农业大学和哈尔滨兽医研究所提供,用于临界值的确定和符合率试验;血清样本2,共1932份,由内蒙古动物疫病预防控制中心提供,用于临床试验;绵羊小肠结肠炎耶尔森菌O9、大肠杆菌O157、都柏林沙门氏菌阳性血清由本实验室制备,用于iELISA特异性检验;鸡血清、兔血清由本实验室制备,用于封闭液的筛选。
1.2 方法
1.2.1 抗原的制备 将纯粹检验合格的羊种布鲁氏菌16M株菌种划线接种于胰示琼脂扁瓶,37℃培养48 h后,用适量0.5%石炭酸生理盐水洗下菌体,80℃灭活2 h;9000 g离心10 min,收集菌体。参照OIE手册[3]用热酚水法提取脂多糖(LPS)抗原。
提取的LPS经琼脂糖凝胶电泳和SAS-PAGE检测核酸和蛋白的残留量,若存在核酸,加入终浓度为15 μg/mL的核酸酶,37℃水浴3 h,若存在蛋白则加入终浓度为15 μg/mL的蛋白酶K,55℃水浴3 h,37℃水浴24 h,收集处理产物,用蒸馏水透析,4000 mL/次,透析3次。
纯化的LPS经琼脂糖凝胶电泳和SDS-PAGE鉴定LPS的纯度。并用银氨染色法鉴定LPS。将LPS抗原摇匀,用微量移液器准确分装,2 mL/瓶,冻干,称重,测定每瓶LPS抗原的质量,-20℃保存备用。
1.2.2 iELISA方法的建立
1.2.2.1 抗原包被浓度和待检血清最佳稀释倍数的确定 抗原用0.01 mol/L pH 9.6的碳酸盐缓冲液(CBS)系列稀释后100 μL/孔包被酶标板,4℃过夜,用 200 μL/孔 PBST 洗板 4 次,5 min/次;洗板后加入200 μL/孔5%的脱脂奶粉,37℃封闭1 h,用200 μL/孔 PBST洗板4次,5 min/次,然后加入经系列稀释的阴阳性对照血清方阵滴定,37℃孵育1 h,用200 μL/孔PBST洗板4次,5 min/次;按照酶标二抗说明书加入1∶40000倍稀释的HRP标记兔抗羊IgG 抗 体 100 μL/孔,37 ℃ 孵 育 1 h,用200 μL/孔 PBST 洗板4 次,5 min/次;加入100 μL/孔TMB显色液室温下(25℃)避光显色10 min;按50 μL/孔加入1 mol/L的 H2SO4终止反应,测 OD450nm值。
按照上述程序,将抗原和待检血清分别进行系列稀释(待检血清起始稀释倍数为50,以后2倍系列稀释至1∶400,抗原起始稀释倍数为1∶100,2倍系列稀释至1∶6400),后进行方阵滴定,确定合适的抗原浓度和待检血清最佳稀释倍数,根据抗原的质量计算出抗原的包被浓度。
1.2.2.2 反应条件的优化 确定最佳抗原包被浓度和待检血清最佳稀释倍数后,按照控制单一变量法比较0.2%的脱脂乳、2%脱脂乳、10%脱脂乳、0.4%明胶、5%鸡血清、5%兔血清的封闭效果,比较封闭37 ℃孵育 90、60、30、20、10 min,4 ℃12 h 的差异;比较待检血清在 37 ℃ 孵育 90、60、30、20、10 min和4℃过夜不同孵育时间的差异;比较HRP标记兔抗羊 IgG抗体稀释1∶10000、1∶20000、1∶40000、1∶80000、1∶160000 倍,在 37℃孵育 90、60、30、20、10 min 的差异;比较显色液室温(25 ℃)作用 3、5、8、10、15 min的显色情况,最终筛选出最佳的反应条件,确定该系统的最终反应程序。
1.2.2.3 临界值的确定 将血清样本1进行SAT和RBPT检测,将SAT和RBPT均为阳性的血清作为阳性血清样本,SAT和RBPT均为阴性的血清作为阴性血清样本。将所有的样本用所建立的iELISA进行检测,根据结果计算阳性样本和阴性样本的平均值,求S/P值[S/P=(样本值-阴性均值)/(阳性均值 -阴性均值)]。检测结果用MedCalc软件进行ROC曲线分析,取敏感性与特异性之和最高的S/P值为阳性和阴性结果的临界值。
1.2.2.4 对照血清的制备 阴性对照血清的制备将RBPT、SAT、补体结合试验(CFT)检测结果均为布鲁氏菌抗体阴性的绵羊血清作为阴性对照血清,通过对大量羊布鲁氏菌病阴性血清样本iELISA检测结果的统计,阴性对照血清iELISA检测结果OD450nm控制在统计结果的阴性平均值以下。
阳性对照血清的制备通过RBPT筛选布鲁氏菌病抗体阴性的健康绵羊,用羊种布鲁氏菌16M株培养物比浊至10亿CFU/mL作为活菌免疫用抗原,羊布鲁氏菌16M株培养物80~90℃灭活,比浊至10亿CFU/mL作为死菌免疫抗原,按以下程序免疫绵羊:活菌免疫原2 mL腿部皮下注射免疫,21 d,重复相同的抗原和免疫途径注射4 mL抗原,28 d后采用同样注射途径注射4 mL死菌免疫抗原加强免疫,14 d后采血,通过SAT检测抗体效价。
人工感染制备的强阳性血清用阴性对照血清做2倍系列稀释,进行 iELISA检测,强阳性对照OD450nm值控制在大量阳性血清样本iELISA检测结果的平均值以上,弱阳性对照血清控制在结果判定的临界值以上,并且在强阳性对照血清OD450nm值以下。
1.2.3 敏感性、特异性、重复性、稳定性、符合率试验
1.2.3.1 敏感性试验 对5份临床阳性血清(来源于血清样本1)和强阳性对照血清、弱阳性对照血清分别用血清稀释液做2倍系列稀释,用所建立的iELISA方法进行检测,同时对稀释的血清用虎红平板凝集试验(RBPT)和平板凝集试验(SAT)检测,记录判定结果,比较三种方法的敏感性。
1.2.3.2 特异性试验 对绵羊布鲁氏菌病的阳性血清、阴性血清、都柏林沙门氏菌阳性血清、大肠杆菌O157阳性血清和小肠结肠炎耶尔森菌O9阳性血清用建立的iELISA方法进行检测,验证所建立方法的特异性。
1.2.3.3 重复性试验随机选择20110524、20110608、20110611三批包被的酶标板各一块,每块板均对上述16份血清进行检测,计算三批包被酶标板检测同一份血清OD450nm的变异系数,分析批间重复性效果。选择20110611批包被的5块酶标板,每块板均对16份血清(来源于血清样本1)进行检测,计算同一批包被的不同酶标板检测同一份血清OD450nm的变异系数,分析批内重复性效果。
1.2.3.4 稳定性试验 将包被好的酶标板于4℃保存,分别在保存期为2、3、4、7、11 个月时对 16 份血清进行检测,判定包被好的酶标板的稳定性。
1.2.3.5 符合率试验 用建立的iELISA及RBPT、SAT对血清样本1进行检测,计算该iELISA与RBPT、SAT检测结果的符合率。
1.2.4 临床样品的检测 对血清样本2进行iELISA和RBPT检测,统计iELISA与RBPT检测结果的符合率。
2 结果
2.1 抗原的制备 参照OIE手册提取的LPS进行琼脂糖凝胶电泳,检测不到核酸条带,表明提取物中不含核酸,进行SDS-PAGE证明提取物中有蛋白存在,对此提纯抗原加入终浓度为15 μg/mL的蛋白酶K消化,将消化产物透析后,进行SDS-PAGE,结果表明,经蛋白酶消化处理后的LPS已经不含蛋白(图1)。对纯化的LPS进行银氨染色,结果表明蛋白酶K消化和透析等处理对LPS没有影响(图2)。最后冻干。冻干后随机抽取5瓶称重,LPS的质量为1032 ±3 μg/瓶。

图1 LPS经蛋白酶K消化前后的SDS-PAGE图
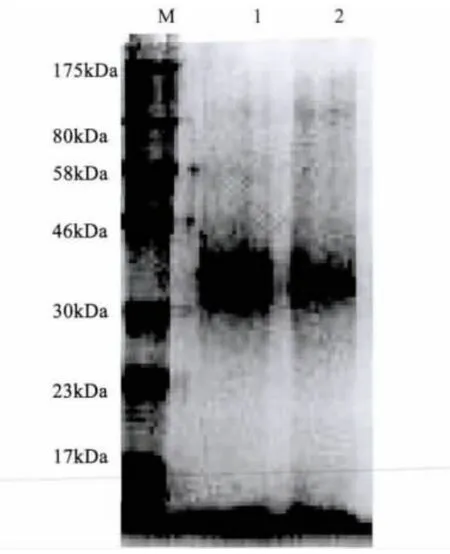
图2 LPS透析前后的银染图
2.2 iELISA方法的建立
2.2.1 抗原最佳包被浓度和待检血清最佳稀释度的确定 抗原和待检血清方阵滴定结果表明,抗原包被浓度越高,血清稀释倍数越低,非特异性反应越强,反之则越弱,而阴性血清稀释倍数太大将失去意义。最终确定抗原的稀释倍数为1∶3200,据此计算出LPS抗原的包被浓度为0.16 μg/mL,血清的稀释倍数为1∶100。
2.2.2 最佳工作条件的确定 按控制单一变量法对封闭液、封闭时间,待检血清孵育时间,酶标记兔抗羊IgG抗体最佳稀释度、孵育时间,显色时间进行优化。结果表明0.4%的明胶37℃封闭30 min的封闭效果最佳;待检血清孵育条件为37℃孵育10 min;酶标记兔抗羊IgG抗体最佳工作浓度为1∶40000;最佳孵育条件为37℃,30 min;最佳显色条件为25℃,10 min。
2.2.3 临界值的确定 对血清样本1中SAT和RBPT检测结果一致(SAT和RBPT同为阳性或SAT和RBPT同为阴性)的血清样本通过iELISA检测,阳性血清样本平均OD450mm为0.83,阴性血清样本平均OD450mm为0.15,经ROC曲线分析,当 S/P=0.2时,敏感性为98.41%,特异性为96.65%,见表1,ROC曲线的下面积为(AUC)为0.997,说明该诊断方法效果良好(图3)。
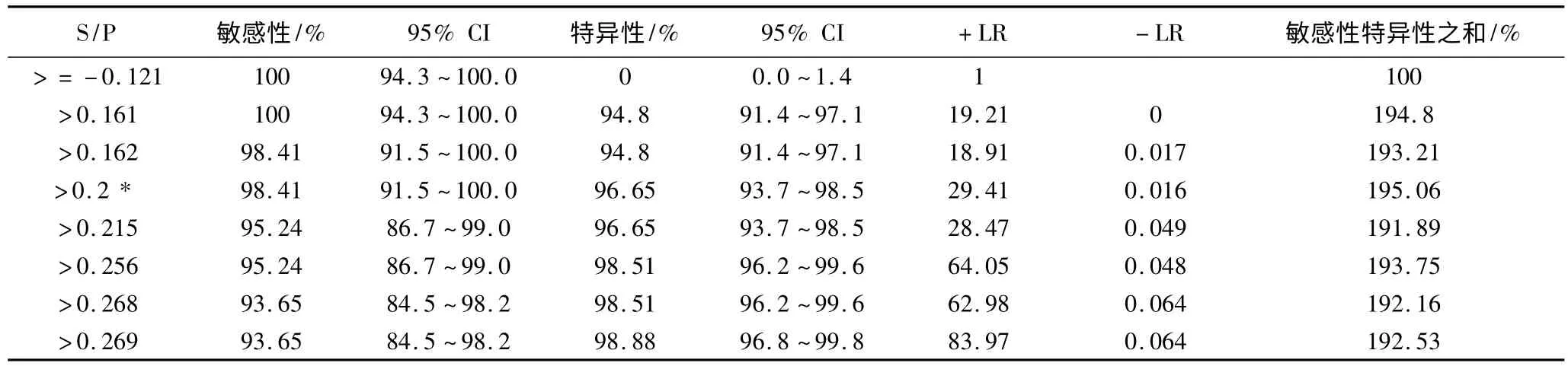
表1 iELISA检测羊血清不同的临界值对应的统计数据
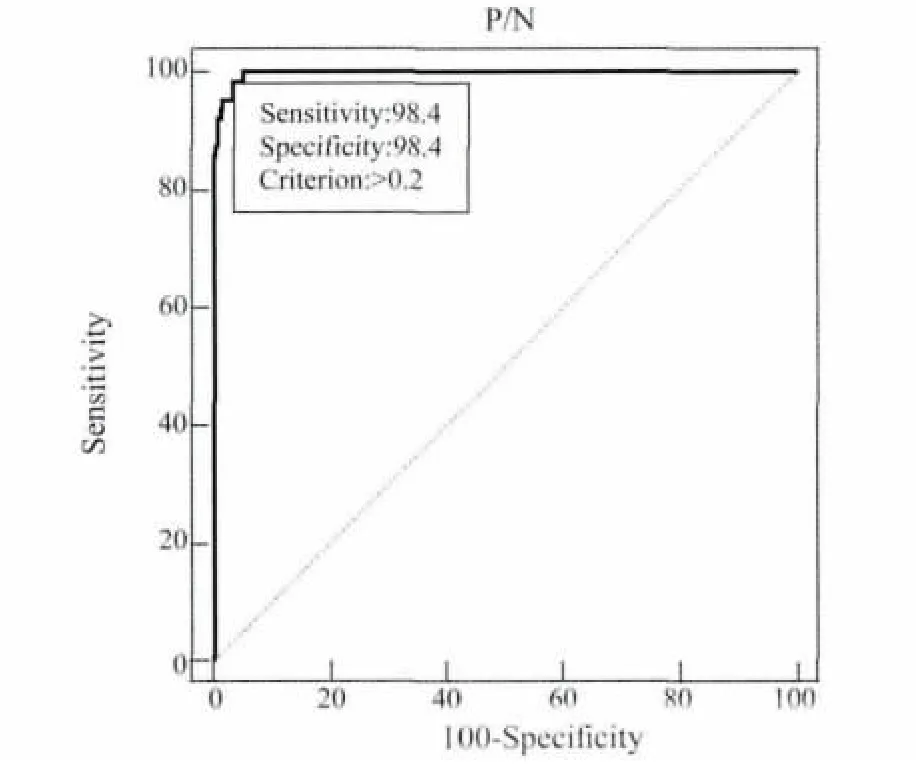
图3 ROC曲线
2.2.4 对照血清的制备及标准的确定 依据来自不同地区385份血清样本的统计结果,阴性对照血清控制在阴性样本统计结果的平均值以下(OD450nm≤0.15),强阳性对照OD450nm的值控制在阳性样本统计结果的平均值以上(OD450nm≥0.83),弱阳性血清控制在临界值以上(0.35≤OD450nm≤0.70),并以此作为iELISA试验成立的条件。
将人工感染制备的布鲁氏菌强阳性血清2倍系列稀释,通过此iELISA检测结果显示,阴性对照血清OD450nm值为0.15,可选择此次检测的阴性血清;强阳性血清(S2)用阴性血清稀释2倍后OD450nm值为0.931,作强阳性对照血清;强阳性血清(S2)用阴性血清稀释16倍后OD450nm值为0.381,作弱阳性对照血清。
2.3 敏感性、特异性、重复性、稳定性、符合率试验结果
2.3.1 敏感性试验 将5份阳性血清和强阳性对照血清、弱阳性对照血清、分别用血清稀释液做2倍系列稀释(2-1~2-12),用所建立的iELISA方法进行检测。结果显示,当血清稀释到256倍时全部为阳性,有的稀释到1024倍时仍能检测出来,强阳性参照血清稀释2048倍时仍可判定为阳性,弱阳性血清稀释128倍时判为阳性。iELISA比RBPT、SAT敏感性高,结果见表2。
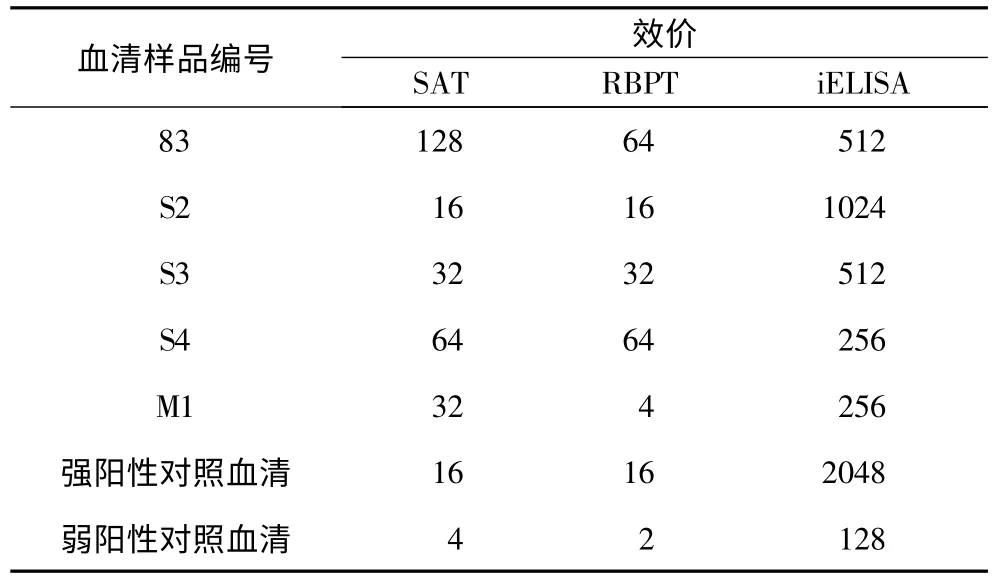
表2 SAT、RBPT、iELISA敏感性比较
2.3.2 特异性试验 对绵羊布鲁氏菌病的阳性血清、阴性血清、都柏林沙门氏菌阳性血清、大肠杆菌O157阳性血清和小肠结肠炎耶尔森菌O9阳性血清用建立的iELISA方法进行检测,结果显示布鲁氏菌阳性血清和小肠结肠炎耶尔森菌O9阳性血清检测结果为阳性,而布鲁氏菌阴性血清、大肠杆菌O157阳性血清、都柏林沙门氏菌阳性血清iELISA检测结果均为阴性(表3)。
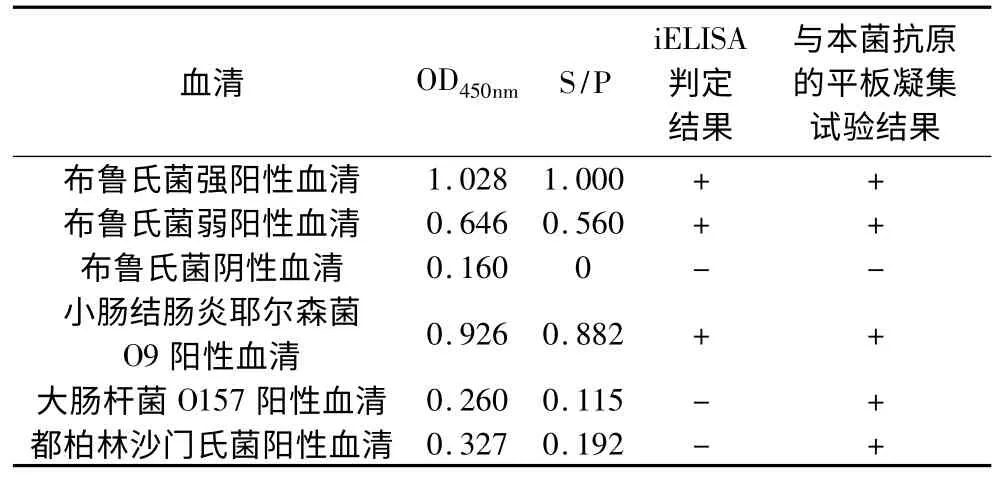
表3 特异性试验结果比较
2.3.3 重复性试验 用20110524批、20110608批、20110611批包被的3批酶标板对上述16份血清检测结果显示,批间变异系数在1.1% ~9.8%之间,说明批间重复性良好;用20110611批包被的5块酶标板对16份血清检测结果显示,批内变异系数在2.9%~9.8%之间,说明批内重复性良好。批间重复性试验和批内重复性试验结果符合临床检测要求。
2.3.4 稳定性试验 将包被好的酶标板于2~8℃保存,分别在保存期为 2、3、4、7、11 个月时对16 份血清检测结果显示,在11个月内包被酶标板检测结果稳定。
2.3.5 符合率试验 对来自泰安、济南、哈尔滨的385份血清分别用虎红平板凝集试验、试管凝集试验和iELISA进行检测。结果显示,iELISA与SAT的阳性符合率为88.57%,阴性符合率为98.21%;iELISA与RBPT的阳性符合率为97.44%,阴性符合率为91.86%;若以SAT和RBPT结果一致为判定标准,则阳性符合率为95.24%,阴性符合率为96.28%;若以SAT或RBPT检测结果阳性判为阳性血清,SAT或RBPT检测结果阴性判定为阴性血清,则阳性符合率为93.63%,阴性符合率为96.62%(表4)。
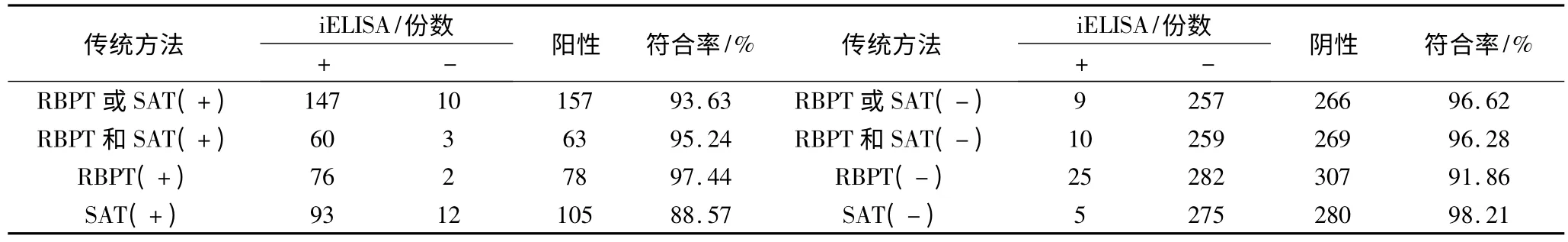
表4 SAT和RBPT与iELISA的符合率情况
2.4 临床样品的检测 用本研究所建立的iELISA方法对血清样本2进行了检测,并与RBPT的检测结果进行了比较。其中RBPT阳性血清161份,iELISA检出157份,与RBPT的阳性符合率为97.5%,RBPT阴性血清1771份,iELISA检出1614份,阴性符合率为91.1%,总符合率为91.7%。
3 讨论与小结
研究以纯化的布鲁氏菌LPS为包被抗原,建立了检测羊布鲁氏菌病的iELISA方法。试验结果表明,此方法抗原用量低,包被浓度仅为0.16 μg/mL,降低了检测成本;对大量临床样品的检测以及与RBPT、SAT检测结果比较,iELISA具有较高的敏感性;特异性试验证明该方法可以有效排除布鲁氏菌与大肠杆菌O157和都柏林沙门氏菌的交叉感染,特异性良好;符合率试验证明iELISA与SAT和RBPT的符合率大于90%;批内重复性试验和批间重复性试验变异系数均小于10%,表明该检测方法具有良好的可重复性;保存期试验证明在1年之内,包被酶标板的检测结果稳定;经过不同条件的优化,该检测的整个过程只需要1 h,一次可检测大量的临床样品,比以往的iELISA检测方法更加省时。
iELISA的符合率试验显示,RBPT、SAT、iELISA检测结果有时不完全一致,这与布鲁氏菌感染后不同时期产生抗体类型的差异有关,布鲁氏菌感染初期诱导产生的抗体主要是IgA和IgM,凝集反应很强,而本研究所建立的iELISA检测抗体为IgG。布鲁氏菌的分离鉴定虽然是布鲁氏菌病诊断的金标准,但是布鲁氏菌的分离效率比较低,感染的大部分时期分离不到菌体,所以确诊布鲁氏菌病的方法有待进一步研究。
由于该检测方法选择的抗原是光滑型布鲁氏菌的LPS,粗糙型抗体与之不发生反应,且特异性试验结果显示iELISA不能有效区分小肠结肠炎耶尔森菌O9与布鲁氏菌的LPS-IgG抗体,为解决以上问题,选择一种能引起较强体液免疫反应的布鲁氏菌共同蛋白作为抗原建立方法是将来研究的重要方向。据文献报道,OMP28蛋白的抗原性良好[4-6],但与其他的检测方法一样,该方法不能区分野毒感染和布鲁氏菌疫苗免疫产生的抗体,解决该问题寄希望于基因缺失疫苗株的构建以及相应的亚单位疫苗的研究。
目前用于布鲁氏菌病的诊断方法主要有(RBPT,SAT等传统血清学诊断方法。随着分子生物学的发展,PCR 技术[7-9]、核酸探针技术[10]等应用于布鲁氏菌抗原的诊断。ELISA[11-12]、荧光偏振技术[13]、免疫酶组化技术[14]、胶体金标记[15-16]等免疫学技术应用于布鲁氏菌病抗体检测的研究日益增多。但这些检测方法或者接触活菌,存在生物安全隐患;或者灵敏度低,存在漏检的风险,不利于布鲁氏菌病的净化;或者需要特定的仪器设备和专业的技术人员,难以在基层推广应用。本研究建立的iELISA方法操作方便,灵敏度和特异性均较高,省时省力,对检验人员专业素质的要求不高,方便在临床推广应用,具有良好的应用前景。
[1]Pappas G,Papadimitriou P,Christou L,et al.Future trends in human brucellosis treatment[J].Expert Opin Invest Drugs.2006,15(10):1141-1149.
[2]Chain P,Comerci D J,Tolmasky M E,et al.Whole-genome analysis of speciation events in pathogenic brucella[J].Infect Immun,2005,73(12):8353-8361.
[3]Office International Des Epizooties,OIE terrestrial manual[M].World Organization for Animal Health,2009:15-16.
[4]Michel S Z,Sylvie B,Niees V,et al.Single step purification and evaluation of recombinant BP26 protein for serological diagnosisof Brucella ovis infection in rams[J].Vet Microbio,2002,87:213-220.
[5]Pallab C,Rajeev P,Vinth K,et al.Recombinant OMP28 antigenbased indirect ELISA for serodiagnosis of bovine brucellosis[J].Molecular and Cellular Prubes ,2010,24:142-145.
[6]Gupta V K,Ranjeeta K,Jyoti V,et al.Comparative evaluation of recombinant BP26 protein for serological diagnosis of Brucella melitensis infection in goats[J].Small Ruminant Resarch,2010,93:119-125.
[7]Ouahrani-Bettache S,Soubrier M P,Liautard J.P.IS6501-anchored PCR for the detection and identification of Brucella species and strains[J].J of Applied Bacteriology,1996,81:154-160.
[8]Bricker B J,Evalt D R,Olsen S G,et al.Evaluation of the B.abortus species-specific polymerase chain reaction assay,an improved version of the Brucella AMOS-polymerase-chain-reaction assay for cattle[J].Vet Diagn Invest,2003,15(4):374-378.
[9]Mater GM,KhneisserI A,Abdehoor A M.Rapid laboratory conformation of human Brucella by PCR analysis of a target sequence on the 31kibdalton Brucella Antigen DNA[J].Clinical Microbiol,1996,34(2):477-478.
[10]Farnander-Lago L,Vallejo F J,Trujilano L,et al.Fluorecent Whole-cell hydridization with 16S rRNA-Targeted oligonucleitide probes to identifie Brucella spp.by flow Cytomaty[J].J of Clinical Microbio,2002,38(7):2768-2771.
[11]Funk N D,Tabatabai L B,Elzer P H,et al.Indirect enzymelinked immunosorbent assay for detection of Brucella melitensisspecific Antibodies in Goat Milk[J].J of Clinical Microbio,2005,Feb,721-725.
[12]Nielsen K,Smith P,Yu W L,et al.Validation of a second generation comparative enzyme immunoassay(CELISA)for the diagnosis of brucellosis in various species of domestic animals[J].Vet Immunol Immunopathol,2008,125(3/4):246-250.
[13]Nielsen K,Gall D,Jolley M,et al.A Homogeneous flourescence polarization assay for detection of antibody to Brucella abortus.[J].Immunol Methods,1996,95(1/2):161-168.
[14]Kim J W,LeeY J,Han M Y,et al.Evaluation of immunochromatographic assay for serodiagnosis of Brucella canis[J].J of Vet Med Sci,2007,69(11):1103-1107.
[15]朱明东,洪林娣.快速免疫诊断布鲁氏菌病新方法的研究[J].浙江省医学科学院学报,2006,67(8):14-17.
[16]朱明东,洪林娣.胶体金免疫层析法快速诊断牛布鲁氏菌病的研究[J].中国人兽共患病学报,2008,24(8):755-759.

