TRPV1在FCDⅠ型和Ⅱa型难治性癫痫中的表达☆
伍苛夫 树海峰 尹清 王法祥 臧振乐 赵邦云 张春青 刘仕勇 安宁 杨辉
皮质发育障碍(malformations of cortical development,MCDs)是儿童难治性癫痫的主要病因之一。局灶性皮质发育不良(focal cortical dysplasia,FCD)是其主要类型之一,大致分为FCDI型、FCDIIa型、FCDIIb型和FCDIII型。目前,对FCDIIb型和FCDIII型的研究较多[1-3]。关于FCDI型和FCDIIa型癫痫发生机制的研究日趋成为人们关注的重点。近年来,非选择性离子通道在癫痫发病机制中的作用正逐步引起广泛重视。瞬时感受器电位(transient receptor potential,TRP)通道是位于细胞膜或胞内细胞器膜上的一类非选择性阳离子通道蛋白超家族,其中瞬时感受器电位辣椒素受体1型(TRPV1)是研究较多的TRP家族成员之一[4-7]。研究证据提示,TRPV1可能与癫痫发生机制之间关系密切。因此,本研究探讨TRPV1与FCDI和FCDIIa的关系,可为研究FCD所致难治性癫痫的癫痫发生机制奠定一定的基础。
1 材料与方法
1.1 研究对象 选取2011年12月至2012年5月本科室手术治疗的FCD难治性癫痫患者。入选标准:①符合FCD的诊断标准,有癫痫发作的典型表现和脑电图特征,正规服用过3种或3种以上一线抗癫痫药(苯妥英钠、卡马西平、丙戊酸钠、苯巴比妥),除丙戊酸钠外,血药浓度在正常高线,与发作前基线比较,发作频率没有明显减少;②术前行头颅CT或MRI检查;③患者的发作类型符合国际抗癫痫联盟1981年有关癫痫发作类型分类的规定;④手术前1周放置硬膜下电极,术中用皮质电极进行监测,发现有明确和固定的癫痫放电部位,有手术适应证,且能进行手术者;⑤所有标本的采集在医院伦理委员会的指导下进行,患者及其家属术前签署知情同意书。FCD的分型参照2011年国际抗癫痫联盟公布的最新分型标准。本组20例,男10例,女10例,年龄1.5~10.2岁,平均(5.6±2.3)岁,病程10~210个月。我们用8位尸检患者的新鲜正常皮层作为对照。对照患者生前无神经系统疾病,由新桥医院病理科医师通过病理切片证实脑皮层结构无异常,家属同意,并签署知情同意书。其中男4例,女4例,年龄3~15岁,平均(8.1±3.4)岁。将收集的组织标本中出血、电灼的组织除去,等渗盐水冲洗干净后一部分用4%多聚甲醛内固定,石蜡包埋。另一部分新鲜组织液氮速冻后存入-80℃冰箱,用于后续实验。根据临床诊断和病理诊断的结果,将收集的标本分为FCDI型、FCDIIa型以及正常皮层对照组(CTX)。本实验均在第三军医大学伦理委员会的监督和规范下进行。
1.2 RT-PCR检测TRPV1 mRNA水平 用Trizol一步法(试剂盒购自武汉博士德公司)提取100mg组织总RNA,并进行RNA样品的的纯度和浓度鉴定,选取D260/D280比值为1.9~2.1的样品进行下一步实验。取1μg RNA逆转录cDNA,以cDNA产物为模板进行RT-PCR(逆转录、PCR试剂盒购自江苏碧云天生物公司)。TRPV1上游引物序列5-CCT GAT GGC AAG GAC GAC TA-3,下游引物序列5-AGG GCA AAG TTC TTC CAG TGT C-3,产物长度182bp;β-actin上游引物序列5-GCA CCA CAC CTT CTA CAA TGA GC-3,下游引物序列5-TAG CAC AGC CTG GAT AGC AAC G-3,产物长度163bp(TRPV1引物由英潍捷基上海贸易有限公司设计并合成)。PCR(20μL体系)反应条件:预变性 95℃ 5 min、95℃ 30s、60℃ 30s、72℃ 30s(30个循环)、终末延伸 72℃10 min。扩增产物用2.0%琼脂糖凝胶电泳,加样量为8µL,电压160V,时间25 min,电泳完毕后在溴化乙锭(EB)中染色,在紫外灯下观察结果并照相。图像采用Quantity One软件测定各条带(TRPV1与内参β-actin)的灰度值,比较二者的比值。
1.3 Western Blot检测TRPV1蛋白水平 取组织约100 mg碾碎,加入全蛋白提取液匀浆15 min,4℃、12000 r/min离心30min,提取总蛋白,取蛋白样品40 μg经8%SDS2 PAGE凝胶电泳分离(蛋白抽提试剂盒、SDS-PAGE凝胶制备试剂盒购自武汉谷歌生物公司),电转移蛋白至PVDF膜上,经丽春红染色鉴定并标记标准蛋白位置,5%脱脂奶粉封闭,TRPV1一抗及二抗孵育(兔抗人TRPV1一抗购自以色列Alomone公司,辣根过氧化物酶标记的羊抗兔二抗购自北京中杉金桥生物公司)。增强化学发光(ECL)显影(超敏ECL化学发光试剂盒BeyoECL Plus购自碧云天生物技术研究所),Quantity One软件扫描计算灰度值,以β-actin为内参照。
1.4 免疫组织化学检测TRPV1表达 标本经石蜡包埋7μm连续切片,分别行常规苏木素伊红染色和免疫组织化学染色。免疫组化采用SABC三步法,按试剂盒操作说明进行(羊抗兔SABC免疫组化试剂盒、DAB显色试剂盒、兔抗人TRPV1一抗购自武汉博士德公司)。显色试剂为高敏感二氨基联苯胺(DAB)。阴性对照取相同量的一抗稀释液代替TRPV1抗体,其余步骤同上。
1.5 免疫组化染色评估分析 每个标本随机选取5张切片,在×200视野下,于皮质逐层分别随机选取10个非重复区域,通过半定量“3分”模式计算染色强度,即:−,阴性(0分);+,弱阳性(1分);++中等(2分);+++,强阳性(3分);在选定的区域计算染色强度值(intensity score,IR)。此外,利用吸光密度测量法(optical density measurement)定量评估免疫组化结果。使用装备了数码照相机的光学显微镜(Leica,德国)获取×100视野下10个连续但不重叠区域,通过Image Pro-Plus图像分析软件,分别测量阳性结果光密度平均值与阴性背景光密度平均值,计算二者比值即相对光密度值(ratio of mean optical density,ODR)。
1.6 统计学处理 采用SPSS 12.0进行分析。数据均以()表示,行单因素方差分析和LSD-t检验。检测水准α=0.05。
2 结果
2.1 TRPV1 mRNA的表达 如图1所示,在所有实验组可以观察到预期的扩增条带TRPV1(182 bp)和β-actin(163 bp)。灰度分析结果显示,FCDI组(0.999±0.037,n=10)和FCDIIa组(1.113±0.097,n=10)TRPV1的相对灰度值显著大于CTX组(0.456±0.036,n=8),差异有统计学意义(P<0.05)。但FCDI组和FCDIIa组进行两两比较,差异无统计学意义(P<0.05)。
2.2 TRPV1蛋白的表达 如图2所示,在所有实验组可以观察到预期的蛋白条带TRPV1(95kD)和β-actin(37kD)。灰度分析结果显示,FCDI组(1.044±0.059,n=10)和FCDIIa组(1.001±0.064,n=10)TRPV1的相对灰度值显著大于CTX组(0.553±0.029,n=8),差异有统计学意义(P<0.05)。但FCDI组和FCDIIa组进行两两比较,差异无统计学意义(P﹥0.05)。
2.3 免疫组织化学观察TRPV1的表达 如图3所示,正常大脑皮质中TRPV1弱到中度表达。然而,在FCD病理切片上,我们发现TRPV1高表达于病灶皮质。高倍镜(×400)下,在CTX中,TRPV1主要表达于神经元和胶质样细胞。在FCDI型和FCDIIa型病灶中,TRPV1在柱形结构(86%±2%)和异型神经元(90%±3%)上呈强阳性表达。免疫组化染色评估分析提示,染色强度值(IR)和相对光密度值(ODR)均明显高于CTX皮质(表 1)(FCDI型 IR:P=0.026;ODR:P=0.019;FCDIIa型IR:P=0.023;ODR:P=0.021)

图1 RT-PCR检测TRPV1 mRNA在正常皮层(CTX)及局灶性皮质发育不良I型(FCDI)和IIa型(FCDIIa)中的表达情况
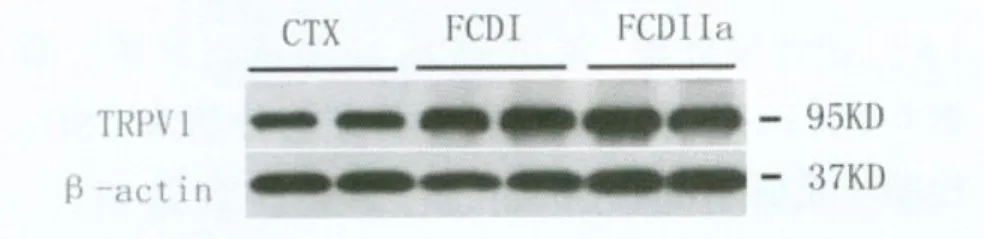
图2 Western-blot检测TRPV1蛋白在正常皮层(CTX)及局灶性皮质发育不良I型(FCDI)和IIa型(FCDIIa)中的表达情况

图3 HE染色及 CTX、FCDI、FCDIIa中 TRPV1的表达 A~C:CTX;D~F:FCDI;G~I:FCDIIa。A、D、G为HE染色,B、C、E、F、H、I为免疫组织化学;A、B、D、E为镜下100倍,G、H为镜下200倍,C、F、I为镜下400倍;标尺均表示50μm
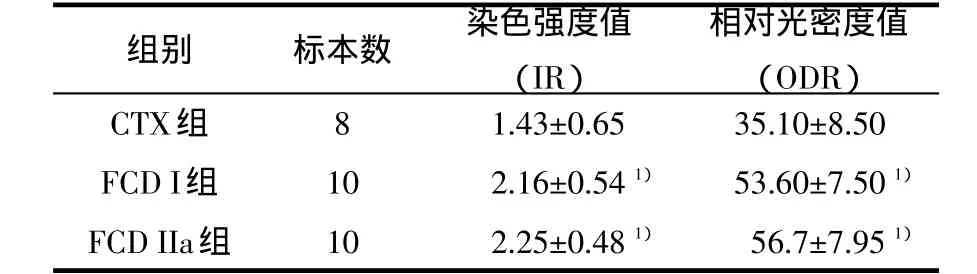
表1 TRPV1免疫反应强度评分
3 讨论
局灶性皮质发育不良是许多难治性癫痫的病理学基础,目前难治性癫痫须行外科治疗[1-3],因此在FCD所致难治性癫痫的预防、诊断和治疗方面,对皮层发育不良的形成机制及其致痫性的研究至关重要。而FCDI型和FCDIIa型癫痫发生机制的研究日趋成为人们关注的重点。有报道称,FCD组织中的异常细胞的不同类型及结构有着独特的形态学和电生理学特性。因此,这些异常细胞类型和结构在FCD患者的致癫痫发作和病理发生机制中发挥着重要作用。“柱形结构”和异型神经元是FCDI和FCDIIa的神经病理学特征性标志,影响神经递质的分泌和突触传递,与癫痫的发作之间联系密切[1,13-17]。
近年来,国内外的研究发现非选择性离子通道在癫痫发病机制中有着重要的作用。瞬时感受器电位(TRP)通道是位于细胞膜或胞内细胞器膜上的一类非选择性阳离子通道蛋白超家族。作为最被大家熟知和认识的一员——TRPV1经证实其可能与癫痫发生机制之间关系密切。TRPV1主要表达在初级传入感觉神经元上,存在于外周神经系统和中枢神经系统,主要对钠、钾、钙离子有通透性,对钙离子调节细胞信号起门控作用,能影响神经递质释放和突触传递,影响局部神经通路的兴奋性,是癫痫发作的一个促成因素[8-12]。我们利用RT-PCR和Western Blot检测发现TRPV1在转录水平及蛋白水平都较正常对照皮层显著升高,提示TRPV1表达上调可能是FCD所致难治性癫痫的发生机制之一。免疫组织化学发现TRPV1主要分布在FCDI和FCDIIa皮质癫痫病灶内的“柱形结构”和异型神经元上且呈高水平的表达。因此我们可以推测,TRPV1受体在“柱形结构”和异型神经元上激活,导致神经递质的分泌,而且增强突触传递,影响局部神经通路的兴奋性,最终导致难治性癫痫的发生。当然,这一切还需要进一步的电生理研究来证实。由于研究中样本量有限的关系,可能导致了FCDI和FCDIIa之间存在的些许差异,但其较对照组呈高表达的趋势是显而易见的。
另有研究证实,癫痫患者脑内存在神经元凋亡现象,天冬氨酸特异性半胱氨酸蛋白酶-3(caspase-3)基因在这一过程中可能发挥了重要的作用[18]。有研究发现caspase-3在异型神经元中的表达说明FCDIIb患者癫痫病灶中凋亡的存在[19]。但是,细胞凋亡参与癫痫发生的机制当前仍在讨论中。是否FCDI和FCDIIa中的“柱形结构”和异型神经元也存在细胞凋亡的标记物的表达,还需进一步研究。
本研究采用RT-PCR、Western Blot和免疫组化相结合的方法检测TRPV1在FCDI和FCDIIa所致的难治性癫痫病灶中的表达情况。研究结果表明TRPV1的高表达可能与FCDI和FCDIIa致癫痫发作有关。但FCD的致痫性是一个复杂的过程,目前对TRPV1在其中如何发挥作用尚不完全清楚。本研究仅对TRPV1在FCD所致的难治性癫痫发生机制中的作用进行了初步探讨,但TRPV1的具体作用机制以及其可否成为难治性癫痫的药物治疗靶点,还有待更进一步研究。
[1]Palmini A,Najm I,Avanzini G,et al.Terminology and classifi⁃cation of the cortical dysplasias[J].Neurology,2004,62(Suppl 3):S2-8.
[2]梅开勇,郝卓芳,欧阳小明.脑局灶性皮层发育不良相关性难治性癫痫的临床病理分析[J].中国神经精神疾病杂志,2010,36(7):419-422
[3]王玮,朴月善,陈莉,等.难治性癫痫的神经病理学进展[J].中国神经精神疾病杂志,2009,35(12):751-753
[4]Pena F,Ordaz B.Non-selective cation channel blockers:poten⁃tial use in nervous system basic research and therapeutics[J].Mini Rev Med Chem,2008,8(8):812-819.
[5]Simard JM,Chen M,Tarasov KV,et al.Newly expressed SUR1-regulated NC(Ca-ATP)channel mediates cerebral edema after ischemic stroke[J].Nat Med,2006,12(4):433-440.
[6]Aarts M,Iihara K,Wei WL,et al.A key role for TRPM7 chan⁃nels in anoxic neuronal death[J].Cell,2003,115(7):863-877.
[7]Clapham DE,Julius D,Montell C,et al.International Union of Pharmacology.XLIX.Nomenclature and structure-function rela⁃tionships of transient receptor potential channels[J].Pharmacol Rev,2005,57(4):427-450.
[8]Bhaskaran MD,Smith BN.Effects of TRPV1 activation on syn⁃aptic excitation in the dentate gyrus of a mouse model of tempo⁃ral lobe epilepsy[J].Exp Neurol,2010,223(2):529-536.
[9]Kauer JA,Gibson HE.Hot flash:TRPV channels in the brain[J].Trends Neurosci,2009,32(4):215-224.
[10]Peters JH,McDougall SJ,Fawley JA,et al.Primary afferent acti⁃vation of thermosensitive TRPV1 triggers asynchronous gluta⁃mate release atcentralneurons[J].Neuron,2010,65(5):657-669.
[11]Karlsson U,Sundgren-Andersson AK,Johansson S,et al.Capsa⁃icin augments synaptic transmission in the rat medial preoptic nucleus[J].Brain Res,2005,1043(1-2):1-11.
[12]Gibson HE,Edwards JG,Page RS,et al.TRPV1 channels medi⁃ate long-term depression at synapses on hippocampal interneu⁃rons[J].Neuron,2008,57(5):746-759.
[13]Blumcke I,Thom M,Aronica E,et al.The clinicopathologic spectrum of focal cortical dysplasias:a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Meth⁃ods Commission[J].Epilepsia,2010,52(1):158-174.
[14]Cepeda C,Andre VM,Yamazaki I,et al.Comparative study of cellular and synaptic abnormalities in brain tissue samples from pediatric tuberous sclerosis complex and cortical dysplasia type II[J].Epilepsia,2010,51(Suppl 3):160-165.
[15]Cepeda C,Andre VM,Vinters HV,et al.Are cytomegalic neu⁃rons and balloon cells generators of epileptic activity in pediat⁃ric cortical dysplasia?[J].Epilepsia,2005,46(Suppl 5):82-88.
[16]Cepeda C,Hurst RS,Flores-Hernandez J,et al.Morphological and electrophysiological characterization of abnormal cell types in pediatric cortical dysplasia[J].J Neurosci Res,2003,72(4):472-486.
[17]Cepeda C,Andre VM,Levine MS,et al.Epileptogenesis in pedi⁃atric cortical dysplasia:the dysmature cerebral developmental hypothesis[J].Epilepsy Behav,2006,9(2):219-235.
[18]尚伟,刘伟红,张珑,等.Fas、caspase-3蛋白在颞叶癫痫病灶内的表达与神经元凋亡[J].中国神经精神疾病杂志,2005,31(5):359-361
[19]Shu HF,Yu SX,Zhang CQ,et al.Expression of TRPV1 in corti⁃cal lesions from patients with tuberous sclerosis complex and fo⁃cal cortical dysplasia type IIb[J].Brain Dev,2012.doi:10.1016/j.braindev.2012.004.007.[Epub ahead of print]

