松果体区原发性绒毛膜癌的临床特点和治疗选择
朱明华 方陆雄 徐书翔 张喜安 邱炳辉 漆松涛
松果体区原发性绒毛膜癌罕见,自Askanazy于1906年首次报道后,至今文献仅报道了100多例。Matsutani等报道的153例原发性生殖细胞肿瘤中,仅3例绒毛膜癌,约占2.0%[1]。我科曾在2007年报告了2例患者的综合治疗经验[1],此后又手术治疗了3例。总结分析这5例患者的临床资料,发现其临床特点突出,现报告如下。
1 对象与方法
1.1 一般资料 纳入标准:①CT或MRI影像显示肿瘤位于松果体区;②经手术治疗,病理诊断明确为绒毛膜癌(choriocarcinoma)。5例患者均为男性,年龄7~13岁,平均(9.8±2.2)岁,病史2d至14个月。
1.2 方法 回顾性分析我科2004年1月至2012年1月收治的松果体区肿瘤病例,对其临床表现、影像学特点(包括复诊资料)、手术资料及治疗策略等进行分析和总结。
2 结果
2.1 临床表现及实验室检查 5例患者中3例以头痛、呕吐等颅高压表现起病,病史2d~1周;1例以多饮、多尿为主要表现,1年后出现发热、呕吐,并分别于入院前1个月、3周和2周在外院行内镜下三脑室底造瘘术、肿瘤γ-刀治疗和脑室外引流术,入院时检查发现存在肿瘤肺内转移;1例初始表现为生殖器和第二性征发育提前,14个月后出现头痛、头晕、呕吐。入院时,5例患者均呈现精神萎靡状态,2例已行脑室外引流。3例眼球上下运动不能,1例眼睑下垂。检查还发现患者均存在外生殖器过早发育和明显的第二性征,与同龄儿比较,表现为肌肉结实,声音低沉,阴茎增粗、增长,色素明显,阴毛早现,甚至出现喉结,但睾丸粗测大小基本正常。血清肿瘤标志物检查:甲胎蛋白(alpha-fetoprotein,AFP)正常 4例,轻度增高1例(16.9μg/L),b-人绒毛膜促性腺激素(β-choriogonadotrophin,b-HCG)均显著增高,达6988~128936mIU/mL。5例患者均排除睾丸等其他部位存在原发性肿瘤,1例曾在外院行CT检查,诊断为“肾上腺皮质增生”。
2.2 影像学表现 5例患者均行颅脑CT和MRI检查,肿瘤位于松果体区,最大直径2.6~4.8cm,4例呈类圆形,边界基本清楚,缺乏沿三脑室侧壁生长的"C"形征,1例形态不规则,边界欠清楚。CT上肿瘤呈等密度2例、稍高密度3例,3例肿瘤内有小片状散在高密度影,难以确定系肿瘤卒中出血或钙化,1例伴有大片高密度影,考虑为血肿。MRI T1加权像上肿瘤表现为等或稍低信号,信号不均匀,瘤内有散在高信号影,2例还存在更低信号影。T2加权上肿瘤表现为等信号1例、稍低信号1例、稍高信号3例,信号多不均匀,肿瘤周边无明显水肿表现。增强扫描4例明显强化、1例中度强化,但强化都不均匀。鞍上、脑室壁等颅内其他部位未发现存在明确的肿瘤灶。
2.3 治疗与预后 除2例已经行脑室外引流的患者外,其余3例入院后病情进展迅速,颅高压征象明显,2例突发昏迷。为缓解病情,此3例患者均于术前紧急行脑室外引流,其后,昏迷患者中1例清醒,1例因肿瘤卒中中脑受压而致意识障碍持续存在。5例患者均经开放手术切除肿瘤,手术入路为枕部开颅经小脑幕入路。术中发现肿瘤脆软,血供极其丰富,出血较多。4例瘤内有明确卒中出血表现。术后根据患者的临床状况和家属意愿,3例进行了化疗,其间2例还进行了全脑放疗。术中录像和术后影像学复查显示肿瘤全切除4例,次全切除1例。术后1周内复查血清肿瘤标志b-HCG,4例降低明显,但没有达到正常水平,为221-3077mIU/mL,1例伴肺内转移患者变化不明显。1例术前昏迷患者术后仍呈昏迷状态,1例术后术区出血导致患者昏迷,此2例患者未进一步治疗。伴肺内转移患者术后化疗1疗程,病情相对稳定,但未进一步来院治疗,失去随访。1例术后进行了化疗和放疗,期间因脑积水行三脑室底造瘘术,导致放疗未完全实施,仅照射了6次,4疗程化疗后血清和脑脊液b-HCG均正常,但2年后b-HCG再度升高,PET检查发现肿瘤中枢神经系统内种植转移,再给予化疗和自体造血干细胞移植,术后44个月死亡。1例术后进行了化疗和放疗,期间同样因脑积水行三脑室底造瘘术,术后继续放化疗,至完成治疗计划,随访超过6年,现身高178cm,学习成绩中等,性发育正常,MRI复查未发现肿瘤复发,血清b-HCG正常(图1-2)。术后病理检查见图2。

图1 松果体区原发性绒毛膜癌。 A~D:手术前MRI平扫及增强扫描;E:肿瘤切除术后2 d,MRI增强扫描,示肿瘤全切除;F:肿瘤切除术后6周,MRI增强扫描,示脑积水;G:内镜下三脑室底造瘘术后3 d,MRI增强扫描,脑积水缓解;H:肿瘤切除术后6年,未见肿瘤复发
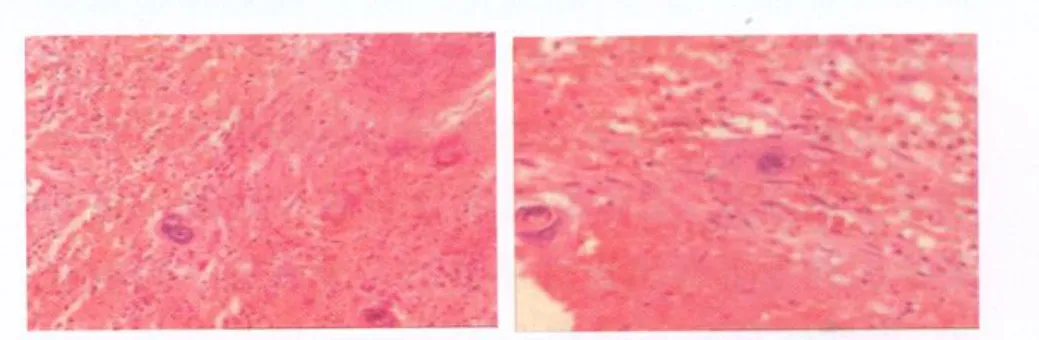
图2 松果体区原发性绒毛膜癌的病理表现。镜下见肿瘤内部含大量出血坏死组织,其内见少量绒毛膜癌细胞。肿瘤细胞异型性明显,核大深染,可见明显核仁,胞浆红染丰富(HE染色,×200)
3 讨论
按WHO 2007中枢神经系统肿瘤分类标准,绒毛膜癌属于生殖细胞肿瘤。松果体区绒毛膜癌发病率低,目前尚无大宗的文献报道。2004年,Shinoda等[2]复习1975年以后的有关文献,加上作者自己的1例病例,总共仅报道19例经活检或手术后病理检查证实的松果体区绒毛膜癌。因此,临床上对松果体区绒毛膜癌的认识仍不深入,更缺乏清晰的治疗路径。
本组5例患者均经开放手术、病理检查证实。仔细分析患者的临床资料,可以发现松果体区绒毛膜癌具有一些共同的临床特征:①本组5例患者均为男性,而Shinoda等收集的19例患者中,男18例,女1例。这些病例说明,与松果体区其他病理类型的生殖细胞肿瘤一样,绒毛膜癌具有明显的男性好发倾向。②松果体区生殖细胞肿瘤多发生于青少年,以年龄的第二个十年为发病高峰,平均发病年龄约16岁。Shinoda等[3]收集的19例患者平均年龄12.8岁,本组平均年龄9.8岁。相比于松果体区其他生殖细胞肿瘤,绒毛膜癌发病年龄更小。③5例患者均出现生殖器和第二性征发育明显较同龄儿提前的性早熟征象,其中1例患者还因此就诊1年余。追问病史,其他4例患者的家长在患者入院前半年至1年间也曾有类似发现,但没有引起重视。既往认为,松果体区肿瘤引起性早熟的原因是肿瘤破坏松果体,致使松果体细胞分泌的褪黑素减少,而褪黑素对生殖系统有调节作用,可抑制性腺的发育,褪黑素分泌减少,对性腺的抑制作用减弱,导致生殖器和第二性征发育提前。然而,此理论无法合理解释松果体区肿瘤患者中出现性早熟的比例较低、而绒毛膜癌或含绒毛膜癌的混合性生殖细胞肿瘤患者性早熟多见的现象;说明褪黑素分泌减少可能不是松果体区肿瘤患者出现性早熟的主要原因。目前认为,男性性早熟与肿瘤分泌的b-HCG有关。绒毛膜癌由滋养细胞发展而来,可分泌b-HCG,引起血清b-HCG显著增高。在男性患者,异常增高的b-HCG可促使睾丸间质细胞分泌睾酮,进而出现阴茎增粗、增长、第二性征早现,表现为性早熟[4,5]。b-HCG诱发的性早熟系假性性早熟,多不伴有睾丸体积相应的增大。及时有效治疗的情况下,患者生长发育可望达到正常水平。
分析本组患者的术前病程,可以发现,松果体区绒毛膜癌既可能以性早熟或尿崩症(本组1例)为初始表现,病情缓慢进展,然后突然加重,短时间内出现颅高压危象,也可能在没有任何颅高压征兆的情况下突然出现严重颅高压表现,甚至昏迷。究其原因,我们认为是肿瘤突发卒中出血造成急性梗阻性脑积水,或中脑受压所致。绒毛膜癌是高度恶性肿瘤,增生活跃、质地脆软,并可广泛浸润周围组织和血管,极易出血。文献报道出血还可能来自肿瘤周围的动脉[6]。血管受绒毛膜癌浸润破坏,形成动脉瘤继而破裂出血,表现如同肿瘤卒中。这种情况下血肿多在肿瘤周边,出血量较瘤内出血大。本组术前影像学检查和术中发现证实肿瘤卒中发生率高,其中1例出血量较大,但无法确定是瘤内卒中或是周围血管破坏的结果。
松果体区绒毛膜癌的治疗方案应依据患者就诊时的状况和所在医院的技术条件确定。一般认为,开放手术切除肿瘤有助于缓解病情、防止肿瘤卒中导致病情突然恶化。在技术条件成熟的单位,手术应该提倡[7]。在患者病情因出血突然恶化的情况下,开放手术更难以避免。然而,松果体区绒毛膜癌位置深在,毗邻重要神经组织和血管,肿瘤本身血供极其丰富,肿瘤还可侵袭破坏周围深静脉系统,种种因素决定了开放手术的难度和风险均较大,限制了医患双方的积极性。相对于其他松果体区肿瘤,绒毛膜癌立体定向活检或脑室镜下活检导致出血的可能性较大,且出血难以直接控制,应该引起警惕并避免实施。我们在2007年报告2例松果体区绒毛膜癌的综合治疗后,总结上述经验,积极实施开放手术治疗,取得了较好的治疗效果。另一方面,肿瘤本身分泌b-HCG,b-HCG是肿瘤特异性标志物,血清或脑脊液b-HCG显著增高时,结合影像学表现,无需活检即可直接诊断肿瘤为绒毛膜癌或包含绒毛膜癌的生殖细胞肿瘤[8]。因此,在技术条件有限或患者病情相对稳定的情况下,可采用风险较低的内引流术缓解脑积水,然后直接实施化放疗[9]。鉴于松果体区绒毛膜癌容易发生颅内种植转移,转移到颅外系统的比例也较高,且肿瘤对化疗反应良好,因此,化疗在松果体区绒毛膜癌治疗中具有不可替代的作用。我们认为化疗具有颅内外兼顾的作用,应该优先实施。化疗疗程应足够,药物选择、给药方式应规范,以达到扑灭颅外可能存在的转移病灶,有效控制颅内原发及种植的病灶为目标。考虑到血脑屏障的影响,化疗结束后,应争取实施全中枢放疗以巩固疗效。治疗随访期间,血清和脑脊液b-HCG是判断治疗效果、肿瘤是否复发的可靠指标[10]。本组疗效较好的2例患者均进行了综合治疗,其中1例放疗未充分实施,2年后肿瘤颅内种植转移,术后44个月死亡。另1例完成了化疗和放疗,随访超过6年,未见肿瘤复发,结果部分印证了充分综合治疗的重要性。
总之,对男性儿童,有性早熟征象时,应警惕松果体区绒毛膜癌的可能,对此有所认识有助于早期诊断。松果体区绒毛膜癌的治疗应联合使用手术、化疗和放疗的方法,化疗应优先于放疗。
[1]张喜安,漆松涛,方陆雄,等.原发性松果体区绒毛膜癌的综合治疗(附2例报告)[J].南方医科大学学报,2007,27(8):3.
[2]Shinoda J,Sakai N,Yano H,et al.Prognostic factors and thera⁃peutic problems ofprimary intracranialchoriocarcinoma/germ-cell tumors with high levels of HCG[J].J Neurooncol,2004,66(1-2):225-240.
[3]Al-Hussaini M,Sultan I,Abuirmileh N,et al.Pineal gland tu⁃mors:experience from the SEER database[J].J Neurooncol,2009,94(3):351-358.
[4]Marshall GA,McMahon SK,Nicholls W,et al.Gonadotro⁃phin-independent precocious puberty in an eight-year-old boy due to ectopic human chorionic gonadotrophin from the central nervous system[J].Ann Clin Biochem,2010,47(Pt 3):271-274.
[5]Schwabe J,Calaminus G,Vorhoff W,et al.Sexual precocity and recurrent beta-human chorionic gonadotropin upsurges preced⁃ing the diagnosis of a malignant mediastinal germ-cell tumor in a 9-year-old boy[J].Ann Oncol,2002,13(6):975-977.
[6]Zairi F,De Saint Denis T,Thines L,et al.Ruptured cerebral on⁃cotic aneurysm from choriocarcinoma:report of two cases and re⁃view of the literature[J].Acta Neurochir(Wien),2011,153(2):353-357.
[7]方陆雄,漆松涛,邱炳辉,等.枕部经小脑幕入路切除松果体区肿瘤(附68例报告)[J].中国神经精神疾病杂志,2007,33(8):498-500.
[8]Kuo HC,Sheen JM,Wu KS,et al.Precocious puberty due to hu⁃man chorionic gonadotropin-secreting pineal tumor[J].Chang Gung Med J,2006,29(2):198-202.
[9]Murata T,Shigeta H,Sato A,et al.[Intratumoral hemorrhage in choriocarcinoma during neuroendoscopic third ventriculostomy:case report][J].No Shinkei Geka,2006,34(3):305-310.
[10]Fujimaki T,Mishima K,Asai A,et al.Levels of beta-human chorionic gonadotropin in cerebrospinal fluid of patients with malignant germ cell tumor can be used to detect early recur⁃rence and monitor the response to treatment[J].Jpn J Clin On⁃col,2000,30(7):291-294.

