苯丙胺类药物所致精神病性障碍患者脑白质微结构改变的弥散张量成像研究☆
赵晓丹 徐芳芳 苏中华 郝伟
近年研究发现,物质依赖具有神经毒性,可造成神经细胞形态和结构的慢性、永久性和不可逆性损害[1]。大量形态学和功能性磁共振研究提示苯丙胺类药物依赖者脑损害涉及多个脑区,甚至多个脑区间的神经联系网络[2-3]。反复滥用苯丙胺类药物可产生幻觉、妄想、情感反应不协调等类偏执型精神分裂症的症状。精神分裂症患者的磁共振弥散张量成像(diffusion tensor imaging,DTI)研究发现多脑区白质纤维连接存在异常[4-5],而国内外对合并精神病性症状的苯丙胺类药物依赖者研究甚少。本研究利用DTI技术探索苯丙胺类药物所致精神病性障碍者多个脑区白质纤维的结构完整性和连通性,并探讨这些微结构异常与精神病性症状的关系。
1 对象与方法
1.1 研究对象 来自2011年12月至2012年4月在济宁医学院第二附属医院(又名山东省安康医院)戒毒所自愿接受戒毒治疗的苯丙胺类药物所致精神病性障碍患者,由两名具有主治医师或以上资格的精神科医生确诊。入组标准:①符合《中国精神障碍分类及诊断标准第3版》(Chinese classification of mental disorders-3,CCMD-3)精神活性物质所致精神障碍中的兴奋剂所致精神障碍,入院时尿检甲基苯丙胺呈阳性;②吸食苯丙胺类药物时间超过半年,无其他精神活性药物滥用史;③本次住院治疗的首要原因是使用苯丙胺类药物后出现精神病性症状;④无其他精神疾病、严重躯体疾病、颅脑外伤或其他神经系统疾病,神经系统检查无阳性体征;⑤右利手。排除标准:①常规磁共振扫描后显示既往有颅脑损伤、遗留脑软化灶或其他神经系统结构异常;②体内有金属异物;③幽闭恐惧症者。入组患者共40例,全部为男性,汉族,年龄20~37岁,平均(27.98±4.67)岁。苯丙胺类药物使用时间1~8年,平均(3.90±1.99)年,日用量0.2~1.0g,平均(0.46±0.26)g。
选取年龄、性别、文化程度与苯丙胺类药物所致精神病性障碍患者相匹配的健康成年人作为对照组,对照组均为济宁医学院第二附属医院的实习医生、护士和后勤人员。入组标准:①无精神活性物质使用史;②无精神疾病、严重躯体疾病、颅脑外伤或其他神经系统疾病,神经系统检查无阳性体征;③右利手。排除标准:①常规磁共振扫描后显示既往有颅脑损伤、遗留脑软化灶或其他神经系统结构异常者;②体内有金属异物者;③幽闭恐惧症者。共入组40名男性,汉族,年龄20~40岁,平均(26.18±4.65)岁。患者组与对照组的年龄差异无统计学意义(P>0.05)。
此研究经医院医学伦理委员会批准,检查前均详细告知被试者实验内容及方法,并签署知情同意书。
1.2 方法
1.2.1 临床资料收集 由同一精神科医师完成。采用自编调查表了解被试者的一般情况,内容包括年龄、文化程度、职业、婚姻状况及毒品使用相关信息等。采用简明精神病量表(brief psychiatric reacting scale,BPRS)评定患者组精神病性症状的严重程度,量表包含焦虑忧郁因子、缺乏活力因子、思维障碍因子、激活性因子和敌对猜疑因子。
1.2.2 影像学检测 患者入院(12.2±4.3)d内采用Siemens Magnetom Avanto超导3.0T MR扫描仪进行检测。扫描前用耳机塞住双耳,减小噪音对所测数值的影响,应用8通道相控阵头线圈,以专用衬垫固定头部制动。行常规MRI和DTI扫描。DTI序列为扩散敏感单次激发(spin echo-echo planar imaging,SE-EPI)序列。参数:TR 4900ms,TE 95ms,视野(field of view,FOV)230mm×230mm,矩阵128×128,采用AC-PC定位线获得35层无间隔横断位图像,层厚3mm,使用2个扩散权重,b值分别为0和1000mm2/s,在20个方向上分别施加扩散敏感梯度,3次信号平均,采集时间为5min 25s。全脑3D结构像为MP-rage序列,扫描层面为矢状面。参数:TR 1900ms,TE 2.99ms,TI 900ms,翻转角 9°,矩阵256×256,16层,层厚0.9mm,层间隔0.27mm,体素为0.9mm×0.9mm×0.9mm。将采集到的DTI原始数据传至Leonardo工作站,用自带的Neuro3D软件包进行离线分析,导入原始数据,应用内插方法进一步提高图像分辨率。经工作站处理自动计算产生各向异性分数(fraction alanisotropy,FA)图和表观扩散系数(apparent diffusion coefficient,ADC)图。各参数图进行图像配准,分别选取双侧前额叶白质、扣带、顶叶、内囊膝部、丘脑、海马及胼胝体膝部、压部。在三维彩色编码张量图上确认纤维束的走行,然后在b=0图像按照不同解剖部位手工放置感兴趣区(region of interest,ROI),其面积随被测区大小而定,以减小容积效应对测量值的影响,每个ROI均多次测量,以确保该部位所选层面的FA值最大。检查由同一名影像学医师完成,以减小因ROI选择的位置、体素大小不同而导致的误差。见图1。
1.2.3 药物治疗 患者组予奥氮平(5mg/片)或利培酮(1mg/片)治疗。服用奥氮平者共35例,起始剂量为10mg/d,根据病情逐渐加量,DTI检测时服用剂量为(16.0±5.0)mg/d,累计剂量为(169.7±79.0)mg;服用利培酮者共5例,起始剂量为2mg/d,根据病情及不良反应逐渐加量,DTI检测时服用剂量为(3.2±1.1)mg/d,累计剂量为(34.4±18.9)mg。治疗期间可酌情使用苯二氮 类、安坦等药物,未使用其他抗精神病药物和戒毒药物。
1.3 统计学方法 数据采用SPSS 16.0进行统计分析。患者组与对照组各相同部位的FA值、ADC值比较均采用独立样本t检验,患者组FA值、ADC值与使用年限、日用量、BPRS总分及各因子分相关性分析采用Pearson相关分析,检验水准α为0.05,双侧检验。
2 结果
2.1 患者组与对照组FA、ADC值比较 与对照组相比,患者组左侧前额叶白质FA降低(t=2.01,P<0.05),胼胝体膝部(t=2.82,P<0.01)、双侧顶叶(右侧t=3.27,P<0.01;左侧t=2.21,P<0.05)、右侧海马(t=2.99,P<0.01)ADC值均升高,差异有统计学意义。见表1、2。

图1 来自苯丙胺类药物所致精神病性障碍患者,图中的圆圈示所选的ROI。图A、B分别示胼胝体膝部FA图和T1WI图,图C、D分别示右侧内囊膝部FA图和T1WI图
表1 患者组与对照组各脑区FA值比较()

表1 患者组与对照组各脑区FA值比较()
1)与对照组比较,经t检验,P<0.05
组别患者组对照组n 4040前额叶白质右侧0.42±0.090.45±0.08左侧0.42±0.121)0.46±0.08扣带右侧0.64±0.190.60±0.15左侧0.69±0.160.66±0.14顶叶右侧0.43±0.120.46±0.09左侧0.45±0.130.46±0.09组别患者组对照组内囊膝部右侧0.68±0.080.65±0.09左侧0.65±0.130.64±0.09丘脑右侧0.30±0.070.29±0.05左侧0.29±0.090.28±0.05海马右侧0.15±0.030.15±0.03左侧0.17±0.040.15±0.03胼胝体膝部0.80±0.070.83±0.05压部0.83±0.050.84±0.05
表2 患者组与对照组各脑区ADC值比较()

表2 患者组与对照组各脑区ADC值比较()
1)与对照组比较,经t检验,P<0.01;2)与对照组比较,经t检验,P<0.05
组别患者组对照组n 4040前额叶白质右侧0.75±0.070.73±0.06左侧0.74±0.090.71±0.03扣带右侧0.75±0.050.73±0.06左侧0.75±0.060.74±0.06顶叶右侧0.76±0.091)0.71±0.04左侧0.74±0.082)0.71±0.05组别患者组对照组内囊膝部右侧0.72±0.050.73±0.06左侧0.70±0.050.71±0.06丘脑右侧0.82±0.210.77±0.04左侧0.78±0.040.77±0.03海马右侧0.86±0.111)0.80±0.05左侧0.90±0.400.79±0.05胼胝体膝部0.79±0.061)0.76±0.05压部0.77±0.050.76±0.05
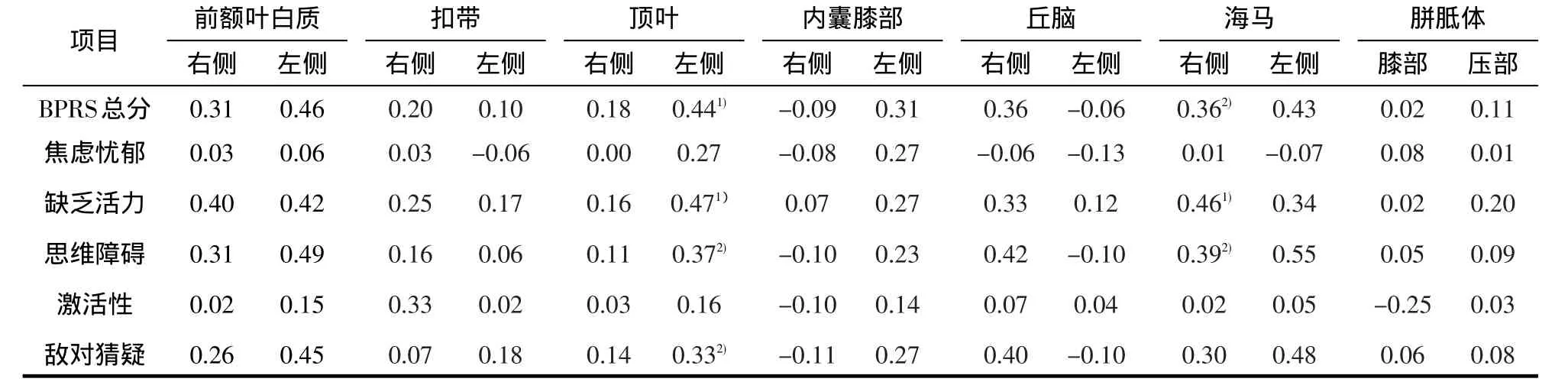
表3 患者组各脑区ADC值与BPRS总分及各因子分的Pearson相关分析(r)
2.2 患者组各脑区FA值、ADC值与苯丙胺类药物使用年限、日用量的Pearson相关分析 患者组各脑区FA值、ADC值与苯丙胺类药物使用年限、日用量之间的相关性无统计学意义(P>0.05)。
2.3 患者组FA、ADC值与BPRS总分及各因子分的Pearson相关分析 患者组BPRS总分为(37.9±20)分,焦虑忧郁因子(8.3±4.2)分,缺乏活力因子(7.6±3.8)分,思维障碍因子(8.1±5.0)分,激活性因子(6.9±3.8)分,敌对猜疑因子(6.9±4.1)分。患者组各脑区FA值与BPRS总分、各因子分之间相关性无统计学意义(P>0.05)。患者组左侧顶叶(r=0.44,P<0.01;r=0.47,P<0.01;r=0.37,P<0.05)、右侧海马(r=0.36,P<0.05;r=0.46,P<0.01;r=0.39,P<0.05)ADC值与BPRS总分、缺乏活力、思维障碍因子分呈正相关,左侧顶叶ADC值亦与敌对猜疑因子分正相关(r=0.33,P<0.05)。见表3。
3 讨论
DTI着重于观察组织的微观结构及其排列规律,FA值为DTI的一个特征性参数。FA值大,说明纤维束排列紧密,方向一致及结构的完整性较好;FA值降低,提示神经纤维的结构破坏。另一个参数ADC值,反映组织内水分子弥散程度,即弥散的方向性、范围。ADC值增大,说明弥散程度大,水分子扩散受限程度小。
大量动物实验证明苯丙胺类药物可引起额叶、顶叶和海马白质纤维束的急性崩解和慢性碎裂,形成脑功能失调的基础[6]。本研究发现,苯丙胺类药物所致精神病性障碍患者的左前额白质FA值减小,降低的FA值反映白质纤维束的破坏,但损伤的原因并不清楚。局部脑缺血可能是一个原因。苯丙胺类物质的神经毒性作用致脑灌流不足,慢性脑灌流不足的大鼠电镜超微结构观察显示轴突有不同程度的水样变性、退行性变性及髓鞘板层分离、断裂等,提示这些轴突、髓鞘的改变导致白质纤维特征性的损伤[7]。以往影像学研究认为苯丙胺滥用者存在额叶体积减少[8]及葡萄糖代谢减低[9],这些研究共同支持额叶是药物成瘾最易损伤的脑区。另外海洛因和酒精依赖者普遍存在FA值的改变[10],暗示着FA值改变可能是药物成瘾的生物学标志。胼胝体是连接左右侧大脑半球的最大连合纤维,其中膝部胼胝体连接左右背外侧前额皮质,压部胼胝体连接顶叶和枕叶,在大脑半球的交流和认知过程中起关键作用。本研究亦发现苯丙胺类药物所致精神病性障碍患者胼胝体膝部ADC值增高,分析原因是长期物质滥用会导致局部脑组织代谢异常,这种微环境的改变可引起神经元水肿、萎缩,细胞膜通透性改变,细胞外间隙增大及正常组织结构消失,神经胶质细胞增生,引起ADC值升高。而FA值没有差异则意味着尽管细胞外间隙增大,但主要的白质纤维束仍保持其平行排列的组织结构。患者组与对照组胼胝体压部并无统计学差异,与大多研究结果相似[11-12],上述结果说明苯丙胺类物质所致脑白质结构病理改变集中,可能原因是膝部纤维比压部直径小且髓鞘形成少,在长期的药物刺激下更容易受到损害。额叶是人类的精神活动中枢,额叶微细结构的改变或其与皮层下连接异常,均会导致脑功能连接损害,而引起一系列临床症状。本研究结果显示额叶微结构异常与临床特征无相关性,对此国内外研究结果不一,部分研究显示FA值越低,症状越严重;另有研究结果截然相反,目前原因尚不清楚[11-13]。脑白质微结构改变受多种因素影响,Alicata等[14]发现苯丙胺滥用者额叶白质ADC值与持续滥用时间正相关,Salo等[15]则认为这类人群DTI参数与持续滥用时间、剂量无相关性,支持本研究结果。两种相反结果的出现可能是样本量小、扫描技术不同所致。
本研究还发现,苯丙胺类药物所致精神病性障碍患者左、右顶叶及右侧海马ADC值增大,提示苯丙胺滥用者脑内存在比较广泛的神经联系异常;并发现左侧顶叶和右侧海马ADC值与BPRS总分、缺乏活力、思维障碍因子分呈正相关,左侧顶叶ADC值亦与敌对猜疑因子分正相关。结果说明脑内的神经联系受损进一步影响脑功能,且损伤越严重,精神病性症状越严重,与先前的研究结果是一致的[16-17]。精神分裂症患者的DTI研究发现,颞叶白质ADC值增加,且其与听幻觉和注意损伤有关,提示白质纤维束构建的缺失,可能导致听觉/语言加工区域脱节[18],支持本研究结果。
本研究揭示了苯丙胺类药物所致精神病性障碍患者前额叶白质、顶叶、海马存在白质微结构完整性和连接性异常,且顶叶、海马微结构改变与精神病性症状相关。DTI是显示脑白质纤维结构的一项技术,其检测指标的异常是长期药物滥用的结果。本研究患者组服用抗精神病药物治疗时间较短,对FA值和ADC值影响不大。
[1]Poom HF,Abdullah L,Mullan MA,et al.Cocaine-induced oxidative stress precedescelldeath in human reuronal progenitor cells[J].Neurochem Int,2007,50(1):69-73.
[2]Kim YT,Lee JJ,Song HJ,et al.Alterations in cortical activity of male methamphetamine abusers performing an empathy task:fMRI study[J].Hum Psychopharmacol,2010,25(1):63-70.
[3]温金峰,成丽娜,宁连才,等.苯丙胺类物质依赖的脑弥散张量成像研究[J].中国神经精神疾病杂志,2011,37(12):710-714.
[4]苏中华,成义仁,王贵山,等.首发偏执型精神分裂症患者的脑白质磁共振弥散张量成像研究[J].中国神经精神疾病杂志,2010,36(4):233-236.
[5]Fujiwara H,Namiki C,Hirao K,et al.Anterior and posterior cingulum abnormalities and their association with psychopathology in schizophrenia:a diffusion tensor imaging study[J].Schizophr Res,2007,95(1):215-222.
[6]Chung A,Lyoo IK,Kim SJ,etal.Decreased frontal white-matter integrity in abstinent methamphetamine abusers[J].Int J Neuropsychopharmacol,2007,10(6):765–775.
[7]李艳明,吴光辉,曾晓锋.甲基苯丙胺中毒小鼠脑组织神经元超微结构变化的研究[J].现代生物医学进展,2011,11(2):207-210.
[8]Nakama H,Chang L,Fein G,et al.Methamphetamine users show greater than normal age-related cortical grey matter loss[J].Addiction,2011,106(8):1474-1483.
[9]Kim YT,Lee SW,Kwon DH,et al.Dose-dependent frontal hypometabolism on FDG-PET in methamphetamine abusers[J].Psychiatry Res,2009,43(14):1166-1170.
[10]Arnone D,Abou-Saleh MT,Barrick TR.Diffusion tensor imaging of the corpus callosum in addiction[J].Neuropsychobiology,2006,54(2):107-113.
[11]Tobias MC,O’Neill J,Hudkins M,et al.White-matter abnor⁃malities in brain during early abstinence from methamphet⁃amine abuse[J].Psychopharmacology,2010,209(1):13-24.
[12]Kim IS,Kim YT,Song HJ,et al.Reduced corpus callosum white matter microstructural integrity revealed by diffusion tensor ei⁃genvalues in abstinent methamphetamine addicts[J].Neurotoxi⁃cology,2009,30(2):209-213.
[13]Tang J,Liao Y,Zhou B,et al.Abnormal anterior cingulum integrity in first episode,early onset schizophrenia:a diffusion tensor imaging study[J].Brain Res 2010,1343:199-205.
[14]Alicata D,Chang L,Cloak C,et al.Higher diffusion in striatum and lower fractional anisotropy in white matter of methamphetamine users[J].Psychiatry Res,2009,174(1):1-8.
[15]Salo R,Nordahl TE,Buonocore MH,et al.Cognitive control and white matter callosal microstructure in methamphetaminedependent subjects:a diffusion tensor imaging study[J].Biol Psychiatry,2009,65(2):122-128.
[16]Chan WY,Yang GL,Chia MY,et al.White matter abnormalities in first-episode schizophrenia:a combined structural MRI and DTI study[J].Schizophr Res,2010,119(1-3):52-60.
[17]Wolkin A,Choi SJ,Szilagyi S,et al.Inferior frontal white matter anisotropy and negative symptoms of schizophrenia:a diffusion tensor imaging study[J].Am J Psychiatry,2003,160(3):572-574.
[18]Lee KU,Yoshida T,Kubicki M,et al.Increased diffusivity in superiortemporalgyrus in patients with schizophrenia:a diffusion tensor imaging study[J].Schizophr Res,2009,108(1):33-40.

