肿瘤标志物对胃癌诊断及预后的评估价值
焦 艳
胃癌是人类常见的恶性肿瘤之一,预后5年的生存率不超过20%[1]。目前,电化学发光法检测肿瘤标志物,是近年来临床上常用的快速检测方法[2]。血清CEA、CA724、CA199等肿瘤是常用的检测指标。我们通过比较198例胃癌患者及198例非胃癌患者的血清肿瘤标志物CEA、CA724、CA199水平差异,及其在不同胃癌分期中的水平差异与阳性率差异,探讨肿瘤标志物对胃癌患者的诊断及其预后价值。现报告如下。
1 材料与方法
1.1 一般资料
收集本科2007年1月至2012年3月经手术及病理学确诊的胃癌患者198例,其中男性120例,女性78例,年龄31~78岁。胃癌TNM分期:Ⅰ期28例,Ⅱ期35例,Ⅲ期71例,Ⅳ期64例。同时选择本院体检后确认的健康体检者198例对照组,其中男性118例,女性80例,年龄25~79岁,无心、肝、肺等重要器官疾病。经统计学检验,病例组与对照组年龄、性别分布差异均无统计学意义。
1.2 方法
采用电化学发光法检测患者血清中的肿瘤标志物。测定仪器采用瑞士罗氏公司生产的ELECSY 2010全自动电化学发光仪;试剂均为配套的 CA199、CA724、CEA试剂。对照组患者于入院体检时,抽取空腹外周静脉血3 ml,分离出血清,于-80℃冰箱保存,用于检测。病例组患者分别于手术前、术后2周抽取外周静脉血3 ml,分离出血清,用于检测。
1.3 判定标准
CEA 正常值为0~5 μg/L,CA199 为0~39 U/ml,CA724 为 0~6 U/ml[3]。
1.4 统计学分析
采用 EpiData3.0进行数据的录入,采用 SPSS 13.0进行统计学分析。计量资料的描述性分析采用均数±标准差,计数资料的描述性分析采用百分数表示;率的比较采用卡方检验,计量资料的比较采用t检验和F检验。以P<0.05为差异有统计学意义。
2 结果
2.1 病例组与对照组3种肿瘤标志物检测结果比较
病例组术前各肿瘤标志物的水平均明显高于对照组,差异均有统计学意义。且病例组术后各肿瘤标志物水平较术前有明显下降,差异也均有统计学意义。见表1。
表1 病例组与对照组3种肿瘤标志物检测结果比较(±s)

表1 病例组与对照组3种肿瘤标志物检测结果比较(±s)
注:*为与对照组比较,P<0.05;△为与病例组术前比较,P<0.05。
组别 CEA(μg/L)t CA724(U/ml)t CA199(U/ml)t 2.3 ±1.4 2.5 ±2.1 14.3 ±3.9病例组术前 18.1 ±23.2* 9.546 48.3 ±61.2* 10.518 103.2 ±155.3* 8.968术后 3.9 ±6.4△ 5.808 2.9 ±9.9△ 8.049 36.9 ±85.9△对照组8.301
2.2 各肿瘤标志物水平与胃癌分期的关系
(Ⅲ+Ⅳ)期胃癌患者的肿瘤标志物水平均高于(Ⅰ+Ⅱ)期,且差异均有统计学意义。见表2。
表2 胃癌患者不同分期的肿瘤标志物水平(±s)
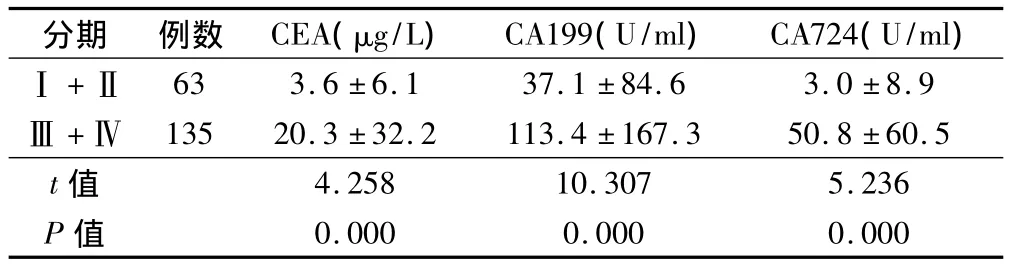
表2 胃癌患者不同分期的肿瘤标志物水平(±s)
分期例数 CEA(μg/L)CA199(U/ml)CA724(U/ml)Ⅰ+Ⅱ63 3.6 ±6.1 37.1 ±84.6 3.0 ±8.9Ⅲ +Ⅳ 135 20.3 ±32.2 113.4 ±167.3 50.8 ±60.5 t值4.258 10.307 5.236 P值0.000 0.000 0.000
2.3 各肿瘤标志物单项和联合检测的诊断价值
各肿瘤标志物单项检测的特异度均较高,而灵敏度却并不高。而联合检测时灵敏度显著提高,但特异度变化不大,正确率明显提高。同时行3项联合检测发现,其灵敏度达90.1%,正确率达86.8%。见表3。
2.4 各肿瘤标志物准确性与胃癌分期的关系
胃癌患者Ⅲ+Ⅳ期的单个肿瘤标志物及不同组合肿瘤标志物检测的阳性率均明显高于(Ⅰ+Ⅱ)期,差异均有统计学意义。见表4。
3 讨论
胃癌在我国有较高的发病率和死亡率[3]。在消化系统恶性肿瘤死亡病例中,约半数死于胃癌。

表3 肿瘤标志物检测结果诊断价值/%
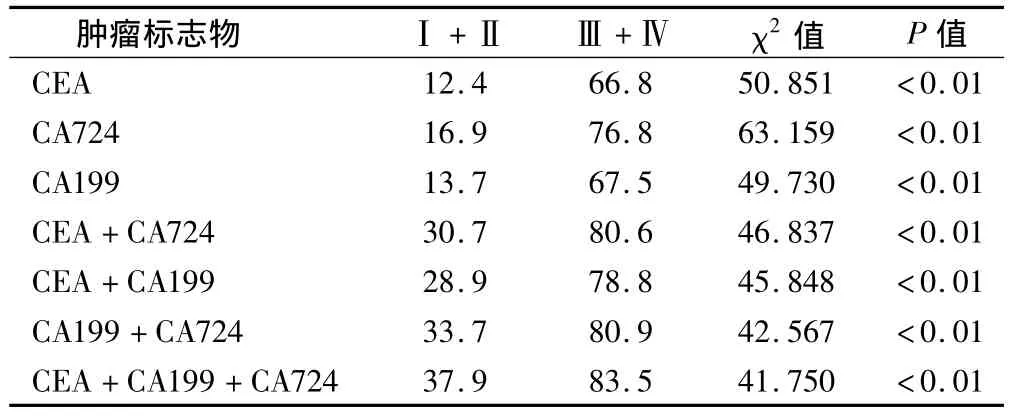
表4 各肿瘤标志物阳性率与胃癌分期的关系/%
胃癌疗效与病期早晚和诊治方法及手段密切相关。研究表明,早期胃癌经足够的治疗后90%以上患者能生存5年以上或治愈[4],而晚期胃癌患者,治疗后5年生存率不足5%。因此,早发现是改善疗效、提高生存率的关键。可惜我国胃癌患者在确诊时为早期者不到10%,日本约60%,差距相当大;主要因为日本坚持定期胃镜检查。而在中国,患者多因不适就诊,而胃癌患者大多数到了中晚期才有症状。由此可见,早发现、早诊断、早治疗是肿瘤预防与治疗的首选[3]。而关于肿瘤标志物的研究,临床上开展得较多,但是由于其灵敏度较低,尚不能准确地用于早期肿瘤的诊断。
肿瘤标志物是肿瘤生长过程中,由肿瘤细胞自身产生或有机体自身免疫反应产生,一般不存在于正常成人组织,而是仅存在于胚胎组织,通常在肿瘤组织中的含量会大大超过正常组织中的含量,是反映肿瘤生长与存在的一类物质,包括蛋白质、酶、多胺、激素等,通常在患者血液或是体液中能检测出[5]。CEA是1种多糖蛋白复合物,主要存在胎儿胃肠管道、肝脏及胰腺中,而出生后含量很低。有研究发现,消化道肿瘤患者的血清中CEA含量会异常增高,因此被作为消化道肿瘤中辅助诊断的常见肿瘤标志物[6]。本研究检测结果表明,胃癌患者的CEA在(Ⅲ+Ⅳ)期的阳性率为66.8%,低于相关研究结果[7]。CA199主要存在胎儿胃、肠等部位,成年期主要由消化道肿瘤细胞分泌,是由抗人结肠癌细胞株抗体116NS1919识别的高分子糖蛋白。本研究检测出CA199在胃癌患者(Ⅲ+Ⅳ)期的阳性率为 67.5%,与相关研究结果一致[8]。CA724也是1种高分子的糖蛋白,主要存在于胃部、胰腺、结肠、卵巢等部位的肿瘤中,其中诊断胃癌阳性率可达47%,且基本上不出现在良性肿瘤及健康人群中,是目前用于胃癌诊断的理想标志物[9]。本研究检测CA724在胃癌患者(Ⅲ+Ⅳ)期的阳性率为76.8%。
本研究显示,病例组术前血清肿瘤标志物CA724、CEA、CA199水平明显高于术后及对照组,差异均有统计学意义。三者对胃癌诊断的灵敏度分别为50.9%,51.3%,47.8%,特异度分别为 92.1%,91.4%,89.5%。对这3种肿瘤标志物两两组合,进行两项平行联合检测时发现,其灵敏度提高,特异度变化不明显,依旧维持较为理想水平。但是进行3项联合平行检测则显示灵敏度为90.1%,特异度为73.4%,与相关研究结果较为一致[9-10]。表明行3项联合检测对胃癌的辅助诊断有较好的临床价值。此外,血清肿瘤标志物CEA、CA199、CA724对胃癌分期及预后的评估也有一定的临床价值。本研究发现,胃癌患者(Ⅲ+Ⅳ)期的单个肿瘤标志物均明显高于(Ⅰ+Ⅱ)期,而不同组合肿瘤标志物检测的阳性率在不同胃癌分期中亦得出相同的结果,且差异均有统计学意义。同时(Ⅲ+Ⅳ)期胃癌患者的3种肿瘤标志物的检测水平均高于(Ⅰ+Ⅱ)期,差异均显著。与已有研究结果相一致[7-8]。
众多研究均表明,肿瘤标志物可用于肿瘤患者的辅助诊断及其对预后的评估[10]。但目前尚未发现能同时满足高灵敏度与特异度的肿瘤标志物[11-12]。结合本研究结果,我们建议,采用几种肿瘤标志物联合分析的方法,实施动态观察,可有效提高肿瘤的诊断率及临床预后评估,还可以有效避免单项肿瘤标志物检测的假阳性和假阴性,从而尽可能做到早发现、早诊断、早治疗,在一定程度上提高患者生存质量与生存率。
[1]徐汪松,王 丹.肿瘤标志物单项及联合检测对胃癌的诊断价值〔J〕.安徽医药,2013,17(3):470.
[2]仰丽丽,李积德,高 晟.MMP-2与EGFR在胃癌中的表达及其与生物学特征的关系〔J〕.实用癌症杂志,2010,25(4):344.
[3]刘 颖,林中倡,胡琼花,等.血清肿瘤标志物对胃癌诊断及预后判断的临床意义〔J〕.中国实验诊断学,2010,14(4):558.
[4]赵春明,郭 巍,赵岩峰,等.血清肿瘤标志物对胃癌的诊断和病情监测的价值〔J〕.检验医学与临床,2008,5(1):45.
[5]杜翠霞.血清肿瘤标志物检测对胃癌的诊断价值〔J〕.肿瘤基础与临床,2012,25(6):540.
[6]黄玉凯,周 进,徐 斌,等.联合检测CA19-9、CEA、AFP和Fer对消化道恶性肿瘤的诊断价值〔J〕.中国基层医药,2011,18(16):2203.
[7]张 婕,彭玉林,施振岗.胃癌患者肿瘤标志物检测的临床价值分析〔J〕.实验与检验医学,2011,29(3):281.
[8]邹 雄.肿瘤标志在肿瘤早期诊断中的研究与应用进展〔J〕.中华检验医学杂志,2002,25(2):71.
[9]李 明,刘顺英,李卫东,等.老年胃癌患者胃液中肿瘤标志物联合检测的临床意义〔J〕.实用癌症杂志,2006,21(5):471.
[10]王 秩.胃癌病程分期与血清CA724,CA242及CEA水平关系探讨〔J〕.放射免疫学杂志,2006,19(3):225.
[11]幸茂晖,陈 典.联合检测肿瘤标志物对胃癌进行早期诊断的临床研究〔J〕.河北医药,2011,33(2):193.
[12]李 璐.肿瘤标志物检测临床应用〔J〕.现代中西医结合杂志,2009,18(21):2604.

