秋水仙碱与人血清白蛋白相互作用的光谱学和电化学研究
佘 佩, 吴 琼, 曹文英, 吴军军
(湖北大学 化学化工学院, 湖北 武汉 430062)
从分子水平阐述蛋白质、核酸等生物大分子与具有生物活性的小分子间的相互作用特征是涉及化学、药学、生命科学等学科的交叉课题,人们一直尝试用各种物理和化学方法来获取这方面的信息,以探讨生命过程的规律. 目前,在研究药物小分子与生物大分子相互作用的各种方法中,光谱方法,尤其是荧光光谱和紫外光谱等方法因其灵敏度高、选择性强、样品用量少、操作方法简便以及能提供较多的物理参数等优点而得到了广泛的应用[1]. 近年来,电化学方法对小分子同蛋白质相互作用的研究也引起了人们的广泛兴趣.
秋水仙碱(colchicine,COLC,分子式为C22H25NO6)在临床上主要用作抗肿瘤药,可用于乳腺癌、皮肤癌、食道癌等的防治,也有研究表明秋水仙碱可用作肺炎、肝脏等疾病患者的镇定剂[2-3]. 血清白蛋白是血浆中含量最丰富的载体蛋白,可与许多内源性或外源性化合物结合[4-5]. 药物进入体内后,要通过血浆的贮存与运输,达到受体部位,进而发生药理作用. 因此,蛋白质与药物的相互作用不仅影响药物在体内的吸收、分布,而且还影响药物在体内的代谢与排泄方式等. 目前,有关秋水仙碱与牛血清白蛋白(BSA)相互作用的研究已有较多报道[6-9],而秋水仙碱与人血清白蛋白(HSA)相互作用的研究较少,且尚未见到用电化学方法研究秋水仙碱与HSA相互作用的相关文献.
为了更全面准确地把握药物与生物大分子的作用机制,往往需要同时采用多种现代实验技术或方法,更适时、原位地追踪小分子进入生命体内与生物大分子的相互作用,以获得更可靠的结果. 作者主要利用荧光光谱、紫外光谱等光谱学方法和循环伏安(CV)、差示脉冲伏安(DPV)等电化学方法,研究在近似生理条件下秋水仙碱与HSA的相互作用. 从分子水平探讨其作用机制,分析秋水仙碱对HSA二级结构的影响;研究秋水仙碱与HSA相互作用的电化学行为;并分别用光谱学和电化学方法测定相互作用的结合常数和结合位点数.
1 实验部分
1.1 试剂及溶液
秋水仙碱(Sigma),人血清白蛋白(Sigma). 实验试剂均为分析纯,实验用水为二次超纯水. 所有溶液均用pH=7.4的PBS缓冲溶液配制.
1.2 荧光光谱
用LS-55荧光分光光度计(美国PE公司),测定研究体系溶液的荧光光谱. 选定激发和发射狭缝均为15 nm, 以290 nm为激发波长,绘制研究体系的荧光发射光谱;固定Δλ=60 nm,记录秋水仙碱与HSA作用的同步荧光光谱.
1.3 紫外-可见吸收光谱
用Lambda-35紫外-可见分光光度计(美国PE公司),测定各溶液的吸收光谱. 波长范围450~190 nm.
1.4 电化学测量
电极处理:将工作电极(玻碳电极)先用0.05 μmγ-Al2O3抛光粉的悬糊液抛光成镜面,再依次在去离子水、无水乙醇、去离子水中各超声两次,每次清洗5 min;然后放入PBS溶液中,于-0.6 ~ 0.6 V电位下进行扫描极化处理,CV曲线平滑无峰,则说明电极无异物;接着放入1.0×10-3mol·L-1K3[Fe(CN)6] 和1.0mol·L-1KCl混合溶液中扫描CV图,当电极的氧化还原电位差小于70 mV时即可使用;最后将其放入0.5 mol·L-1H2SO4溶液中进行活化.
电化学测量:CHI 660a电化学工作站(上海辰华有限公司),三电极工作体系(玻碳电极为工作电极、饱和甘汞电极为参比电极、金电极为对电极),CV测量在pH=7.4的PBS缓冲溶液中进行,电位范围0.8 ~ 1.35 V,扫描速度0.1 V·s-1;在相同的电位范围对秋水仙碱与HSA反应体系进行DPV测定.
2 结果与讨论
2.1 秋水仙碱与HSA相互作用的荧光光谱及猝灭机理
蛋白质的荧光主要来自色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)等能产生荧光的氨基酸基团,这三种氨基酸的荧光强度比大约为100∶9∶0.5,因此通常情况下可以认为蛋白质的荧光主要来自Trp残基的贡献,通过检测加入秋水仙碱前后HSA的内源荧光变化情况来表征药物与HSA的结合关系. 而蛋白质分子的荧光光谱会随溶剂极性变化而发生红移或蓝移,因此根据这一规律可以推断氨基酸残基所处环境及蛋白质结构变化等信息[10].
为了突出血清白蛋白的荧光来自色氨酸残基的贡献而降低酪氨酸和苯丙氨酸残基的影响,作者利用HSA分子中色氨酸残基的内源荧光,以λex=290 nm激发,在340 nm附近有很强的荧光峰;而以同样激发波长激发秋水仙碱溶液时,在340 nm附近则没有荧光峰,表明秋水仙碱不会产生与HSA相互干扰的荧光. 固定HSA的浓度为2.0 μmol·L-1,随着体系中秋水仙碱浓度的增加,HSA的内源荧光产生有规律的猝灭(图1). 从图1可以看出,随着秋水仙碱的加入及其浓度增大,其荧光强度降低,且伴随着最大发射波长明显的蓝移(最大发射波长从343 nm蓝移到322 nm),表明HSA与秋水仙碱的作用使其发色团微环境发生了变化,即色氨酸残基所处环境极性减弱,疏水性增强.
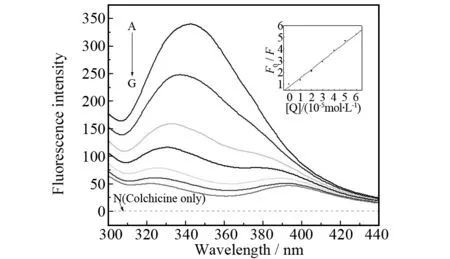
c(HSA) = 2.0 μmol·L-1; c(COLC)/(10-5 mol·L-1), A-G: 0, 1.0, 2.0, 3.0, 4.0, 5.0, 6.0.; curve N shows the emission spectrum of colchicine only, c(COLC)= 1.0×10-5 mol·L-1. The inset corresponds to the Stern-Volmer plot图1 秋水仙碱浓度对HSA荧光发射光谱的影响Fig.1 Emission spectra of HSA in the presence of various concentrations of colchicine
荧光猝灭过程分为动态猝灭、静态猝灭、混合猝灭等,为了研究和讨论的方便,通常将其分为动态猝灭和静态猝灭. 动态猝灭是猝灭剂和荧光物质的激发态分子之间的相互作用过程,主要依赖于分子扩散;静态猝灭是猝灭剂和荧光物质分子在基态时生成不发荧光的配合物,从而导致荧光物质荧光强度降低的过程. 无论是动态猝灭还是静态猝灭,其过程均遵循Stern-Volmer方程[11]:
τ0[Q]=1+KSV[Q]
(1)
式中F0和F分别表示不存在和存在猝灭剂时荧光物质的荧光强度,[Q]为猝灭剂的浓度,kq是生物大分子的猝灭速率常数,τ0(10-8s) 是无猝灭剂时荧光分子的平均寿命,KSV是Stern-Volmer猝灭常数. 根据荧光实验数据,以F0/F对相应的[Q]作图,得到秋水仙碱对HSA猝灭的Stern-Volmer曲线(图1插图),由直线斜率求出KSV= 7.56×104L·mol-1,kq= 7.56×1012L·mol-1·s-1.kq的值比各类荧光猝灭剂对生物大分子的最大动态荧光猝灭速率常数(2.0×1010L·mol-1·s-1)[12]大得多,所以猝灭过程不是动态猝灭过程,而是秋水仙碱和HSA形成了复合物的静态猝灭过程.
由于动态猝灭只涉及荧光分子的激发态,因而猝灭剂对荧光物质的吸收光谱一般不产生影响;而基态配合物的生成往往会导致荧光物质吸收光谱的改变[13]. 为了进一步验证秋水仙碱对HSA的静态猝灭机理,实验考查了HSA与秋水仙碱作用的紫外吸收光谱.
图2为室温条件下2.0 μmol·L-1的秋水仙碱溶液的紫外吸收(曲线A)、2.0 μmol·L-1的HSA溶液的紫外吸收(曲线B)以及秋水仙碱与HSA的物质的量之比为1∶1的混合物与秋水仙碱的紫外吸收差谱(曲线C). 从图2可以看出,B和C两曲线有明显差别,表明秋水仙碱的加入使HSA的紫外吸收发生了变化,秋水仙碱对HSA的荧光猝灭是它与HSA生成基态配合物的结果。进一步推断秋水仙碱-HSA体系的荧光猝灭为静态猝灭机制.
2.2 秋水仙碱对HSA二级结构的影响
同步荧光光谱因具有谱图简化(减少谱图重叠)、谱带变窄、光散射干扰减少等优点而常被用来分析药物对蛋白质分子构象的影响[14]. 通过选择合适的波长差,可将在普通荧光光谱上相互重叠的不同发色团产生的荧光峰分开,如固定Δλ=60 nm和Δλ=15 nm所作出的同步荧光光谱分别表现出色氨酸残基和酪氨酸残基的光谱特征[15]. 因氨基酸残基的最大吸收波长与其所处环境的极性有关,因此,由最大发射波长产生的位移情况,可判断蛋白质构象的变化. 发射波长红移表明氨基酸残基所处环境的极性增加(疏水性逐渐降低),蓝移则疏水性增加. 因色氨酸的最大荧光发射峰位对环境很敏感,通常作色氨酸残基的同步荧光光谱,以此作为定性判断蛋白质构象变化的依据.
固定HSA的浓度,逐渐增大秋水仙碱的浓度,记录Δλ=60 nm时的同步荧光光谱(图3).由图3可见,HSA-秋水仙碱体系的同步荧光光谱发生蓝移(从279 nm位移至276 nm). 表明秋水仙碱的加入使HSA的构象发生了一定的变化,色氨酸残基所处环境的疏水性有所增强,HSA内部的疏水结构趋于稳定.
2.3 秋水仙碱的电化学行为
秋水仙碱是一种电活性物质,在玻碳电极上的循环伏安(CV)扫描图见图4,阳极扫描有一个氧化峰,阴极扫描无峰,说明秋水仙碱在玻碳电极上的氧化是不可逆的. 其峰的位置随着底液不同而移动;改变电位扫描速度,观察扫描速度对氧化峰的峰电流的影响,发现峰电流与扫速的一次方呈良好的线性关系. 由此可知,秋水仙碱在玻碳电极上的电化学反应是受吸附控制的[16].
采用测定灵敏度高,分辨率好的差示脉冲伏安法(DPV)对体系进行研究和测定.富集时间从0 s变化到160 s,发现秋水仙碱的氧化峰电流基本保持不变,说明富集时间对秋水仙碱在玻碳电极上的氧化峰电流没有影响,为了节约反应时间,我们选择10 s为本实验的富集时间. 富集电位在1.1 ~ -0.2 V变化时,秋水仙碱的氧化峰电流在0.9 V时最大,因此我们选择0.9 V为本实验的富集电位.
选定实验条件下,氧化峰峰电流与秋水仙碱的浓度在1.2×10-5~ 8.1×10-4mol·L-1范围内呈良好的线性关系)(图5),线性回归方程为:ipa/A =1.62×10-7+ 0.12c(COLC)/(mol·L-1),R=0.996 0.

c(HSA) = c(COLC) = 2.0 μmol·L-1图2 秋水仙碱对HSA吸收光谱的影响Fig.2 Absorption spectra of colchicines-HSA system

c(HSA) = 2.0 μmol·L-1; c(COLC)/(10-5 mol·L-1), A-G: 0, 1.0, 2.0, 3.0, 4.0, 5.0, 6.0图3 秋水仙碱与HSA作用的同步荧光光谱Fig.3 Synchronous fluorescence spectra of HSA in the presence of colchicine

c(COLC) = 1.0×10-4 mol·L-1; v=0.1 V·s-1图4 秋水仙碱的CV图Fig.4 Voltammogram of COLC

c(COLC)/(10-4 mol·L-1), A-I: 0.12, 0.32, 0.62, 1.1, 2.4, 3.2, 5.2, 6.6, 8.1. Inset: plots of the oxidative current and concentration of COLC图5 不同浓度秋水仙碱的DPV图Fig.5 DPV of COLC at different concentrations
2.4 秋水仙碱与HSA相互作用的差示脉冲伏安研究
我们用差示脉冲伏安法对秋水仙碱与HSA二者的反应体系进行了电化学研究. 在pH=7.4的PBS缓冲溶液中加入适量的HSA,在0.95~1.26 V范围内对其进行DPV扫描,无峰出现,与在底液中扫描的基线基本重合,而秋水仙碱在此浓度范围内有一灵敏的氧化峰,峰电位为1.18 V(vs. SCE). 当将HSA加入到秋水仙碱溶液中后,秋水仙碱的氧化峰电流减弱,峰电位正移(图6),这是由于秋水仙碱与HSA相互作用,生成了秋水仙碱-HSA非电活性化合物,二者结合使得游离的秋水仙碱浓度降低,从而导致峰电流降低[17].
2.5 秋水仙碱与HSA相互作用的结合常数和结合位点数
对于静态猝灭,其荧光猝灭数据可用修正的Stern-Volmer方程进行处理[18]:
(2)
式中ΔF为加入猝灭剂前后荧光强度的变化,fa为蛋白质(荧光基团)可接近猝灭剂的部分(分数);Ka为有效猝灭常数,可用作结合常数. 以F0/ΔF对1/[Q]作图,即可求得蛋白质与秋水仙碱的结合常数Ka. 直线拟合方程为:F0/ΔF=2.98×10-5/[Q]+0.605,R=0.991 0. 由此求得秋水仙碱与HSA的结合常数为Ka=2.03×104L·mol-1. 秋水仙碱与HSA的结合常数较大,说明秋水仙碱与血清白蛋白有强的结合,可以通过HSA携带而在体内储存和运输从而通过血液循环达到作用部位,发挥效果.
假设生物大分子的若干个结合位点是独立且相同的,根据小分子与大分子的配位方程[19]:
(3)
式中Kb与n分别是表观结合常数与结合位点数. 根据(3)式,以lg((F0-F)/F) 对lg[Q]作图,由直线斜率求出秋水仙碱与HSA的结合位点数n=1.31. 秋水仙碱与HSA作用的结合位点数约为1,表明它们之间可以形成一个强结合位点.
为了证实光谱法所得结果,在优化条件下,用差示脉冲伏安法测定了秋水仙碱与HSA作用体系的结合常数和结合位点数. 假定秋水仙碱与HSA结合形成一种简单的化合物HSA-nCOLC,即

其中ΔI表示加入HSA前后秋水仙碱峰电流的差值,ΔImax表示的是峰电流的最大差值,n是结合位点数. 图7为HSA浓度固定为2.0 μmol·L-1时,改变秋水仙碱的浓度所得的氧化峰电流曲线.

c(COLC) = 1.0×10-4 mol·L-1;c(HSA), A-D: 0, 1.0, 2.0, 3.0 μmol·L-1图6 秋水仙碱与HSA反应的DPV图Fig.6 DPV of COLC-HSA reaction system
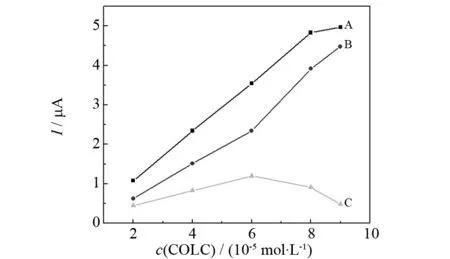
A: The current of COLC in the absence of HSA; B: the current of COLC in the presence of HSA; C: the difference between A and B图7 氧化峰电流与秋水仙碱浓度的关系Fig.7 Plots of the oxidation peak current versus c(COLC)
结论:用荧光光谱、紫外吸收光谱和电化学方法研究在近似生理条件下秋水仙碱与人血清白蛋白(HSA)的相互作用. 研究表明,秋水仙碱与HSA的结合主要是两者形成基态复合物的静态猝灭过程,秋水仙碱的加入使HSA的构象发生变化,色氨酸残基所处环境的疏水性有所增强. 在pH=7.4的PBS缓冲溶液中,秋水仙碱在玻碳电极上产生一不可逆的氧化峰,峰电位在1.18 V(vs. SCE). 加入HSA后秋水仙碱的氧化峰电位正移,峰电流下降. 用光谱学和电化学方法测定秋水仙碱与HSA相互作用的结合常数及结合位点数分别为:K=2.03×104L·mol-1,n=1.31和K=1.95×104L·mol-1,n=1.20. 说明秋水仙碱与HSA之间有较强结合,秋水仙碱可以通过HSA携带而在体内储存和运输从而通过血液循环达到作用部位,发挥效果.
参考文献:
[1] GUO Qing Lian, LI Ran, JIANG Feng Lei, et al. Characterization of the interactions between intraconazole and human and bovine serum albumins by a spectroscopic method [J]. Acta Phys Chim Sin, 2009, 25(10):2147-2154.
[2] BANERJEE M, PODDAR A, MITRA G, et al. Sulfonamide drugs binding to the colchicine site of tubulin: thermodynamic analysis of the drug-tubulin interactions by isothermal titration calorimetry [J]. J Med Chem, 2005, 48:547-555.
[3] DUDKIEWICZ I, COHEN I, HOROWITZ S, et al. Colchicine inhibits heterotopic ossification: experimental study in rabbits [J]. Isr Med Assoc J, 2005, 7:31-34.
[4] RAN De Huan, WU Xia, ZHENG Jin Hua, et al. Study on the interaction between florasulam and bovine serum albumin [J]. J Fluoresc, 2007, 17:721-726.
[5] CUI Feng Ling, WANG Jun Li, CUI Yan Rui, et al. Fluorescent investigation of the interactions between N-(p-chlorophenyl)-N-(1-naphthyl) thiourea and serum albumin: synchronous fluorescence determination of serum albumin [J]. Anal Chim Acta, 2006, 571:175-183.
[6] ZHANG Xiu Hua, WANG Shi Min, LI Jia, et al. Electrochemical properties of colchicine on the PoPD/SWNTs composite-modified glassy carbon electrode [J]. Sens Actuators B, 2008, 134(2):477-482.
[7] 刘永明, 李桂枝, 孙希芬. 荧光法研究秋水仙碱和牛血清白蛋白的相互结合作用[J]. 分析化学, 2004, 32(5):615-618.
[8] WEN Wei, TAN Yu Mei, XIONG Hua Yu, et al. Voltammetric and spectroscopic investigations of the interaction between colchicine and bovine serum albumin [J]. Int J Electrochem Sci, 2010, 5:232-241.
[9] HU Yan Jun, LIU Yi, ZHANG Li Xia, et al. Studies of interaction between colchicine and bovine serum albumin by fluorescence quenching method [J]. J Mol Struct, 2005, 750:174-178.
[10] HE Xiao Min, CARTER D C. Atomic structure and chemistry of human serum albumin [J]. Nature, 1992, 358:209-215.
[11] LAKOWICZ J R. Principles of fluorescence spectroscopy [M]. New York: Plenum Press, 1999: 237-265.
[12] 颜承农,上官云凤,潘祖亭,等. 吡罗昔康与蛋白质作用特征的热力学研究[J]. 分析化学, 2004, 32(3):317-320.
[13] WU Qiong, JIANG Feng Lei, LI Chao Hong, et al. Interaction of caffeine with bovine serum albumin: determination of binding constants and the binding site by spectroscopic methods [J]. Chin J Chem, 2011, 29:433-440.
[14] 许金钩,王尊本. 荧光光谱法(第三版)[M]. 北京: 科学出版社, 2006: 64-69.
[15] MILLER J N. Recent advances in molecular luminescence analysis [J]. Proc Anal Div Chem Soc, 1979, 16:203-208.
[16] 冶保献, 木合塔尔·吐尔洪, 张宗培,等. 秋水仙碱的电化学性质及电分析方法研究[J]. 分析科学学报, 2004, 20(5):458-460.
[17] 曹福悦,任凤莲,宋 鸽,等. 秋水仙碱与牛血清白蛋白相互作用的电化学研究[J]. 分析实验室, 2012, 31(6): 92-95.
[18] LEHRER S S. The quenching of the tryptophyl fluorescence of model compounds and of lysozyme by iodide ion [J]. Biochemistry, 1971, 10:3254-3263.
[19] HAN Xiao Le, TIAN Fang Fang, GE Yu Shu, et al. Spectroscopic, structural and thermodynamic properties of chlorpyrifos bound to serum albumin: a comparative study between BSA and HAS [J]. J Photochem Photobiol B: Biol, 2012, 109:1-11.
[20] FENG Qu, LI Nan Qiang, JIANG Yu Yang. Electrochemical studies of porphyrin interacting with DNA and determination of DNA [J]. Anal Chim Acta, 1997, 344:97-104.

