PAT酶长期胁迫下小鼠遗传多态性的变化
刘 金,黄 毅,孙艳波,颜亨梅
(1.北京师范大学珠海分校不动产学院,中国 珠海 519087;2.湖南师范大学生命科学学院,中国 长沙 410081)
水稻是我国乃至全世界的主要粮食作物,其安全性尤为重要.转基因水稻是利用转基因技术把目的基因转入到水稻中,使水稻具有新的性状,如抗虫、抗除草剂、抗病害等.但转基因水稻的安全性在没有经过长期评估之前,其食用安全性仍存在很大争议.迄今为止,国内外对转基因稻谷所做安全性评价研究主要集中在:李英华等[1]、HAN等[2]、Oberdoerfer等[3]、韩军花等[4]和Cromwell等[5]分别进行了实质等同性分析,LI 等[6]、Momma等[7]、陈小萍等[8]和杨月欣等[9]开展了营养学评价,WANG等[10]、王茵等[11]、Herouet等[12]、王忠华等[13]和李英华等[14]分别进行了毒理学评价,Momma等[7]、Tada等[15]和孙艳波等[16]做了致敏性研究,以及李英华等[17]、卓勤等[18]、王忠华等[19]分别进行了致畸作用研究.而转基因稻谷对小鼠的遗传多态性影响的研究鲜有报道.考虑到肝脏和小肠分别是机体主要的解毒和消化器官,本研究以饲喂转Bar基因抗除草剂稻谷子二代(F2)小鼠肝脏和小肠为样品,进行遗传多态性变化研究,为转基因稻谷的安全性评价提供参考.
1 材料与方法
1.1 材料
1.1.1 稻谷 转Bar基因抗除草剂稻谷香125S/Bar68-1(简称Bar68-1) [生产许可证号:农基安审字(2006)第060号]及其亲本——非转基因稻谷香125S/D68(简称D68),均由中国科学院亚热带农业生态研究所生产提供.
1.1.2 饲料 常规基础饲料[生产许可证号:SCXK(湘)2009-0009],购自湖南斯莱克景达实验动物有限公司.将稻谷、常规基础饲料和鱼粉按一定比例混合(见表1)后送到中南大学动物饲料厂粉碎压成根状,即成小鼠日粮(配合饲料).其中每千克预混料含有:VA 3.3 mg,VD 70 μg, VE 45 mg,VK 1.60 mg,VB12.4 mg,VB26.5 mg,VB63.6 mg,VB1238 μg,烟酸92 mg,叶酸0.85 mg,泛酸31 mg,生物素115μg,胆碱285 mg,Fe 170 mg,Cu 240 mg,Mn 50 mg,Zn 160 mg,I 1.4 mg,Se 0.4 mg.各组饲料的蛋白质、脂肪测定结果均符合小鼠生长的营养要求[20](w(蛋白质)≥18%,w(脂肪)≥3%).
1.1.3 实验动物 6周龄、体重18~22 g的SPF级昆明小鼠(Musmusculus)200只,购自湖南斯莱克景达实验动物有限公司(生产许可证编号:SCXK(湘)2009-0004).小鼠按编号随机分成5组,每组4个重复,每个重复10只小鼠,雌雄各半.5个组的日粮组成和营养水平仅稻谷含量有差异.实验设计见表2.
实验前给予小鼠常规基础饲料[生产许可证编号:SCXK(湘)2009-0009]适用3~5 d.各组小鼠分别供应充足的饲料和水,保持鼠房的空气流通和适当的温度、湿度(温度22~25 ℃,湿度50%~60%,动物照度15 ~20 lx).亲代小鼠饲养90 d后开始繁殖子一代(F1),以此类推,一直持续到子二代(F2).每代小鼠饲养180 d后,分别在2组(Z2组)和4组(C2组)中每次按编号随机抓取F2代小鼠6只,雌雄各半.试验重复3次.
采用小鼠肝脏的和肠的样品进行分析,其中,肝脏样品和肠样品各12份,6份取自常规稻谷(非转基因稻谷)喂养的小鼠,6份取自转基因稻谷喂养的小鼠(见表3).

表1 日粮原料及成分质量分数(干重)/%

表2 实验设计
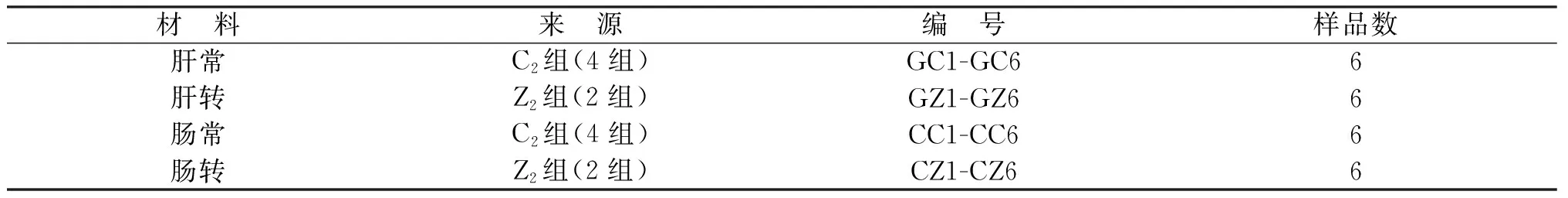
表3 用于AFLP分析的小鼠材料
1.2 仪器设备
超纯水系统:PL 5124 Purelab Plus UV/UF PALL;高速冷冻离心机:D-78532 Tuttlingen, hettich zentrifugen, Mikro 22R;PCR仪:T-Gradient Thermoblock, Biometra;超低温冰箱:U410 Ultra low temperature freezer, Premium;高温灭菌锅:HVE-50, HIRAYAMA;凝胶成像系统:Gel Doc 1000 Single, Wavelength Mini-Transilluminator,BIO-RAD, Hercules, CA, USA.
1.3 试剂
AFLP引物:上海捷瑞生物工程有限公司合成.EcoRI接头: 5′-CTCGTAGACTGCGTACC-3′, 5′-AATTGGTACGCAGTCTAC-3′.MseI接头: 5′-GACGATGAGTCCTGAG-3′,5′-TACTCAGGACTCAT-3′ .预扩增引物: E+A 5′-GACTGCGTACCAATTCA-3′, M+C 5′-GATGAGTCCTGAGTAAC-3′.选择性扩增引物共10条,为E-AGC、M-CAG、E-ACG、M-CTG、E-ACC、M-CTC、E-ACT、M-CTT、E-ACA、M-CGA(E=GACTGCGTACCAATTC;M=GATGAGTCCTGAGTAA). Taq DNA Polymerase,MseⅠ,EcoRⅠ, T4 Ligase, 100 bp ladder, dNTP,动物DNA快速提取试剂盒购自天根生化科技(北京)有限公司;琼脂糖为BIOWEST AGAROSE,其他试剂均为国产分析纯.变性上样缓冲液质量分数: 99%甲酰胺、0.25%二甲苯青、0.25%溴酚蓝和10 mmol/L EDTA.
1.4 AFLP分析方法
1.4.1 小鼠基因组DNA的提取 使用天根生化科技(北京)有限公司的动物血液组织DNA快速提取试剂盒提取基因组DNA,并用100 μL TE洗脱,-20 ℃保存样品.
1.4.2 双酶切 用MseⅠ和EcoRⅠ限制性内切酶酶切基因组DNA.体系为:10×PCR Tango 2.5 μL; DNA模板(50 mg/L) 5.0 μL;EcoRⅠ(166.7 mkat/L,即107U/L) 0.5 μL, 灭菌蒸馏水 17.0 μL; 总体积 25 μL.反应程序为:37 ℃ 2 h, 70 ℃ 30 min, 16 ℃ 10 min; 反应完成后再加入 0.5 μLMseⅠ(166.7 mkat/L,即107U/L),65 ℃ 酶切2 h,然后 80 ℃ 变性30 min, 16 ℃降温10 min; 酶切产物 -20 ℃保存.
1.4.3 连接反应 反应体系为10×T4 buffer 2.5 μL, DNA酶切产物10 μL, T4 Ligase(50 mkat/L,即3×106U/L)1.0 μL,EcoRⅠ接头(10 μmol/L) 2 μL,MseⅠ接头(10 μmol/L) 2 μL, Sterile deionized water 7.5 μL,总体积为25 μL.于16 ℃温度下过夜.
1.4.4 预扩增 考察模板用量,对连接产物进行稀释,分别稀释200倍,10倍,4倍和1倍(原液).预扩增体系为:10×PCR buffer (含20 mmol/L Mg2+) 2.5 μL, dNTP (10 mmol/L) 0.5 μL, DNA连接产物 2.0 μL,EcoRⅠ+A(10 μmol/L) 1 μL,MseⅠ+C(10 μmol/L) 1 μL, Taq DNA Polymerase(41.67 mkat/L,即2.5×106U/L) 0.5 μL, 灭菌蒸馏水17.5 μL, 总体积 25 μL.反应程序设为:94 ℃ 预变性3 min,94 ℃ 变性30 s, 56 ℃ 复性1 min, 72 ℃ 延伸1 min.经过20个循环后,72 ℃延伸8 min, 16 ℃保存备用.
1.4.5 选择性扩增 对所合成的10条选择性引物(MseⅠ5条,EcoRⅠ5条)共25种组合进行了筛选,选择其中扩增效果较好的引物用于AFLP分析.
对预扩增产物进行稀释,分别为200倍、10倍、4倍和1倍(原液),作为选择扩增反应的模板,用量为 2 μL, 引物为选择性引物各1 μL,10×PCR buffer (含20 mmol/L Mg2+) 2.5 μL, dNTP (10 mmol/L) 0.5 μL, Taq DNA Polymerase(41.67 mkat/L) 0.5 μL, 灭菌蒸馏水17.5 μL, 总体积 25 μL.PCR反应的程序为: 94 ℃预变性3 min;94 ℃变性30 s, 65 ℃复性30 s, 72 ℃延伸1 min(共13个循环,每个循环退火温度降低0.7 ℃);94 ℃变性30 s, 56 ℃复性30 s, 72 ℃延伸1 min(共23个循环);72 ℃延伸8 min, 16 ℃保存备用.
1.4.6 聚丙烯酰胺电泳及显影观察
(1)电泳分析 在PCR扩增产物中加入25 μL 的变性上样缓冲液,然后于90 ℃变性5 min,置于冰上冷却,4 ℃温度下保存产物.配制质量分数为8%聚丙烯酰胺凝胶,室温下凝结1.5 h,然后进行梯度电泳,电泳槽的负极(上槽)加入0.5×TBE电泳缓冲液,下槽用1倍体积 3 mol/L的醋酸钠溶液和2倍体积的1×TBE缓冲液.上样量为5 μL,并用200 ladder marker做参照.电压250 V,电泳2.0 h后进行银染.
(2)银染 参考Heckel[21]银染方法,将凝胶从胶板取下,用去离子水冲洗,放入10%(体积分数)的乙醇溶液中固定后用去离子水洗涤一遍,然后用0.2%(质量分数)的AgNO3溶液银染,之后用去离子水洗涤2次,最后用显影液显影.待条带清晰后用蒸馏水洗涤一遍,放入Na2CO3溶液中,最后对显色后的胶块拍照保存.
(3)银染结果分析 用选择的引物对所有样品进行扩增,获得扩增的多态图谱,记录凝胶图谱上100~1 500 bp DNA条带的有或无,条带清晰可辨的记为“1”,缺失或模糊不清的记为“0”,将观察的结果以Excel形式输入计算机,用 NTSYS-pc 2.1软件进行数据分析,得到聚类结果.
2 结果与分析
2.1 引物筛选
对AFLP的引物组合进行选择,10条引物共有25种配对组合方法,用25对引物分别扩增肝和肠样品,扩增的PCR产物进行聚丙烯酰胺凝胶电泳(见图1).从电泳图谱可看到,大部分引物都能扩增出带型明晰、分布均匀的条带,从中选择了6对引物组合用于小鼠遗传背景的研究(见表4).

表4 小鼠多态分析的AFLP引物
2.2 AFLP电泳结果
采用聚丙烯酰胺凝胶电泳分析,精确度高,可检测到AFLP扩增条带的微小差异,更有利于小鼠遗传差异的探讨.通过聚丙烯酰胺凝胶电泳对各扩增产物的分析,得到了较清晰的多态性图谱.其中第1对引物(E-AGC + M-CAG)、第4对引物(E-ACG+ M-CGA)扩增的结果分别见图2、图3.从电泳结果可知,各样品扩增的主要条带都没有明显差异,多态性条带很少,但也存在具有差异的弱带,这可能是实验条件和误差造成的.总体来说,小鼠的遗传背景差异小.
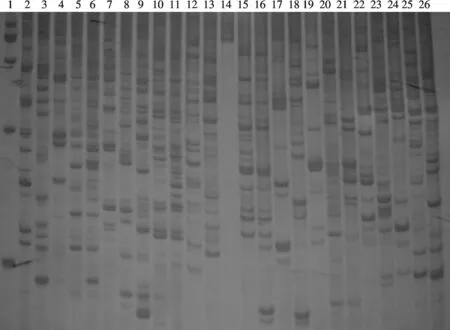
图1 AFLP引物筛选聚丙烯酰胺电泳结果
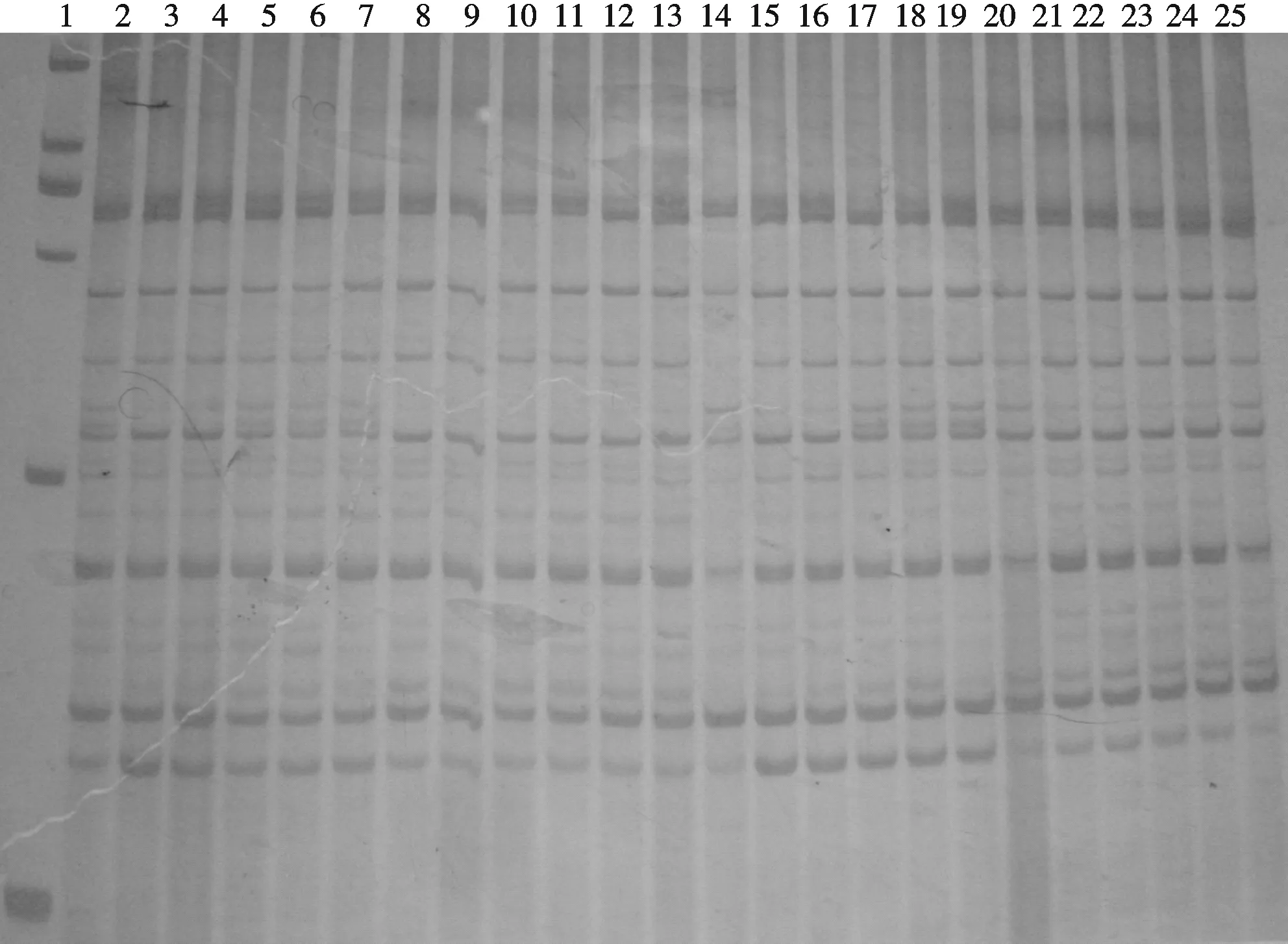
图2 第1对引物(E-AGC + M-CAG)扩增小鼠样品的效果
2.3 聚类分析
为了更好地分析小鼠的遗传背景特征,对聚丙烯酰胺凝胶电泳图谱进行条带统计,共统计到108条清晰条带,其中多态性条带数仅为28条,多态率为25.9%.用NTSYS-pc 2.1 软件进行聚类分析,得到的聚类结果见图4.
从聚类图看,各样品聚类的趋势不是很明显.第9号样品在相似系数为0.13时与其他样品聚集,与其他样品差别较大;7、8号样品与12号样品在相似系数约为0.09时,聚集为一支;除10、11号样品外,Z2组肝脏样品(7~12号)与其他样品在较大相似系数时聚集.C2组肝脏样品(1~6号)和17、10、11号样品聚集为一支,相似系数为0.06左右.小肠各样品聚集在0.07到0.11的相似系数之间.

图3 第4对引物(E-ACG+ M-CGA)扩增小鼠样品的效果
由实验结果可知,小鼠的遗传背景总体差异比较小,但肝脏和小肠之间存在微小差异,Z2组肝脏样品和C2组肝脏样品也有微小差异.
3 讨论
分子标记是能反映生物个体或种群间基因组中具有某种差异特征的DNA片段,它直接体现基因组DNA之间存在的差异.几十年来,DNA分子标记技术取得了很大的发展和进步.第二代分子标记技术扩增片段长度多态性(Amplified fragment length polymorphism, AFLP)是在随机扩增多态性(Random Amplified Polymorphic DNA, RPAD)和限制性片段长度多态性(Restriction Fragment Length Polymorphism, RFLP)2种技术结合发展起来的DNA多态性检测技术,兼有简便、快捷和重复性高的特点.与PCR相结合,AFLP技术能同时检测很多数量的多态位点和多态性标记.1995年由Zabeau 和Vos[22]发明以后,该技术在动物学、植物学和微生物学研究中得到了广泛的应用.
多态性(Polymorphism)是指一个生物群体中,同时存在2种以上的不连续的基因型或等位基因,也称为遗传多态性或基因多态性.从本质上讲,多态性的产生来源于基因水平上的变异,一般发生在基因序列中不编码蛋白的区域或没有重要调节功能的部分.
转Bar基因抗除草剂稻谷的外源基因——Bar基因的表达产物为膦丝菌素乙酰转移酶(phosphinthricin acetyl transferase, PAT).PAT酶能使除草剂中草丁膦的有效成分膦丝菌素(phosphinothricin, PPT)的自由氨基乙酰化,不能抑制谷氨酰胺合成酶(glutamine synthetase,GS)活性,从而赋予转基因作物对除草剂的抵抗力,使草丁膦对作物失去活性[23].PAT作为Bar基因的表达产物和稻谷的外源成分,在转Bar基因抗除草剂稻谷中具有一定的含量.小鼠消化系统在长期受PAT胁迫下,是否发生DNA多态性变化,正是作者研究的主要问题.因而,本研究选取消化系统的两个重要器官肝脏和小肠为样品进行了试验.结果显示,F2代C2组与Z2组各样品比较,扩增的主要条带都没有明显差异,多态条带数量很少,多态率仅为25.9%;依聚类图分析,Z2组肝脏和小肠样品和C2组肝脏和小肠样品有微小差异,但差异不明显.可见PAT对小鼠肝脏和小肠的DNA多态性没有明显影响.究其原因,作者认为可能与以下原因有关:(1)PAT在小鼠消化道中会被消化液消化、降解,失去活性;(2)转Bar基因稻谷中的PAT含量太低,不足以产生明显的效应.具体原因有待于进一步研究.
致谢:感谢中国科学院亚热带农业生态研究所唐香山博士和湖南师范大学生命科学学院研究生廖四芳等同学给予大力帮助.
参考文献:
[1] 李英华, 朴建华, 陈小萍, 等. Xa21转基因大米的营养学评价[J]. 卫生研究, 2004,33(3):303-306.
[2] HAN J, YANG Y, CHEN S,etal. Comparison of nutrient composition of parental rice and rice genetically modified with cowpea trysin inhibitor in China[J]. J Food Compos Anal, 2005,18(4):297-302.
[3] OBERDOERFER R B, SHILLITO R D, BEUCKELEER M D,etal. Rice (OryzasativaL.) containing thebargene is compositionally equivalent to the nontransgenic counterpart[J]. J Agric Food Chem, 2005,53(5):1457-1465.
[4] 韩军花, 杨月欣, 陈淑蓉, 等. 转SCK基因大米对小型猪生长发育的影响[J]. 中国食品卫生杂志, 2004,16(6):489-493.
[5] CROMWELL G L, HENRY B J, SCOTT A L,etal. Glufosinate herbicide-tolerant(Liberty Link) rice vs. conventional rice indiets for growing-finishing swine[J]. J Anim Sci, 2005,83(5):1068-1074.
[6] LI X, HUANG K, HE X,etal. Comparison of nutritional quality between Chineseindicarice withsckandcry1Acgenes and its nontransgenic counterpart[J]. J Food Sci, 2007,72(6):420-424.
[7] MOMMA K, HASHIMOTO W, OZAWA S,etal. Quality and safety evaluation of genetically engineered rice with soybean glycinin: Analyses of the grain composition and digestibility of glycinin in transgenic rice[J]. Biosci Biotechnol Biochem, 1999,63(2):314-318.
[8] 陈小萍, 卓 勤, 顾履珍, 等. 转基因大米营养评价试验[J]. 营养学报, 2004,26(2):119-123.
[9] 杨月欣, 陈淑蓉, 韩军花, 等. 转SCK基因大米的营养学评价——小型猪比较喂养研究[J]. 营养学报, 2005,27(1):38-45.
[10] WANG Z H, WANG Y, CUI H R,etal. Toxicological evaluation of transgenic rice flour with a synthetic cry1Ab gene from Bacillus thuringiensis[J]. J Sci Food Agric, 2002,82(7):738-744.
[11] 王 茵, 莱伟旗, 陈建国, 等. 抗除草剂基因(BAR)转基因水稻的毒性试验[J]. 卫生研究, 2000,29(3):141-142.
[12] HEROUET C, ESDAILE D J, MALLYON BA. Safety evaluation of the phosphinothricin acetyltransferase proteins encoded by the pat andbarsequences that confer tolerance to glufosinate-ammonium herbicide in transgenic plants[J]. Regul Toxicol Pharmacol, 2005,41(2):134-149.
[13] 王忠华, 王 茵, 崔海瑞, 等. Bt水稻“克螟稻”稻米毒理性评价研究初报[J]. 中国农业科学, 2002,35(12):1487-1492.
[14] 李英华, 朴建华, 卓 勤, 等. Xa21转基因大米亚慢性毒性实验[J]. 卫生研究, 2004,33(5):575-578.
[15] TADA Y, NAKASE M, ADACHI T,etal. Reduction of 14~16 kDa allergenic proteins in transgenic rice plants by antisense gene[J]. FEBS Lett, 1996,391(3):341-345.
[16] 孙艳波, 黄 毅, 段妍慧, 等. 转Bar基因抗除草剂稻谷对小鼠致敏性的研究[J].湖南师范大学自然科学学报, 2012,35(1):71-76.
[17] 李英华, 朴建华, 卓 勤, 等.Xa21转基因大米对大鼠致畸的实验研究[J]. 卫生研究, 2004,33(6):710-712.
[18] 卓 勤, 陈小萍, 朴建华, 等. 转豇豆胰蛋白酶抑制剂大米的致畸作用研究[J]. 卫生研究, 2004,33(1):74-77.
[19] 王忠华, 王 茵, 舒庆尧, 等. 转Bt基因水稻稻米的诱变性研究[J]. 中国农业科学, 2004,37(12):2043-2046.
[20] REEVES P G, ROSSOW K L, LINDLAUF J. Development and Testing of the AIN-93 Purified Diets for Rodents: Results on Growth, Kidney Calcification and Bone Mineralization in Rats and Mice[J]. J Nutr, 1993,123(11):1923-1931.
[21] HECKEL D G, GAHAN L J, DALY J C,etal. A genomic approach to understanding Heliothis and Helicoverpa resistance to chemical and biological insecticides[J]. Philos Trans R Soc Lond B Biol Sci, 1998,353(1376):1713-1722.
[22] VOS P, HOGERS R, BLEEKER M,etal. AFLP: a new technique for DNA fingerprint[J]. Nucleic Acids Res, 1995,23(21):4407-4414.
[23] WOHLLEBEN W, AMOLD W, BROER I,etal. Nucleotide sequence of the Phosphinothricin N-acetyltransferase gene from the Streptomyces hygroscopicus Tu 494 and its expression in Nicotiana tobacum[J]. Gene, 1988,70(1):25-37.

