正负离子表面活性剂复配系统囊泡的可调控性
何少青,刘美娜,叶 恒,南延青,郝力生
(湖南师范大学化学生物学及中药分析教育部重点实验室,化学化工学院,中国 长沙 410081)
自Kaler等人[1]用正负离子表面活性剂复配系统(简称CA系统)制备了性质稳定的囊泡以来,有关CA系统的研究吸引了众多研究者的兴趣[2].在一定表面活性剂总浓度和配比范围内,只需要将两种带相反电荷的离子表面活性剂水溶液简单混合,即可制备出具有热力学稳定性的囊泡(简称CA囊泡)[3],克服了传统方法(如溶胀法、注射法、超声法)存在操作复杂且制备的囊泡不稳定的缺点.囊泡是理想的生物膜模拟系统,在药物和基因的传递、控制释放,作为微反应器或软模板在微纳米材料合成等方面具有广泛的应用前景.CA囊泡的尺寸、荷电性质、渗透性等可通过调节表面活性剂总浓度、配比、链长对称性及加入添加剂等方法进行调控,以满足不同的研究及应用中对囊泡的要求,因而CA囊泡成为近年来广泛关注和研究的热点[4-10].静电作用是使CA囊泡稳定存在的原因[3],盐的加入可显著影响CA系统中带相反电荷的离子头基间的静电作用,可诱导胶束和囊泡间的结构转变[4-7].Kunz等人[4-5]系统研究了无机盐诱导的负离子表面活性剂过量的(SDS/DTAB[4], SL/DTAB[5])CA系统胶束向囊泡的转变,对于指定浓度和配比的CA系统,盐诱导的CA系统胶束向囊泡的转变表现出显著的无机反离子特异效应,此外表面活性剂离子头基和无机反离子间的水亲合性匹配也是一个重要影响因素.研究表明[4-5]可通过加入不同种类和浓度的无机盐调控囊泡的粒径,但从描述囊泡微粒均一性的多分散指数PdI的实验数据发现这些囊泡的粒径不均一.考虑到表面活性剂总浓度和配比都是影响CA系统聚集体结构、尺寸和相行为的重要因素,本文基于Kunz等人[4]的研究工作,以十二烷基硫酸钠(SDS)/十二烷基三甲基溴化铵(DTAB)/碱金属氯化盐水复配系统为研究对象,系统考察盐的种类、浓度、表面活性剂总浓度及配比等因素对诱导的CA囊泡粒径和多分散性的影响,进而归纳出通过调节上述因素调控CA囊泡粒径的规律.
1 实验部分
1.1 实验材料与试剂
十二烷基三甲基溴化铵,南京旋光科技有限公司;十二烷基硫酸钠,北京鼎国生物技术有限公司;氯化锂(LiCl),氯化铷(RbCl),氯化铯(CsCl),上海晶纯试剂有限公司;氯化钠(NaCl),长沙市湘科精细化工厂;氯化钾(KCl),天津市大茂化学试剂厂.样品均为分析纯(≥99%),使用前在333.15 K真空干燥24 h.二次重蒸水.
1.2 囊泡制备
以一定浓度的盐水溶液为溶剂,分别配制浓度相同的DTAB和SDS溶液,然后将2种表面活性剂的盐水溶液按一定物质的量比混合,轻微振荡,放于303.15±0.1 K的恒温装置中恒温5 d,若复配系统为淡兰色透明溶液,预示着囊泡自发形成[1],将囊泡样品用动态光散射仪进行粒径测定.随机选取一些不同配比的囊泡系统特别是囊泡相区边界附近的系统,放置1个月甚至半年左右,淡兰色透明溶液外观无明显变化,说明观察到的是平衡条件下的相行为.此外,为验证所配置囊泡系统的稳定性,将其加热到343.15 K放置24~48 h,再置于303.15 K的恒温水浴中恒温一段时间后,其相行为能够复原,这说明与文献结果类似[3],这类囊泡系统具有热力学稳定性.
1.3 仪器与设备
1.3.1 透射电子显微镜(TEM) 以w=1%(质量分数,下同)的醋酸铀水溶液为负染色剂,将囊泡系统和聚合后的囊泡溶液分别负染制样,然后用操作电压为100 kV的JEOL-1230型电子显微镜观测拍照[11].
1.3.2 粒径与分散系数的测定 采用Malvern Zetasizer Nano ZS 纳米粒度及Zeta电位分析仪测试样品的粒径和多分散性.测试温度为303.15 K,散射角为173°,平行测试3次.
2 结果和讨论
2.1 SDS/DTAB/盐水系统的囊泡相区
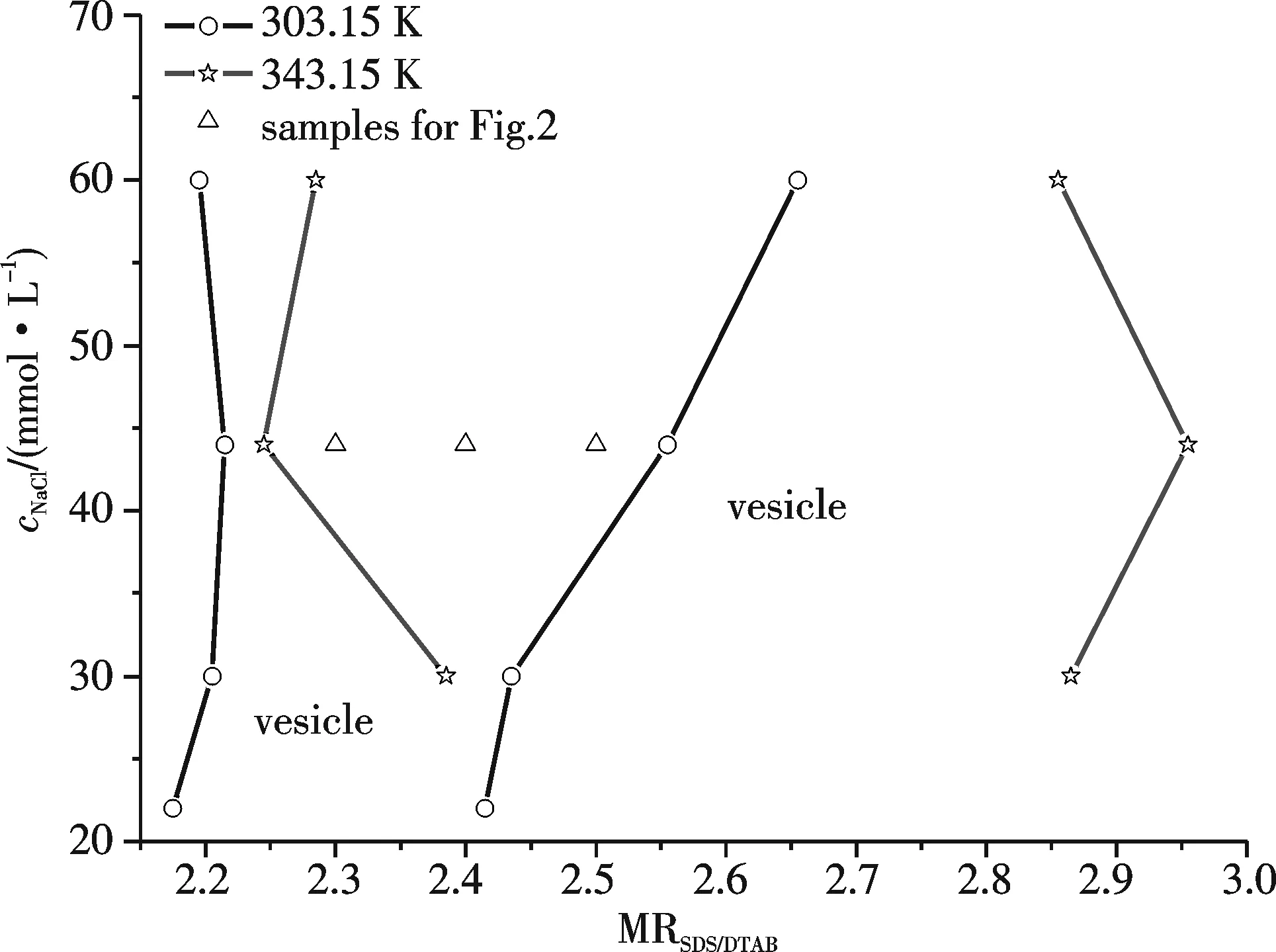
图1 SDS/DTAB/NaCl/H2O系统在303.15 K和343.15 K下的囊泡相区Fig.1 The vesicular phase regions of SDD/DTAB/NaCl/H2O system at 303.15 K and 343.15 K
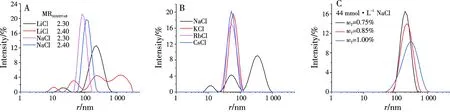
分别以22、30、44、60 mmol·L-1NaCl, 22 mmol·L-1KCl、RbCl、CsCl,60 mmol·L-1LiCl水溶液为溶剂,配制了表面活性剂wT=1.00%、具有不同配比、SDS过量的SDS/DTAB复配系统,在303.15 K下恒温放置,目测观察,若系统为淡兰色透明溶液,则意味着有囊泡自发生成[1,12-13].图1为303.15 K下囊泡相区随NaCl水溶液浓度cNaCl的变化;聚合反应在343.15 K下进行,该系统在343.15 K下的囊泡相区也被观测确定.表面活性剂形成的聚集体微观结构与临界堆积参数p有关,p=v/(lmaxa),其中v和lmax分别表示表面活性剂疏水部分的体积和长度,a为有效头基面积.当1/3 从60 mmol·L-1LiCl和NaCl的SDS/DTAB系统和22mmol·L-1的SDS/DTAB/无机盐(NaCl,KCl,RbCl和CsCl)系统的实验结果比较,发现在303.15 K时,随着碱金属离子半径的增大,囊泡相区变宽,这与反离子结合度增强有关.而在343.15 K时,随着碱金属离子半径的增大,囊泡相区反而变窄.这与在较高温度下,分子热运动加剧等因素导致的囊泡结构破坏有关. A: MRSDS/DTAB=2.3 B: MRSDS/DTAB=2.4 C: MRSDS/DTAB=2.5图2 wT=1.00% SDS/DTAB/44 mmol·L-1 NaCl/H2O复配系统(303.15 K)的TEM负染照片Fig.2 The negative staining TEM imagines of wT=1.00% SDS/DTAB/44 mmol·L-1 NaCl/H2O mixed systems 图3 制备时间不同的wT =1.00% SDS/DTAB/44 mmol·kg-1 NaCl/H2O囊泡系统DLS结果Fig.3 The DLS results of wT=1.00% SDS/DTAB/44 mmol kg-1 NaCl/H2O (MRSDS/DTAB=2.3) vesicular systems with different preparation times 2.2.1 制备时间的影响 图3给出了制备时间对wT=1.00% SDS/DTAB/NaCl/H2O复配囊泡系统的粒径大小及其分布的影响.随着制备时间的增长,囊泡的平均粒径先是逐渐增大,粒径分布范围变宽,说明囊泡之间发生了互相融合的现象,在制备时间为5~7 d时,出现了一个稳定时段,囊泡的粒径及其分布变化很小,但是在9~15 d时,囊泡融合的趋势又变得显著,在15 d时,囊泡粒径分布图上出现了多个粒径峰,而到25 d时,囊泡粒径的均一程度变好,其后囊泡粒径略减小然后粒径分布趋于稳定,如30 d和35 d时囊泡的粒径及其分布与5~7 d时相近.这是由于最初制得的囊泡系统处于亚稳态,有融合变大的趋势,经过一段时间的稳定,最后达到系统能量最低、最稳定的状态[16].因5~7 d时的情况与最终稳定时的情况相似,所以本文囊泡的制备时间选择为5 d. 2.2.2 无机盐浓度的影响 选择MRSDS/DTAB=2.30,2.40和2.50、wT=1.00% 的 SDS/DTAB/NaCl/H2O系统,考察cNaCl的改变对囊泡粒径及多分散指数PdI的影响,DLS结果见图4.在cNaCl较低时,对一定配比复配系统,其囊泡粒径分布范围较宽,PdI较大,随cNaCl增大,粒径分布图上的多峰逐渐变为单峰,PdI减小,囊泡粒径分布范围变窄,单分散性变好,平均粒径减小.结合图1和图4,可知随MRSDS/DTAB增大,诱导棒状胶束向囊泡的转化的无机盐浓度随之增大,MRSDS/DTAB较小即更接近等摩尔比的系统,其a较小,p相对较大,较少量的无机盐加入即可使p增大到1/2到1之间,更易于诱导棒状胶束向囊泡的转化.在无机盐最初诱导棒状胶束向囊泡转化时,所形成的囊泡粒径大小很不均匀,随着盐浓度的逐渐增大,p也逐渐增大,当p增大到一定程度时,更有利于粒径较小且较均一的囊泡生成. 图4 wT =1.00% SDS/DTAB/NaCl/H2O复配系统DLS结果Fig.4 The DLS results of wT=1.00% SDS/DTAB/NaCl/H2O mixed systems 2.2.3 碱金属氯化盐中碱金属离子的影响 图5给出了碱金属氯化盐诱导的囊泡系统的DLS结果.对于MRSDS/DTAB=2.30和2.40的系统(图5A),即使LiCl的浓度高达60 mmol·L-1,生成的囊泡粒子粒径分布范围很宽,而在60 mmol·L-1NaCl水溶液中所形成的囊泡粒子单分散性较好.对于MRSDS/DTAB=2.30的系统(图5B),在22 mmol·L-1NaCl水溶液中所形成的囊泡粒子粒径分布范围很宽,而在同样浓度的KCl、RbCl或CsCl水溶液中,所形成的囊泡粒子单分散性较好,囊泡的平均粒径按如下无机盐次序减小:KCl>RbCl≈CsCl.结果表明在碱金属氯化盐诱导棒状胶束向囊泡转化的过程中,反离子效应按如下次序增强:Li+ A: wT=1.0%,盐水浓度为60 mmol·L-1;B: wT=1.0%,盐水浓度为22 mmol·L-1,MRSDS/DTAB=2.30;C: MRSDS/DTAB=2.40图5 SDS/DTAB/盐水系统DLS结果A: wT=1.0%, the concentration of salt solution is 60 mmol·L-1; B: wT=1.0%,the concentration of salt solution is 22 mmol·L-1, MRSDS/DTAB=2.30; C: MRSDS/DTAB=2.40Fig.5 The DLS results of SDS/DTAB/salt containing aqueous systems 2.2.4 配比的影响 以44 mmol·L-1NaCl水溶液为例,考察了配比改变对SDS/DTAB/NaCl/H2O系统生成的囊泡粒径及多分散指数PdI的影响,结果见表1.由表1和图4结果可见,在MRSDS/DTAB=2.5时,生成的囊泡是多分散的,PdI=0.956,囊泡的粒径分布范围很宽,由十几nm到3 000 nm左右,且有3个显著的峰值.随配比MRSDS/DTAB减小,囊泡粒径的PdI显著减小,即DLS粒径分布图上的多峰变为单峰,同时Z均半径逐渐减小.这与在一定盐浓度下,一定表面活性剂总浓度的复配系统,在一定配比范围内,其p随配比向等物质的量比接近逐渐增大,更有利于囊泡粒子的生成有关.配比向等摩尔比接近时对囊泡的影响规律与增加盐浓度,或与氯化盐中碱金属离子促进结构能力减弱、破坏结构能力增强时的影响规律相类似. 表1 wT=1.00%SDS/DTAB/44 mmol·L-1 NaCl/H2O复配系统囊泡的Z均半径r和PdI 2.2.5 表面活性剂总浓度的影响 对MRSDS/DTAB=2.40的SDS/DTAB/44 mmol·L-1NaCl/H2O复配系统,考察了表面活性剂总浓度wT改变对囊泡粒径和PdI的影响.由图5C可见,随着wT增大,囊泡平均粒径随之增大,囊泡粒径分布范围显著变宽,这表明PdI也在显著增大.这与文献[16]中一定配比的CTAB/SDBS囊泡粒径随浓度增大而增大的研究结果一致.这与复配系统所形成的聚集体,在较低浓度下组成更接近等物质的量比,而在较高浓度下组成远离等物质的量比,更接近体相组成[13,17]有关.随囊泡组成向等物质的量比接近,带相反电荷的离子头基间静电引力增强,a减小,p增大,因而更有利于粒径较小且较均匀的囊泡生成,因而表面活性剂总浓度降低,生成的囊泡粒径减小,PdI也减小. 多种因素影响SDS/DTAB/碱金属氯化盐水系统生成囊泡的平均粒径和多分散指数PdI,这表明可以通过调节这些影响因素来调控复配系统的囊泡.无机盐浓度、碱金属离子的种类、配比MRSDS/DTAB以及表面活性剂总浓度wT是几个主要影响因素.研究表明在囊泡相区中,在其他因素不变的情况下,增大无机盐浓度,或减小MRSDS/DTAB,或减小wT,或促进结构型的碱金属离子被破坏结构型的碱金属离子所取代,都有利于CA系统生成的囊泡平均粒径的减小和单分散性的改善.研究结果表明利用如下一些CA系统可制得粒径较均一的囊泡:wT=0.75%,0.85%,1.00%,MRSDS/DTAB=2.3~2.4的SDS/DATB/44 mmol·L-1NaCl/H2O;wT=1.00%,MRSDS/DTAB=2.3~2.5的SDS/DATB/60 mmol·L-1NaCl/H2O;wT=1.00%,MRSDS/DTAB=2.3的SDS/DATB/22 mmol·L-1KCl(或CsCl,或RbCl)/H2O.本文关于CA系统囊泡可调控性的研究可为以此囊泡系统为软模板制备聚合物中空微球提供理论基础,对实际应用具有一定指导作用. 参考文献: [1] KALER E W, MURTHY A K, RODRIQUEZ B E,etal. Spontaneous vesicle formation in aqueous mixtures of single-tailed surfactants [J]. Science, 1989,245(4924):1371-1374. [3] WALKER S A, ZASADZINSKI J A. Electrostatic control of spontaneous vesicle aggregation [J]. Langmuir, 1997,13(19):5076-5081. [4] RENONCOURT A, VLACHY N, BAUDUIN P,etal. Specific alkali cation effects in the transition from micelles to vesicles through salt addition [J]. Langmuir, 2007,23(5):2376-2381. [5] VLACHY N, DRECHSLER M, VERBAVATZ J M,etal. Role of the surfactant headgroup on the counterion specificity in the micelle-to-vesicle transition through salt addition [J]. J Colloid Interface Sci, 2008,319(2):542-548. [6] BRASHER L L, HERRINGTON K L, KALER E W. Electrostatic effects on the phase behavior of aqueous cetyltrimethylammonium bromide and sodium octyl sulfate mixtures with added sodium bromide [J]. Langmuir, 1996,11(11):4267-4277. [7] CHEN L, XING H, YAN P,etal. Anomalous effects of concentrated salts on the equimolarly mixed cationic-anionic surfactant mixtures [J]. Soft Matter, 2011,7(11):5365-5372. [8] JIANG L, WANG K, DENG M,etal. Bile salt-induced vesicle-to-micelle transition in catanionic surfactant systems: Steric and electrostatic interactions [J]. Langmuir, 2008,24(9):4600-4606. [9] YUET P K, BLANKSCHTEIN D. Effect of surfactant tail-length asymmetry on the formation of mixed surfactant vesicles [J]. Langmuir, 1996,12(16):3819-3827. [10] HAO J, HOFFMANN H. Self-assembled structures in excess and salt-free catanionic surfactant solutions [J]. Curr Opin Colloid Interface Sci, 2004,9(3-4):279-293. [11] HAO L S, DENG Y T, ZHOU L S,etal. Mixed micellization and the dissociated margules model for cationic/anionic surfactant systems [J]. J Phys Chem B, 2012,116(17):5213-5225. [12] KALER E W, HERRINGTON K L, MURTHY A K,etal. Phase behavior and structures of mlxtures of anionic and cationic surfactants [J]. J Phys Chem, 1992,96(16):6698-6707. [13] HERRINGTON K L, KALER E W, MILLER D D,etal. Phase behavior of aqueous mixtures of dodecyltrimethylammonium bromide (DTAB) and sodium dodecyl sulfate (SDS) [J]. J Phys Chem, 1993,97(51):13792-13802. [14] GORSKI N, KALUS J. Temperature dependence of the sizes of tetradecyltrimethylammonium bromide micelles in aqueous solutions [J]. Langmuir, 2001,17(6):4211-4215. [15] TSUCHIYA K, NAKANISHI H, SAKAI H,etal. Temperature-dependent vesicle formation of aqueous solutions of mixed cationic and anionic surfactants [J]. Langmuir, 2004,20(6):2117-2122. [16] 余 娜. 囊泡的自发形成与其稳定性的研究[D].长春:吉林大学,2007. [17] KATO T, TAKEUCHI H, SEIMIYA T. Concentration dependence of micellar size and composition in mixed anionic/cationic surfactant solutions studied by light scattering and pulsed-gradient FT-NMR spectroscopy [J]. J Phys Chem, 1992,96(16):6839-6843.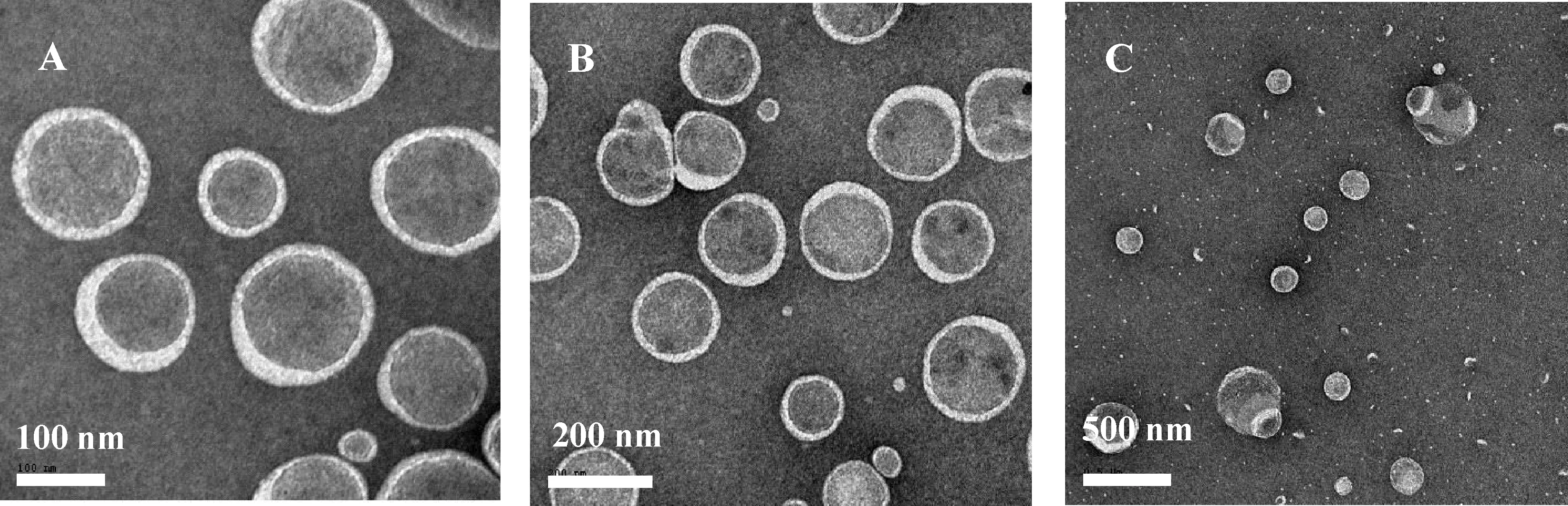
2.2 SDS/DTAB/盐水系统囊泡的粒径及影响因素



3 结论

