血液透析患者动脉粥样硬化的高频超声评价
杨 克,张云山,刘秋颖,张 岩
慢性肾脏疾病(chronic kidney disease,CKD)是动脉粥样硬化的重要危险因素,约有50%的终末期肾病患者伴有动脉粥样硬化。动脉粥样硬化性心血管疾病是CKD患者,尤其是血液透析(hemodialgis,HD)时死亡的最常见原因[1]。颈动脉内中膜厚度(carotid artery intima-media thickness,CIMT)的增加及斑块的出现能够反映全身动脉粥样硬化的变化,CIMT增厚与冠状动脉粥样硬化的发生和严重程度有很强的关联[2],因此测量颈动脉CIMT能够对血液透析患者进行心血管事件的风险评价。超声测量CIMT是一种有效的检测动脉粥样硬化进展的非侵入性方法。本研究旨在探讨高频超声对HD患者动脉粥样硬化进展的诊断价值,并探讨HD患者动脉粥样硬化与各种危险因素的关联。
1 资料与方法
1.1 研究对象 2007年1月至2012年6月因慢性肾功能衰竭在我院肾脏内科规律行HD的患者58例,入选标准:终末期肾脏疾病,窦性心律,左室射血分数>50%,无心肌梗死病史,无血管疾病。其中男30例,女28例,年龄36~68岁,平均(51.2±13.8)岁,透析龄(30.4±7.6)个月。根据透析龄分为2组,短期组透析龄<2年,共32例;长期组透析龄≥2年,共26例。原发性疾病分别为糖尿病肾病14例,高血压肾病10例,原发性慢性肾炎18例,梗阻性肾病6例,多囊肾7例,原因不明5例。另选取本院健康体检人员40例作为对照组,其中男21例,女19例,年龄34~67岁,平均(49.4±10.6)岁。长、短期组与对照组年龄、性别、体质量指数比较差异均无统计学意义(P>0.05)。
1.2 研究方法 所有对象均行双侧颈动脉高频超声检查,测量CIMT及斑块,收集临床及实验室检查资料,进行对比分析。颈总动脉超声检查:采用Philips公司IU22彩色多普勒超声诊断仪,探头频率10 MHz,由同一超声医师盲法检测。CIMT检测部位位于颈总动脉分叉近端2~4 cm无斑块处,测量3处取平均值,再取双侧的平均值,再仔细探查双侧颈总、颈内及颈外动脉的斑块。
1.3 统计学处理 采用SPSS 15.0统计分析软件,计量资料用均数±标准差(x±s)表示,组间比较采用t检验,相关分析采用Spearmen′s检验。P<0.05认为差异有统计学意义。
2 结果
各组研究对象的临床资料、实验室及超声检查结果见表1。长期组的血磷及C反应蛋白水平明显高于短期组,血钙和白蛋白水平明显低于短期组,差异有统计学意义(P<0.05)。长期组的CIMT明显大于短期组(P<0.05),2组斑块发生率比较差异无统计学意义(P>0.05)。
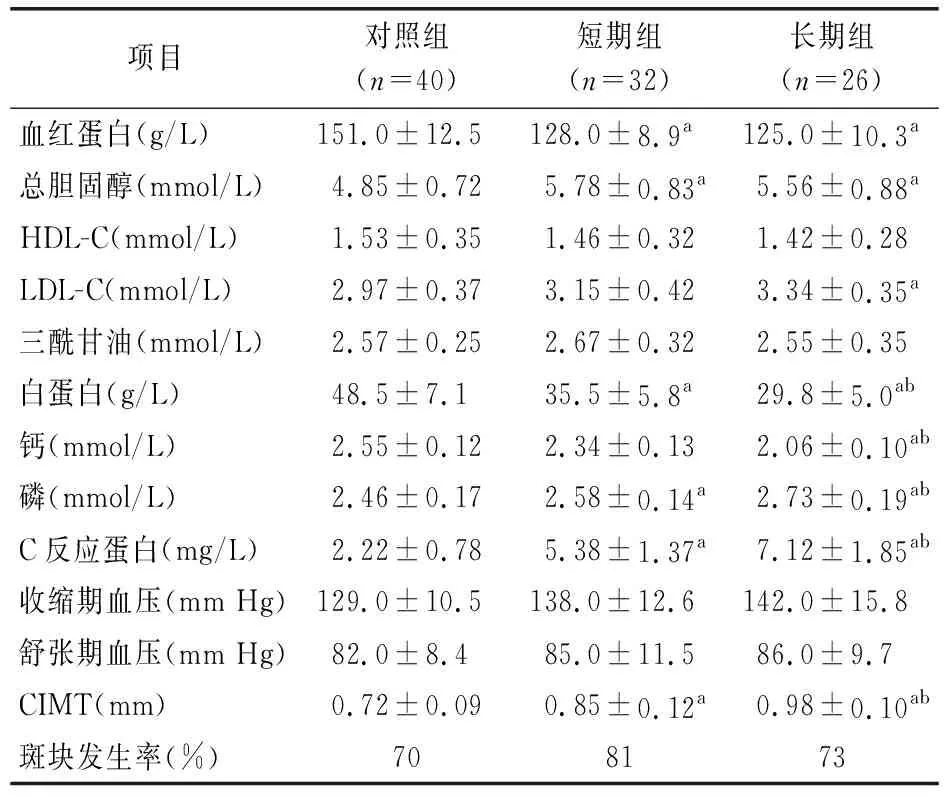
表1 3组临床资料及实验室检查结果比较(x±s)
长、短期组CIMT与各因素的相关性分析见表2。短期组中,CIMT与低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)水平正相关(P<0.05),与白蛋白水平负相关(P<0.05);长期组CIMT与总胆固醇(TC)、LDL-C、TG、C反应蛋白、年龄因素正相关(P<0.05),与高密度脂蛋白胆固醇(HDL-C)、白蛋白、钙水平负相关,但差异无统计学意义(P>0.05)。
3 讨论
多项研究结果显示,CKD是动脉粥样硬化进展的重要因素,与健康对照组相比,CKD血液透析患者的CIMT增厚及斑块发生率明显升高[3-4],且发病年龄较正常人群提前。一般认为动脉硬化由多个遗传和环境因素相互作用所致,习惯上将其称为动脉硬化的危险因素,目前公认的重要危险因子是血脂蛋白异常,主要是低密度脂蛋白升高,高密度脂蛋白减少,脂蛋白(a)升高,高血压,糖尿病,同型半胱氨酸升高等[5],大量研究证实慢性肾衰患者存在进展性动脉粥样硬化,并且在尿毒症透析前已经开始。本研究发现,长期行HD治疗(透析龄≥2年)的CKD患者的CIMT显著高于短期HD治疗的患者,与此同时长期HD治疗患者的C反应蛋白、血磷水平显著高于短期组,白蛋白、血钙水平显著低于短期组,这与以往的一些研究结果相一致[6-7]。
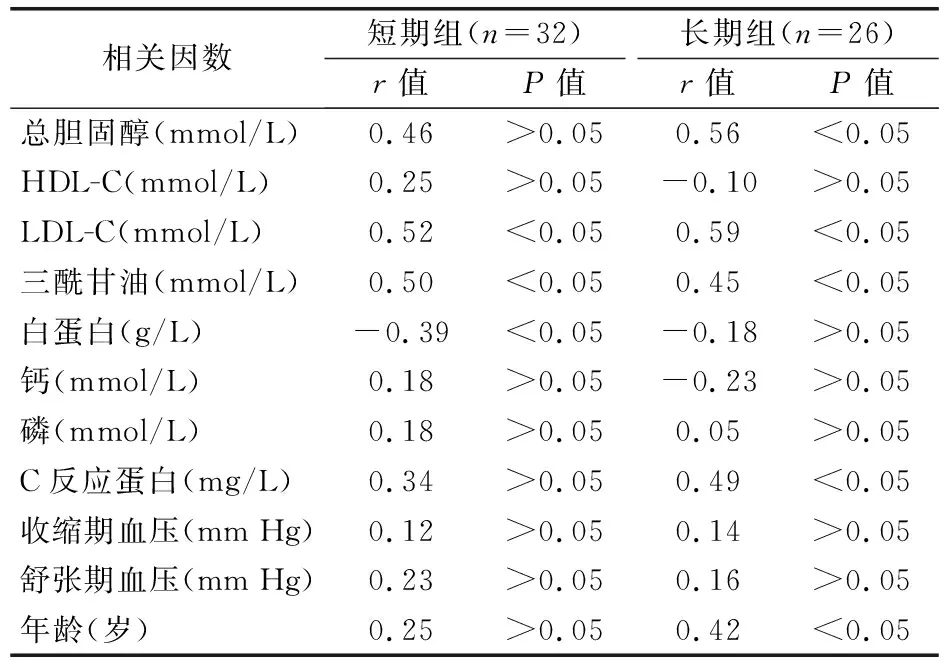
表2 长、短期透析组CIMT与各因素的相关性分析
血液透析患者的心血管损伤机制十分复杂,传统的动脉粥样硬化危险因素不能完全解释血液透析患者高发动脉粥样硬化的现象,这类患者同时具有动脉粥样硬化和慢性肾脏疾病带来的多种危险因素[8]。动脉粥样硬化也被认为是一种炎症疾病[9],近年的研究表明HD患者体内的慢性炎症状态与患者的动脉粥样硬化有密切关系。也有研究证实了一般和透析人群的炎性因子和CIMT的关联。
Okhuma等[10]发现,C反应蛋白、血清钙水平和CIMT显著相关,以及斑块积分和C反应蛋白显著相关。血清CRP是一种正性急性时相反应蛋白,是机体慢性炎症状态的一项敏感指标,慢性肾脏疾病患者的血清CRP水平持续升高被认为是炎症状态的证据。Kawagashi等[11]发现,血液透析患者的CIMT、血清磷水平及甲状旁腺激素(PTH)存在关联。慢性肾脏衰竭患者血钙常降低,血磷浓度升高,使钙沉积于软组织,引起软组织钙化。钙磷代谢受损还可能影响脂蛋白代谢,从而加重动脉粥样硬化。长期HD治疗的患者常伴有继发性甲状旁腺功能亢进,国外已有文献报道,慢性肾衰患者继发性甲状旁腺功能亢进引起的高磷血症及动脉钙化与动脉粥样硬化均有相关性[12-13]。
在一些研究中HD患者的血清白蛋白水平与CIMT独立相关,白蛋白作为一个负面急性期蛋白还代表增强的炎症反应的状态。本研究中HD治疗后的患者血清白蛋白水平降低,说明患者体内存在慢性炎症,同时可能存在营养不良,而高脂血症、低蛋白血症均可导致动脉粥样硬化的发生,营养不良-慢性炎症-动脉粥样硬化三因素可能相互促进,构成恶性循环,加重患者的病情恶化,炎症状态的存在又可加剧贫血、营养不良、动脉粥样硬化性心脑血管并发症[14-16]。
CKD患者的高血压非常常见,过去的研究没有证实高血压是HD患者CIMT增厚的决定因素。在本研究中也没有发现血压与CIMT及斑块的关联,可能是因为HD患者长期接受降压治疗,血压控制的比较好,药物治疗抑制了动脉粥样硬化的进展。关于HD患者CIMT与脂代谢紊乱的关联的报道较多,HD患者的TC、LDL-C、TG、CIMT及斑块发生存在独立的联系已经被证实。有资料显示,在血透患者中,年龄与动脉内膜厚度相关,而且是决定粥样斑块数量的明显决定因素[17],本研究也支持这些结论。
本研究发现CKD患者在经过长期HD治疗后CIMT显著增厚,与血脂,血清钙、磷及CRP、白蛋白水平相关,为临床上采取有效的预防和治疗措施提供了依据和佐证,因此高频超声评价HD患者动脉粥样硬化的进展具有重要价值。
[参考文献]
[1] Coresh, Astor B, Sarnak MJ. Evidence for increased cardiovascular disease risk in patients with chronic kidney disease[J]. Curr Opin Nephrol Hypertens, 2004, 13(Suppl 2): 73-81.
[2] Lim TK, Lim E, Dwivedi G, et al. Normal value of carotid intima-media thickness—a surrogate marker of atherosclerosis: quantitative assessment by B-mode carotid ultrasound[J]. J Am Soc Echocardiogr, 2008, 21(2): 112-116.
[3] Qureshi AR, Alvestrand A, Divino-Filho JC, et al. Inflammation, malnutrition, and cardiac disease as predictors of mortality in hemodialysis patients[J]. J Am Soc Nephrol, 2002, 13(Suppl 1): 28-36.
[4] Hojs R. Carotid intima-media thickness and plaques in hemodialysis patients[J]. Artif Organs 2000,24(9): 691-695.
[5] 郑波,陈志伟. 颈动脉粥样硬化与脑梗死相关性临床研究[J].海军医学杂志,2005,26(3):227-228.
[6] Kato A, Takita T, Maruyama Y, et al. Impact of carotid atherosclerosis on long-term mortality in chronic hemodialysis patients[J]. Kidney Int, 2003, 64: 1472-1479.
[7] Papagianni A, Kokolina E, Kalovoulos M, et al. Carotid atherosclerosis is associated with inflammation, malnutrition and intercellular adhesion molecule-1 in patients on continuous ambulatory peritoneal dialysis[J]. Nephrol Dial Transplant, 2004, 19(5): 1258-1263.
[8] 王红娣,冯冰,王琥,等. 尿毒症合并主动脉夹层1例[J].海军医学杂志,2012,33(3):166.
[9] 徐也鲁. 动脉粥样硬化-一种慢性炎症过程[J]. 中国动脉粥样硬化杂志, 2001, 9(2): 93-95.
[10] Okhuma T, Minagawa T, Takada N, et al. C-reactive protein, lipoprotein (a), homocysteine, and male sex contribute to carotid atherosclerosis in peritonealdialysis patients[J]. Am J Kidney Dis, 2003, 42(2): 355-361.
[11] Kawagishi T, Nishizawa Y, Konishi T,et al. High-resolution B-mode ultrasonography in evaluation of atherosclerosis in uremia[J]. Kidney Int, 1995, 48(3): 820-826.
[12] 马骏,齐华林,许晨,等. 维持性血液透析患者炎症与颈动脉粥样硬化的关系[J]. 中国动脉硬化杂志, 2004, 12(1): 69-72.
[13] Arici M, Walls J. End-stage renal disease, atherosclerosis, and cardiovascular mortality: C-reactive protein the miss link[J]. Kidney Int, 2001, 59(2): 407-414.
[14] London G, Marchais S, Guerin A, et al. Arterial structure and function in end-stage renal disease[J]. Nephrol Dial Transplant, 2002, 17(): 1713-1724.
[15] Nishizawa Y, Shoji T, Maekawa K, et al. Intima-media thickness of carotid artery predicts cardiovascular mortality in hemodialysis patients[J]. Am J Kidney Dis, 2003, 41(3): S76-S79.
[16] Takashi K, Kosaku N, Hiroyuki K, et al. An increased serum level of parathyroid hormone is a risk factor for atherosclerosis in hemodialysis patients[J]. Nephron, 2000, 86(2): 213-214.
[17] Yildi. Carotid atherosclerosis is a predictor of coronary calcification in chronic haemodialysis patients[J]. Nephrol Dial Transplant, 2004, 19(4): 885-891.

