小分子Rhizobiumsp.N613胞外多糖的羧甲基化及其抗肿瘤活性
聂瑞红,吕利华,魏国琴,王桂琴,赵良启*
(1山西大学化学生物学与分子工程教育部重点实验室, 太原030006;2山西晋城无烟煤矿业集团有限公司;3山西医科大学微生物学与免疫学教研室;*通讯作者,E-mail:liangqi@sxu.edu.cn)
生物多糖,不仅是生物机体结构的组成成分,而且是一类具有重要生物功能的活性物质[1,2],在机体生命活动过程中扮演着重要角色,例如信号识别、细胞分化、免疫调节等。如今,多糖生物学已成为继核酸、蛋白质生物学研究之后的又一大学科分支。生物多糖的应用研究已取得较大进展,越来越多的功能多糖从动物、植物和微生物中被开发出来。一些多糖具有抗肿瘤、抗氧化、抗衰老和提高免疫力等功能,已用于生物医药[3,4]。
目前,在已分离得到的多种生物活性多糖中,有一些多糖已显示出较好的医疗功效和应用价值,然而其理化性质和生物活性仍有待改善和提高。改善多糖相关性质的方法有多种,但最为有效的方法是分子修饰。迄今为止,已有羟甲基化、硫酸酯化、硒化、羧甲基化等方法应用于多糖修饰,在改善多糖理化性质和生物活性方面取得了一定进展[5]。
我们实验室已经应用微波辐照氧化技术降解Rhizobium sp.N613(REPS)获得了一种小分子Rhizobium sp.N613(LREPS)[6-8],极大地改善了原多糖的溶解性。本文拟以乙醇为溶剂,应用一氯乙酸对LREPS进行羧甲基化修饰,通过正交试验优化羧甲基化LREPS(CM-LREPS)的制备工艺条件。选用不同取代度的CM-LREPS进行抗肿瘤活性测定,以取代度和抑瘤率为检测指标确定CM-LREPS的最佳制备工艺条件,为CM-LREPS的开发应用奠定基础。
1 材料与方法
1.1 材料与试剂
LREPS,由本实验室发酵纯化降解制得,纯度达99%以上,分子量为10.352 kD。一氯乙酸、氢氧化钠、冰醋酸、无水乙醇、溴化钾,以上试剂均为分析纯,均购自天津化学试剂三厂。
1.2 主要仪器
pH计 (德国inolab公司),CR22G高速冷冻离心机(日本日立公司),Heto-PL3000-冷冻干燥机(捷克热力电器公司),傅立叶变换红外光谱仪 (美国Mattson公司)。
1.3 试验动物与肿瘤细胞株
健康昆明种小鼠,4-5周龄,购于山西医科大学实验动物中心。小鼠肝癌腹水瘤H22细胞株购于山西省肿瘤医院实验动物中心。
1.4 试验方法
1.4.1 CM-LREPS 制备及工艺条件优化 CMLREPS制备方法:乙醇为溶剂,按一定的物料比,将乙醇、一氯乙酸、氢氧化钠及LREPS分别加入反应器中,充分搅匀后移入恒温水浴振荡器中,待物料升温至反应温度,保温进行反应。反应完成后加入冰醋酸,中和pH为7.0。先以自来水透析再以蒸馏水透析,加入3倍体积乙醇沉淀,离心弃上清,冷冻干燥法获得一系列CM-LREPS产物。
CM-LREPS分子结构测定:LREPS与 CMLREPS的结构比较采用溴化钾压片法,分别称取5 mg LREPS和CM-LREPS,与400 mg KBr粉末混合研磨、压片,采用红外光谱仪扫描分析,扫描范围为4 000-500/cm。
取代度(DS)和CM-LREPS取代度的测定:取代度指平均每个失水葡萄糖单元上被反应试剂取代的羟基数目。CM-LREPS取代度的测定采用硫酸铜沉淀法[9]。
正交试验优化CM-LREPS制备条件:在单因素实验基础上,选取乙醇体积分数、LREPS用量、一氯乙酸用量、氢氧化钠用量、醚化温度及时间为因素,采用L25(56)正交表优化CM-LREPS制备条件,因素水平设计见表1。

表1 CM-LREPS正交试验设计因素水平表Tab 1 Factors and levels of orthogonal test for CM-LREPS
1.4.2 CM-LREPS生物学活性测定及最佳制备工艺确定 不同取代度CM-LREPS的抗肿瘤及免疫活性测定:供试昆明种雌性小鼠随机分组,每组10只。抽取接种1周左右的小鼠肝癌腹水瘤H22,以生理盐水配制成106个/ml的肿瘤细胞悬液,在每只小鼠左腋皮下接种0.2 ml,建立荷瘤小鼠模型。接种24 h后,每日1次腹腔注射0.2 ml试样溶液,不同取代度的CM-LREPS剂量为10 mg/kg体重,阳性对照组环磷酰胺(Cy)的剂量为20 mg/kg体重,阴性对照组注射生理盐水,连续给药10 d,每日定时称重小鼠体重并记录。连续给药10d停药,次日称量小鼠体重断颈处死,摘取小鼠脾脏及胸腺,剥取小鼠左腋下瘤块分别称量脾脏、胸腺和瘤块重量并计算平均值[7]。
CM-LREPS最佳制备工艺条件确定:根据正交试验结果和不同取代度CM-LREPS的抑瘤率,确定CM-LREPS的最佳制备工艺条件。
2 结果与分析
2.1 不同取代度CM-LREPS的制备
应用L25(56)正交表进行了25组实验并得到一系列取代度不同的CM-LREPS。CM-LREPS试验结果和方差分析见表2、表3。
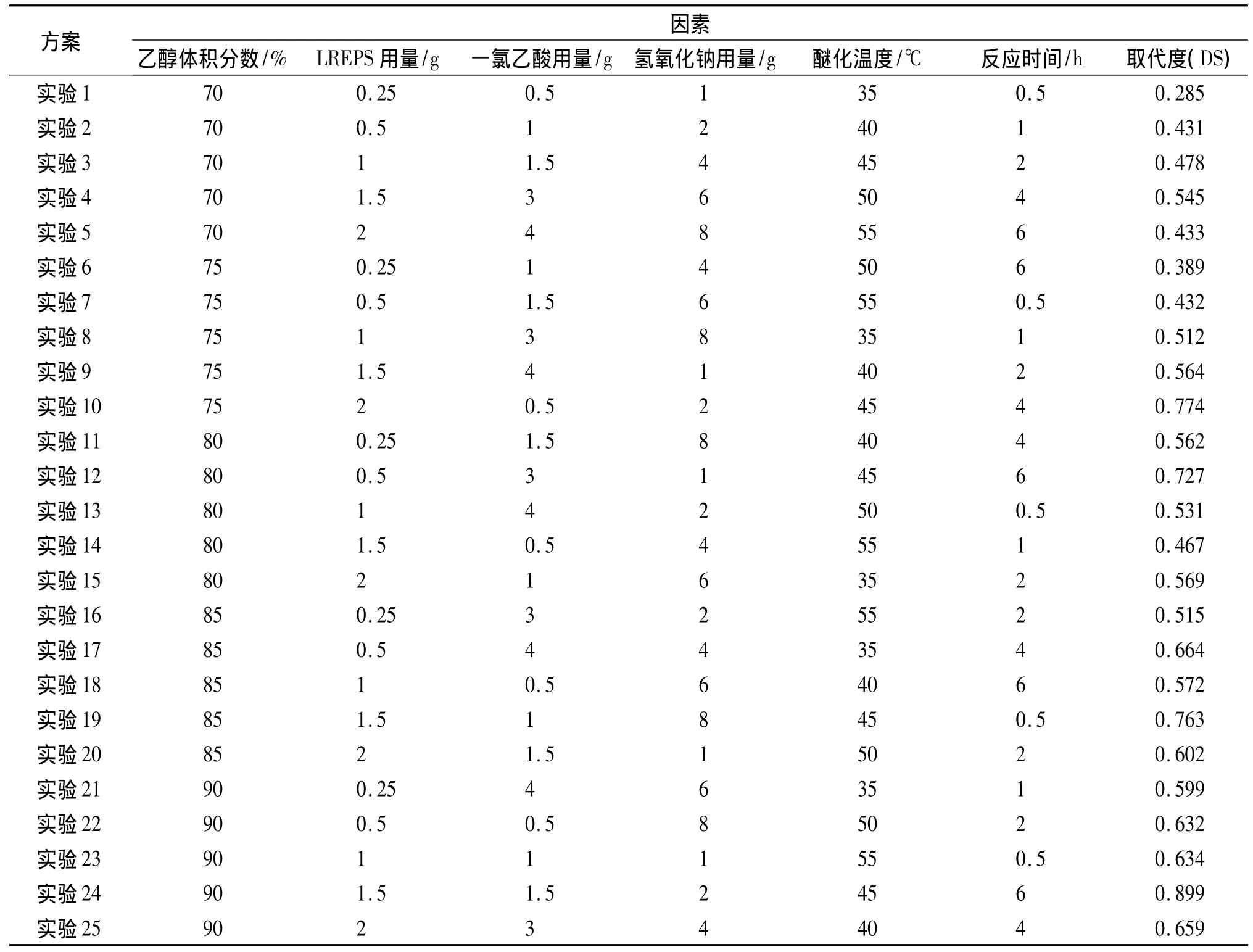
表2 CM-LREPS正交试验结果Tab 2 Orthogonal test results of CM-LREPS

表3 CM-LREPS方差分析Tab 3 Analysis of variance of CM-LREPS
由表2正交试验结果可以看出,实验成功获得了一组不同取代度的羧甲基化LREPS样品及其相应的制备工艺参数。由表3可以看出,影响LREPS羧甲基化的因素顺序是:醚化温度>乙醇质量分数>一氯乙酸用量>LREPS用量>氢氧化钠用量>反应时间。通过调整醚化温度,乙醇质量分数及其一氯乙酸用量,能够有效改变CM-LREPS的取代度。
CM-LREP结构的红外分析(图1)显示,两种纯多糖在4 000-500/cm范围内有糖类特征吸收峰,3 400/cm附近出现的宽峰是分子内或分子间O-H伸缩振动的结果。CM-LREPS样品在1 720/cm附近的吸收峰为CCA羧基形成的酯键 (-COOR)C=O的伸缩振动。1 636/cm的强吸收峰为羧酸盐(-COO-)的不对称伸缩振动,同时也是糖水化物样品的特征吸收峰[10]。综上所述,经羧甲基修饰后,LREPS结构发生了变化。
2.2 CM-LREPS生物学活性测定及最佳制备工艺确定
以 LREPS 和CM-LREPS(DS=0.285、0.531、0.659和0.899)代表性样品进行体内鼠肝癌H22抗肿瘤和免疫活性试验,结果见表4。
从表4可以看出,取代度的大小与抑瘤率有着直接关系,不同的取代度抑瘤作用不相同。取代度最低组 (DS=0.285)和取代度中等组 (DS=0.531和DS=0.659)的抑瘤率较修饰前LREPS都有所提高,其中取代度为0.659的CM-LREPS抑瘤率最高,达到59.2%。而当取代度达到0.899时,其抗肿瘤活性降低到49.2%。可见CM-LREPS对H22肿瘤细胞抑制作用有其最适的取代度取值范围。阳性对照组(环磷酰胺)抑瘤效果最为明显,但是显著降低了小鼠的胸腺与脾脏指数,对小鼠产生了毒副作用。而LREPS及CM-LREPS可显著增加小鼠胸腺,脾脏的重量,增强了荷瘤小鼠的免疫功能。本实验中综合考察了不同取代度CM-LREPS对小鼠肝癌H22抑瘤率及脏器指数的影响,疗效最好的CM-LREPS取代度在0.659左右。

图1 CM-LREPS与LREPS红外图谱比较Fig 1 Comparison of infrared spectra between CM-LREPS and LREPS
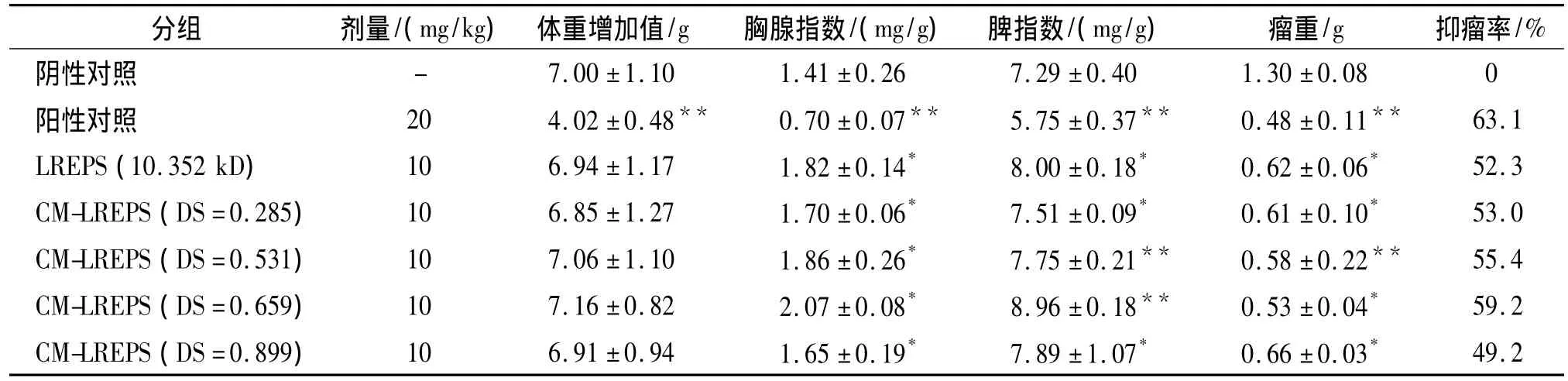
表4 CM-LREPS和LREPS对H22荷瘤小鼠瘤重及脏器指数的影响Tab 4 Antitumor activity,thymus and spleen index of CM-LREPS and LREPSagainst H22
以羧甲基化LREPS的取代度及抗肿瘤活性为检测指标,确定CM-LREPS的最佳制备工艺条件:乙醇质量分数为90%,LREPS用量为2.0 g,一氯乙酸用量为3.0 g,氢氧化钠用量为4.0 g,醚化温度为40℃,反应时间为4 h。
3 讨论
本文以实验室开发的小分子量锦鸡儿根瘤菌多糖LREPS为基本原料,一氯乙酸为修饰剂,通过改变底物加量、反应体系酸碱度、醚化温度和反应时间等条件,制备羧甲基化小分子多糖—CM-LREPS。红外光谱分析表明实现了LREPS的羧甲基化。通过正交试验考察了乙醇质量分数、LREPS、一氯乙酸、氢氧化钠用量、醚化温度及时间对CM-LREPS取代度的影响并在获得一系列CM-LREPS产物的同时建立了CM-LREPS的制备工艺。本试验中羧甲基化反应时间短,反应副产物少,无有毒副产物生成,反应过程简单。在实验中我们发现,通过调整醚化温度、乙醇质量分数、一氯乙酸可以显著影响CMLREPS的取代度,而LREPS用量、氢氧化钠用量及反应时间对CM-LREPS的取代度影响较小。
以取代度和抗肿瘤活性为指标,进一步确定了CM-LREPS的最佳制备工艺条件。本文为今后羧甲基化多糖在保健或药物开发方面提供了一定的参考价值,CM-LREPS的抗肿瘤作用机制有待进一步研究。
[1]Huheihel M,Ishanu V,Tal J,etal.Activity of Porphyridium sp.polysaccharide against herpes simplex viruses in vitro and in vivo[J].Biochem Biophys Methods,2002,50(223):189-200.
[2]Chen XM,Zhang J,Tian GY.Studies on synthesis and antitumor activity of phosphorylated Achyranthes bidentata polysaccharide(P-AbPS)[J].Chin J Chem,2002,20(11):1406-1410.
[3]Umemura K,Yanase K,Suzuki M,etal.Inhibition of DNA topoisomerases I and II,and growth inhibition of human cancer cell lines by a marine microalgal polysaccharide[J].Biochem Pharmacol,2003,66:481-487.
[4]Ramesh HP,Tharanathan RN.Carbohydrates—the renewable raw materials of high biotechnological value[J].Crit Rev Biotechnol,2003,23(2):149-173.
[5]Hanna DK,Michael PM,Bruce JP.Modifications and applications of the Acinetobactervenetianus RAG-1 exopolysaccharide,the emulsancomplex and its component[J].Appl Microbiol Biotechnol,2008,81:201-210.
[6]韩勇,黄晓波,董岳峰,等.根瘤菌N613胞外多糖发酵条件及抗肿瘤作用研究[J].微生物学通报,2007,34(5):909-913.
[7]Zhao LQ,Chen YL,Ren S,etal.Studies on the chemical structure and antitumor activity of an exopolysaccharide from Rhizobium sp.N613 [J].Carbohydr Res,2010,345(5):637-643.
[8]魏国琴,吕利华,陈艳丽,等.小分子 Rhizobium sp.N613胞外多糖的制备及其抗肿活性[J].微生物学通报,2011,38(5):743-749.
[9]邓勇,呙琴.马铃薯羧甲基淀粉制备工艺的研究[J].中国粮油学报,2001,16(1):43-45.
[10]孙元琳,崔武卫,顾小红,等.傅里叶变换红外光谱法测定当归果胶多糖的酯化度[J].光谱学与光谱分析,2009,29(3):682-685.

