早期肠内营养对老年胃癌患者术后免疫功能的影响
钟武装 肖丽萍 蔡敏捷 (广州军区广州总医院干部病房二科,广东 广州 510010)
老年胃癌患者由于存在肿瘤消耗、饮食摄入减少、基础营养状况较差、术后禁食及手术创伤等原因导致机体处于营养状态不良及高分解代谢状态〔1〕,直接影响患者伤口愈合;免疫功能处于受抑制状态,不仅延长患者恢复时间,而且容易导致各种并发症的发生,影响老年胃癌患者术后。因此,术后采用营养支持改善患者营养状态已成为共识。然而,采用肠内营养还是肠外营养仍存在争议。本文对老年胃癌患者术后分别采用早期肠内营养支持及肠外营养,比较两种营养支持方式对胃癌术后免疫功能的影响。
1 资料与方法
1.1 一般资料 纳入2009年1月至2012年1月我院收治的老年胃癌患者64例,男38例,女26例,平均年龄(67.5±5.8)岁。以上患者入院后明确诊断为胃癌,无合并心肺功能、肝肾功能及内分泌系统严重疾病,具备手术条件,行胃癌根治术。将以上患者随机均分为两组,其中早期肠内营养组(EEN组)32例,男18例,女14例,平均年龄(68.2±6.4)岁;肠外营养组(PN组)患者32例,男20例,女12例,平均年龄(67.1±5.0)岁。两组患者性别、平均年龄、体重指数、病情等一般资料无统计学差异(P>0.05),具有可比性。
1.2 营养方案 两组患者均行胃癌根治术,并根据不同组别采用不同营养支持方式。
EEN组:术前将营养管插入胃管并用4号线固定。术中通过胃管将营养管置入胃肠吻合口的远端并固定。术后第1天注入等渗盐水250 ml,并观察患者血流动力学状况。若情况稳定,无腹痛、腹胀,则开始输注肠内营养液(能全素,荷兰纽迪希亚,国药准字:J20040077)。通过营养液泵控制滴入速度,起始滴速维持在50 ml/h,并观察患者有无不良反应;若患者无不适可于次日逐渐提高滴速至100~120 ml/h。术后第2天输注总量为500 ml左右,术后第3天增加至1 000 ml,此后可增加至2 000 ml左右。待患者可经口进食后逐渐降低营养液输注量,保证每日摄入热量不低于25 kJ/kg。若有液体或能量输入不足,通过静脉补充。
PN组:术前选择颈内静脉置入营养管。术后第2天开始营养支持。营养液成分包括与EEN组等氮等热量的复方氨基酸,脂肪乳,葡萄糖,水溶性维生素,脂溶性维生素,微量元素,维生素K,胰岛素。每日营养液总输入量在3 L左右。两组患者共营养支持7 d。
1.3 观察指标 分别于术前1 d,术后1 d及术后第14天检测如下指标:(1)细胞免疫:包括 CD3+,CD4+,CD8+,CD4+/CD8+,NK细胞。(2)体液免疫:包括 IgA,IgG,IgM。(3)肿瘤标志物:包括 CEA,CA125,CA19-9。
1.4 统计学方法 采用SPSS13.0统计软件包进行分析,计量资料以s表示,应用t检验。
2 结果
2.1 两组患者细胞免疫检测结果比较 两组患者术后第1天细胞免疫水平较术前有所下降,于术后第14天恢复。两组患者在术前及术后第1天细胞免疫水平差异无统计学意义(P>0.05)。EEN 组术后第 14天 CD3+,CD4+,CD8+,CD4+/CD8+,NK细胞水平均明显高于PN组(P<0.01)。见表1。
2.2 两组患者体液免疫检测结果比较 两组患者术后第1天体液检测结果较术前呈下降趋势,并于术后第14天恢复。两组患者在术前与术后第1天体液免疫检测结果无明显差异(P>0.05)。EEN组术后第14天IgA,IgM、IgG水平均明显高于PN组(P<0.01)。见表2。
2.3 两组患者肿瘤标志物检测结果比较 两组患者术后肿瘤标志物检测结果较术前呈下降趋势。EEN组与PN组在术前及术后第1天肿瘤标志物检测结果差异无统计学意义(P>0.05)。术后第14天时EEN组肿瘤标志物水平明显低于PN组(P<0.01)。见表3。
表1 两组患者细胞免疫检测结果( s,n=32,%)
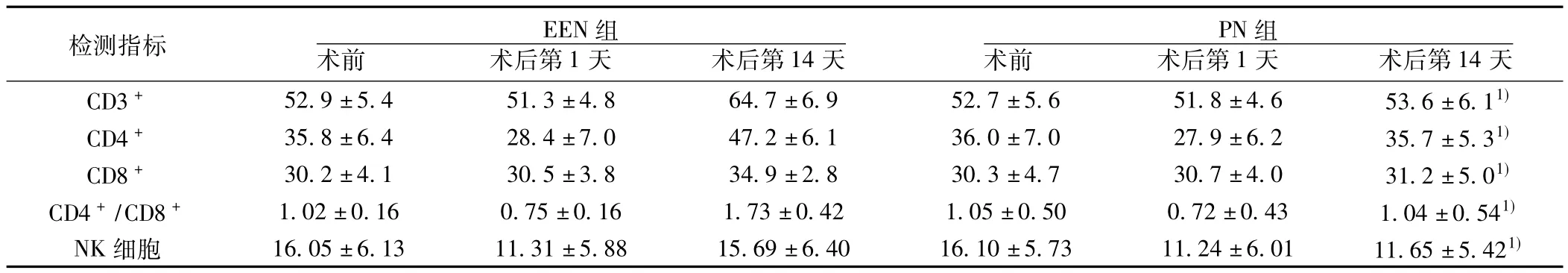
表1 两组患者细胞免疫检测结果( s,n=32,%)
与EEN组同一时点比较:1)P<0.01;下表同
检测指标 EEN组术前 术后第1天 术后第14天PN组术前 术后第1天 术后第14天CD3+ 52.9±5.4 51.3±4.8 64.7±6.9 52.7±5.6 51.8±4.6 53.6±6.11)CD4+ 35.8±6.4 28.4±7.0 47.2±6.1 36.0±7.0 27.9±6.2 35.7±5.31)CD8+ 30.2±4.1 30.5±3.8 34.9±2.8 30.3±4.7 30.7±4.0 31.2±5.01)CD4+/CD8+ 1.02±0.16 0.75±0.16 1.73±0.42 1.05±0.50 0.72±0.43 1.04±0.541)NK细胞 16.05±6.13 11.31±5.88 15.69±6.40 16.10±5.73 11.24±6.01 11.65±5.421)
表2 两组患者体液免疫检测结果(s,n=32,g/L)
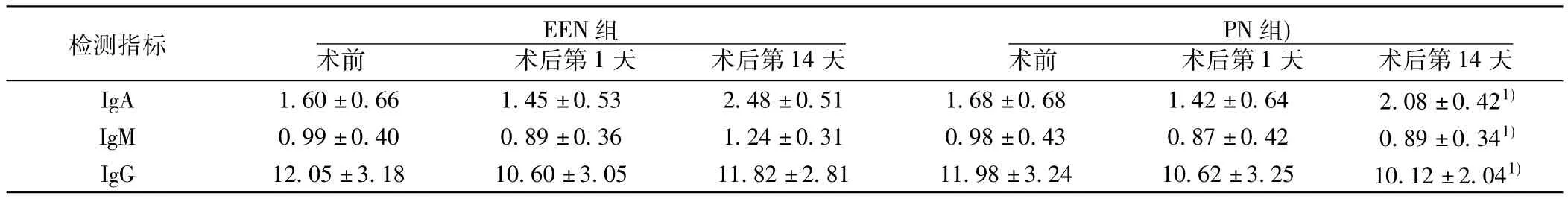
表2 两组患者体液免疫检测结果(s,n=32,g/L)
检测指标 EEN组术前 术后第1天 术后第14天PN组)术前 术后第1天 术后第14天IgA 1.60±0.66 1.45±0.53 2.48±0.51 1.68±0.68 1.42±0.64 2.08±0.421)IgM 0.99±0.40 0.89±0.36 1.24±0.31 0.98±0.43 0.87±0.42 0.89±0.341)IgG 12.05±3.18 10.60±3.05 11.82±2.81 11.98±3.24 10.62±3.25 10.12±2.041)
表3 两组患者肿瘤标志物检测结果对比( s,n=32)
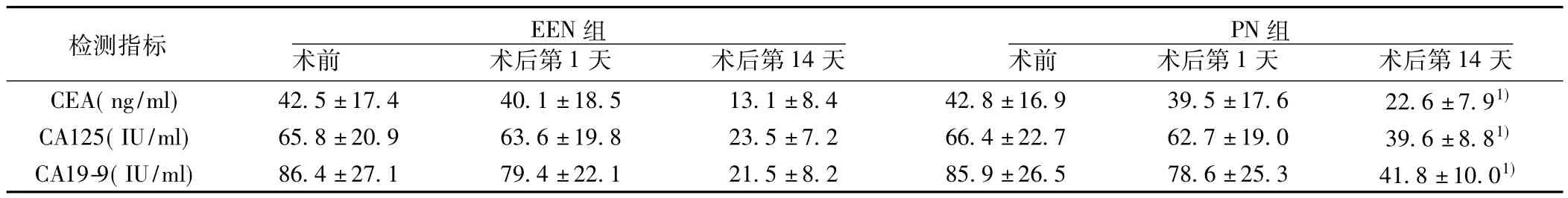
表3 两组患者肿瘤标志物检测结果对比( s,n=32)
检测指标 EEN组术前 术后第1天 术后第14天PN组术前 术后第1天 术后第14天CEA(ng/ml)42.5±17.4 40.1±18.5 13.1±8.4 42.8±16.9 39.5±17.6 22.6±7.91)CA125(IU/ml)65.8±20.9 63.6±19.8 23.5±7.2 66.4±22.7 62.7±19.0 39.6±8.81)CA19-9(IU/ml)86.4±27.1 79.4±22.1 21.5±8.2 85.9±26.5 78.6±25.3 41.8±10.01)
3 讨论
胃癌属于消化系统最常见的恶性肿瘤,发病人群多在50~80岁之间,以老年人较为常见。治疗本病最主要的方法是采用胃癌根治术。然而,由于胃癌患者术前多存在饮食摄入减少,疾病消耗,且患者多为老年人,自身常存在营养不良,加之手术创伤、术后禁食等因素,术后机体处在高代谢状态,使原存在的营养不良状况加重,导致术后创伤愈合缓慢,容易合并感染或器官衰竭等〔2〕,影响患者预后。胃癌术后采用营养支持,改善患者术后营养状态,提高机体免疫力以改善预后已成为现今胃癌治疗的共识〔3,4〕。
现今营养支持方法主要包括肠内营养及肠外营养两种。肠外营养曾作为临床常用的营养支持方式,但存在较大弊端。缺点在于:(1)需选择锁骨下静脉或颈内静脉穿刺置入营养管,在穿刺及输注营养液过程中增加感染风险〔5〕。(2)长期肠外营养使肠道缺少食物刺激,肠道缺乏消化运动,引起肠黏膜萎缩,屏障功能减退,菌群失调,增加了因细菌移位引起的肠源性感染的风险;而缺少食物刺激同时导致胆囊收缩素分泌量降低,继而引发肝脏功能损害〔6〕。(3)肠外营养费用较高,增加患者负担。
近年来研究结果表明,胃肠功能在术后数小时内即可恢复〔7〕。因此,术后早期(24 h)内即可对患者采用肠内营养支持。此外,Peter等〔8〕研究表明采用肠内营养有利于促进肠道功能恢复,维持肠道黏膜屏障完整性,降低肠源性感染风险。Shastri等〔9〕研究认为,采用在胃肠吻合口处放置营养管并未影响术后并发症及病死率。这些研究结果均为老年胃癌患者术后采用早期肠内营养支持提供了理论依据。
Yoshida等〔10〕研究认为肿瘤患者可因营养不良及手术创伤导致免疫功能受抑制本文结果与之相符。细胞免疫中,T淋巴细胞亚群比例的稳定性可反映机体细胞免疫功能状况,而NK细胞对靶细胞具有杀伤作用,同时调节免疫功能。因此,本研究认为,EEN较PN可更好改善胃癌患者术后营养状态,促进术后免疫功能恢复。同时,肿瘤标志物的降低也提示采用EEN可更好改善胃癌患者预后,提高患者机体抵抗肿瘤能力。
笔者总结临床经验认为,由于老年胃癌患者术后肠道多存在水肿,早期肠道功能较差,因此,在输注营养液之注入生理盐水,以促进肠道蠕动,并观察患者有无不适,当确认患者肠道功能恢复时再输注营养液,并循序渐进,营养液输注量应由少逐渐增加,输注速度由低速开始调整增加,注意保持营养液温度。
综上所述,采用EEN可改善老年胃癌患者术后营养状态,促进细胞免疫功能恢复,提高机体对抗肿瘤的能力,可作为胃癌术后营养支持的首选方式。
1 王永森,陆贞凯,余一朗,等.早期肠内营养对胃癌患者术后细胞免疫功能和肿瘤标志物的影响〔J〕.大家健康,2011;5(11):1-3.
2 田志强,吴 涛,陆春雷,等.胃癌术后早期肠内营养与肠外营养的对照研究〔J〕.中华实用诊断与治疗杂志,2012;26(10):1028-30.
3 耿 勇,周 波.胃癌术后患者早期肠内营养支持的临床价值〔J〕.现代肿瘤医学,2012;20(10):2127-9.
4 Ogawa K,Hirai M,Katsube T,et al.Suppression of cellular immunity by surgical stress〔J〕.Surgery,2000;127(3):329-36.
5 黄国强,于吉人,冯永生,等.老年胃癌患者术后早期肠内与肠外营养的比较〔J〕. 中国老年学杂志,2012;32(8):1839-40.
6 王旭林,王红梅,牟永华,等.早期肠内营养对老年胃癌病人术后血清SOD-MDA和T细胞免疫功能的影响〔J〕.肠外与肠内营养,2012;19(2):74-7.
7 张 宏,刘晓伟.胃癌术后早期肠内与肠外营养支持对患者术后营养状况的影响研究〔J〕.现代中西医结合杂志,2012;21(35):3934-5.
8 Peter JV,Moran JL,Phillips-Hugher J.A meta analysis of treatment outcomes of early versus early parenteral nutrition in hospitalized patients〔J〕.Crit Care Med,2005;33(1):213-20.
9 Shastri YM,Shirodkar M,Mallath MK,et al.Endoscopic feeding tube placement in patients with cancer:a prospective clinical audit of 2005 procedures in 1866 patients〔J〕.Aliment Pharmacol Ther,2008;27(8):649-58.
10 Yoshida S,Kaibara A,Ishibashi N,et al.Glutamine supplementation in cancer patients〔J〕.Nutrition,2001;17(9):766-8.

