改良大鼠急性心肌梗死模型的制备方法
许官学 石 蓓 盛 瑾 郭小英 杨文笔 雷艳娟
(遵义医学院附属医院心血管内科,贵州 遵义 563003)
动物模型是研究人类急性心肌梗死(AMI)的重要工具〔1〕。研究中结扎冠状动脉是制作AMI动物模型的常用方法。其中SD大鼠因来源方便、价格便宜、易于饲养等优点,常被选用制作AMI模型。然而,在AMI模型建立中肺损伤、冠状动脉左前降支定位错误、麻醉和呼吸机应用不当等原因,可造成SD大鼠死亡率过高甚至制模失败。本研究针对如何成功建立大鼠AMI模型并降低其死亡率方法进行评估分析。
1 材料与方法
1.1 实验动物 6周龄雄性SD大鼠,体重200~250 g,重庆医科大学实验动物中心提供。
1.2 方法
1.2.1 SD大鼠AMI模型的建立 42只SD大鼠称重,戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉。将麻醉、备皮后的大鼠仰卧位固定于实验用木板上,常规消毒铺巾,颈部正中切开皮肤,甲状腺下方1~2个气管环状软骨切开气管,插管,连接呼吸机(潮气量3 ml/100 g;呼吸频率100次/min;呼吸比1∶3)。胸骨左缘心脏搏动明显处纵行切开皮肤约3 cm,经左第3、4肋间进入胸腔。结扎左冠状动脉前降支。利多卡因1~2滴滴于心脏表面预防心律失常。2/0缝线关闭胸腔。动物苏醒后拔除气管插管,8/0无损伤缝合针闭合气管。2/0缝线缝合颈部皮肤。皮下注射2~3 ml无菌生理盐水。大鼠先放入清洁鼠笼,站灯加热。温度维持在35℃ ~37℃〔3〕。大鼠完全清醒后转至普通鼠笼中,置于27℃空调房内正常饲养。术后连续注射青霉素钠3 d(40 万 U/d),防止切口感染〔3〕。
1.2.2 AMI模型的鉴定
1.2.2.1 心电图 心电图针形电极在麻醉生效后插入大鼠四肢皮下。观察术前和术后各导联ST段改变情况。AMI模型成功标志为心电图肢导R波振幅明显升高,Ⅰ、aVL导联ST段弓背向上抬高大于0.1 mV并持续0.5 h以上。
1.2.2.2 超声心动图检查 大鼠AMI后4 w,再次腹腔注射戊巴比妥(30 mg/kg)麻醉,用Philips多功能超声诊断仪在胸骨旁观察心室壁厚度改变情况。
1.2.2.3 形态观察 术后2只大鼠在未关胸时,沿胸腹部交界,切开皮肤至两侧前后肢连线处,于胸廓下缘切开肌肉进入腹腔,前正中线处切开肌肉向下沿长切口达膀胱水平,将肌肉向两侧牵拉,暴露腹腔。切开膈肌,注意不要损伤肺组织及前正中线旁胸廓内动脉,眼科剪沿前后肢连线剪开皮肤及胸廓,达近前肢处。向前上方抬起胸廓前壁同时,分离心脏与胸廓前壁粘连,完全暴露跳动心脏及大血管。腹腔内肠管向右方推移,可见腹后壁前方左肾及左肾动静脉,用5 ml注射器于左肾静脉内缓慢注入约3 ml亚甲蓝,观察心肌血运情况。
术后4 w,颈椎脱臼法处死大鼠,从大鼠剑突下剪开一个弧形切口,切口两端延伸至大鼠腋下,小心剪开膈肌后即可看到跳动的心脏〔4〕,用无菌纱布轻轻将心脏从周围粘连组织中剥离,离断主动脉根部,迅速取出心脏。用生理盐水及磷酸盐缓冲液(PBS)各冲洗3遍,冲洗干净心脏内积血。观察心脏的外形变化,与相同月龄及大小的大鼠心脏比较。
1.2.2.4 组织病理学鉴定 术后4w取出心脏,冲洗净心脏内积血后去除心房、大血管及心脏外结缔组织等。10%甲醛固定,送病理切片作苏木素-伊红(HE)染色及Masson染色观察。
2 结果
2.1 大鼠存活率 SD大鼠40只,术中死于大出血1支,死于心室颤动和恶性心律失常1只,存活率为95%。继续观察饲养4 w,1只死于不明原因,4 w时存活率为92.5%。
2.2 肉眼观 SD大鼠冠状动脉左前降支结扎后数分钟可见结扎线以下左室前壁及心尖部心肌组织由红色变为暗红或紫红色,并伴随心肌运动减弱或消失。此时经大鼠左肾静脉注入亚甲蓝可见正常血供心肌蓝染,而梗死区域心肌组织无蓝染现象。术后4 w,结扎线以下左室前壁心肌呈典型室壁瘤表现,左室壁变薄,呈半透明状,局部随心脏搏动呈反常搏动。
2.3 超声心动图检查 正常组SD大鼠心脏超声心动图可见左室心肌厚度均匀,舒缩运动正常。AMI后4 w时超声心动图下见梗死区域心室壁呈室壁瘤样改变,室壁厚度菲薄,局部向外扩张,并随心室舒缩活动呈明显反常搏动。见图1。
2.4 心肌组织HE染色 术后4 w时,光镜下见结扎线以上非心肌梗死区心肌细胞较正常对照组代偿性肥大,细胞横纹及闰盘清晰,纤维结构清晰、排列整齐,无炎症细胞浸润;而梗死区域心肌细胞因缺血出现坏死,坏死心肌表现为纤维化、结构排列紊乱。心肌梗死区与非梗死区界限明显,在交界处组织中可见少量炎症细胞浸润。见图2。
2.5 心肌组织Masson染色 左心室梗死区胶原纤维显著增多,呈条索状,部分胶原纤维融合。梗死区与非梗死区边界清晰,可见毛细血管增生。见图3。
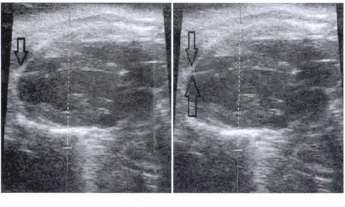
图1 AMI 4 w后心脏长轴超声心动图心室前壁改变

图2 各组心肌组织HE染色

图3 正常心肌masson染色
3 讨论
AMI动物模型的建立方法目前国内外文献报道众多,方法已经基本成熟,但手术成功率及老鼠死亡率等不尽相同。倪新海等〔5〕建立的Wistar大鼠AMI模型600只,术后24 h存活率70%,术后8 w存活率62%。刘元生等〔6〕报道AMI 3 w以上大鼠存活率为78.1%:Sia等〔8〕及高琴等〔9〕报道 AMI大鼠术后24 h成活率分别为49%和52.5%。本研究AMI大鼠存活率较上述报道明显提高。
3.1 实验动物的选择 目前国内外常用的AMI模型的动物包括小鼠、大鼠、兔、小型猪、犬等。相对于其他实验动物,大鼠有以下优势:种群纯正,个体变异性小,价格低廉,基因与人类相似度高,可复制出多种人类疾病模型。在心血管疾病研究方面,因为大鼠的冠状动脉系统相对稳定、变异性低、侧支循环少,是冠脉疾病模型制备及研究的良好动物模型来源〔9~11〕。为了能够建立稳定、可靠及重复性好的AMI模型,大鼠的选择尽量保持种族、体重、性别、月龄的一致性,达到AMI模型标准化。
3.2 麻醉方法的选择 对大鼠的麻醉方法常见的有腹腔注射、静脉注射、吸入麻醉三种方法,试验中用于麻醉药物有戊巴比妥、水合氯醛、氯胺酮、乌拉坦、阿托品、利多卡因等。其中戊巴比妥钠溶液或水合氯醛通过腹腔注射给药可以达到理想的麻醉效果〔11〕,优点为给药途径便利、麻醉起效快、麻醉深度适中。但在具体应用中应当警惕麻药剂量的选择,应当按体重计算,从低剂量开始给药,如10%水合氯醛按照300 mg/kg为起始量,5~10 min起效,若此时麻药仍未起效,可按50 mg/kg逐量追加给药。反之,大鼠容易发生麻醉过深,导致术后大鼠复苏时间延长,脱离呼吸机困难,此外还可引起实验动物肺水肿、感染、酸碱失衡、呼吸肌麻痹、气道分泌物过多而窒息,增加了大鼠围术期死亡率。
3.3 气道建立的方法 有少量报道在制备AMI模型过程中不予气管插管〔14〕,在很短的时间迅速开胸并行冠脉结扎术。此方法在实际应用中有大量不易克服的技术弊端:技术含量高、操作难度大、围术期存活率低。现在AMI模型制备中多用小动物呼吸机维持呼吸,相对不受时间限制,术者可仔细操作,从而使AMI成功率及围术期死亡率明显下降。现在较常用的大鼠气管插管方法有经口气管插管和气管切开插管。经口气管插管最符合生理状态,且对动物机体损伤小,但技巧难度较大,对术者要求高,需要长时间训练,在操作中若反复插管刺激,会导致气道分泌物增加,气道阻塞、窒息,并可出现喉头损伤、误插入食管等并发症,严重时导致大鼠死亡〔15〕。本实验选用气管切开法,能在术中直视操作,短时间训练及可熟练操作。需要注意的是,该方法术后可能发生气道分泌物过多及少量积血堵塞气道,致窒息死亡。因此术中应避免损伤血管神经和腺体,及时清理术区积血,术后用50 ml注射器接16G静脉留置针通过抽吸吸出气管内痰液及血液,畅通呼吸道,提高存活率。
气管插管呼吸机辅助呼吸开始后,从开胸结扎左前降支冠脉到关胸过程中有可能因未及时发现气管插管脱落、堵塞致动物死亡。因此术中需注意:①麻醉后大鼠肢体、头部及气管插管后均要稳妥固定,防止术中人为原因引起动物滑动;牢固固定手术台板,避免因动物或手术台板活动造成气管插管拽脱;②气管切开过程中需仔细操作,避免唾液腺体及气管旁血管损伤,防止血液及分泌物流入气管管腔内阻塞气管及气管插管;③保持气管插管通畅,避免因插管弯折致堵塞。
3.4 开胸方法的改良 本文结合文献报道作了部分改良:手术切口定位在胸骨左缘心脏搏动处,纵行切开皮肤长约3 cm,钝性分离皮下结缔组织和肌肉(胸大肌斜行,胸小肌呈纵行),不要切断胸大小肌。充分暴露第3、4肋间后,眼科剪平行肋骨方向分离肋间肌,直至进胸,术中注意避免过分靠近中线及侧方,以防损伤胸骨旁胸廓内动脉及肺组织。进胸后换闭合小止血钳,钝性分离肋间肌,切断第5肋。眼科镊沿心脏顶部或底部小心提起心包并撕开心包膜,注意不要损伤左侧心包中走行的左侧膈神经及伴行血管。通过方法改良,能在术中充分暴露心脏及大血管,并减少出血。因未切断胸大、小肌,术后关胸时,胸大小肌能从不同方向原位覆盖肋间切口,并与皮肤切口方向互相交错,有效防止术后切口漏形成气胸。
3.5 冠脉结扎部位 AMI结扎部位的选择是整个模型的重点也是难点,尤其是左冠状动脉前降支的定位及结扎是本模型的关键。开胸后能够充分暴露心脏前壁及大血管是下一步结扎冠脉的基础。综合文献报道及自身实践操作,进针标志为左冠状动脉主干左心耳下方2 mm,肺动脉圆锥旁出针,此时不要急于结扎,可暂时轻用力提起缝线两端,保持张力,在此过程中动态观察心电图变化,必须见到ST段弓背向上持续抬高及心肌表面颜色发白,左室收缩活动减弱,初步判断冠脉前降支确切在缝线内后再进行打结结扎。如没有以上表现,或因局部刺激后血管短暂痉挛心肌变苍白,但很快恢复正常,则表明未能成功将左前降支冠脉缝扎,立即抽出缝线,重新仔细辨认解剖标志后再次进针。结扎的深度约0.5 mm、宽度约2~3 mm,过多会导致大面积心肌因机械变性发生梗死面积过大,可导致术后心功能过差,甚至引起大鼠死亡,反之不易一次结扎成功,也可造成缝线撕脱引起大出血。本组动物有一只即因此原因出现大出血致死。在结扎过程中及结扎成功后可能会有AMI后心律失常出现,且大多是恶性室性心律失常,如室早二联律、心室颤动,用注射器将少量利多卡因滴入心脏表面可防治恶性室性心律失常。针对术后可能出现的心动过缓,在心脏表面滴注阿托品,可提高心率,同时减少气管内分泌物,建议常规备用。
3.6 脱机 不管是人类还是动物,术后停用呼吸机辅助呼吸,恢复自主呼吸都是手术的难点。实验中需针对不同动物个体做到个体化处理。不同个体老鼠对麻醉药物反应不一,因此术中麻醉深度不尽相同,术后需呼吸机辅助呼吸时间变化较大。当术后大鼠出现明显自主呼吸并有肢体疼痛反射活动后,可试停呼吸机,停机前注意先用止血钳夹住呼吸机的出气口管2~3个呼吸周期,待肺充分扩张后将止血钳松开,然后再夹住呼气口管,观察是否有胸廓起伏。若有自主呼吸可顺利脱机。如脱机后出现呼吸缓慢,数分钟无改善,须立即重新插管并联接呼吸机,再次呼吸机辅助呼吸。
3.7 手术后措施 术后保暖,防止舌后坠,应用抗生素,保持饲养环境卫生,保证饲料充足等措施可以有效预防术后感染、窒息、免疫力低下所致的死亡,所以不容忽视。
1 Utgens E,Daemen MJ,de Muinck ED,et al.Chronic myocardial infarction in the mouse:cardic structural and functional changes〔J〕.Cardiovasc Res,1999;41(3):586-93.
2 施新猷.医学动物实验方法〔M〕.北京:人民卫生出版社,1980:101.
3 孙敬方.动物实验方法学〔M〕.北京:人民卫生出版社,2001:369.
4 Fox JG,Cohen BJ,Loew FM.Laboratory animal medicine〔M〕.New York:Academic Press,1984:31-2.
5 倪新海,郜朝晖,张宇清,等.提高心肌梗塞一心衰大鼠模型动物存活率的实验研究〔J〕.中国实验动物学杂志,1999;9(4):206-10.
6 刘元生,陈运贞.慢性心肌梗塞大鼠实验模型〔J〕.重庆医科大学学报,2002;27(2):153-5.
7 Sia YT,Parker TG,Tsoporis JN.Long-term effects of carvedilol on left ventricular function,remodeling,and expression of cardiac cytokines after large myocardial infarction in the rat〔J〕.J Cardiovasc Pharmacol,2002;39(1):73-87.
8 高 琴,关瑞锦.充血性心力衰竭大鼠模型的制作及意义〔J〕.心血管康复医学杂志,2004;13(1):27-30.
9 Kajstura J,Liu Y,Baldini A,et al.Coronary artery constriction in rats:Necrotic and apoptotic myocyte death〔J〕.Am J Cardiol,1998;82(5A):30-41.
10 华 平,熊利华,张 华,等.骨髓间充质干细胞移植重建大鼠缺血心肌的实验研究〔J〕.中华显微外科杂志,2004;27(2):117-9.
11 李亚辉,何建国,乔 木,等.直视下行大鼠气管插管的改良方法〔J〕.中国实验动物学杂志,2000;10(2):123-5.

