老年终末期肾脏病患者血管钙化相关危险因素
李 相 邹洪斌 于金宇 刘 思 张 立 (济宁医学院附属医院肾内科,山东 济宁 272029)
心脑血管疾病是终末期肾病(ESRD)血液透析患者死亡的主要原因,其发生率高达60%,是普通人群的10~20倍;其中因冠状动脉阻塞致死的发生率是正常人的2~5倍〔1〕,而血管钙化又是老年人心脑血管疾病发生的主要关联性因素。引起血管钙化的因素中除高血压、糖尿病等传统因素,还有钙磷代谢、氧化应激等非传统因素。各因素之间互为因果,通过相同或不同的机制互相影响、互相叠加,进一步加速血管钙化及其他重要器官衰竭。本文拟观察ESRD老年患者血管钙化的发生、发展相关因素。
1 对象与方法
1.1 研究对象 选择吉林大学第一医院肾内科慢性肾脏病(CKD)5期年龄>60岁并需行上肢动静脉内瘘的住院患者59例,男42例,女17例,男女比例为2.47:1,平均年龄(68.25±7.17)岁。原发病因为慢性肾小球肾炎30例(50.8%),糖尿病肾病7例(11.9%)、高血压肾病5例(8.5%)、慢性间质性肾炎5例(8.5%)、其他及原因不明确12例(20.3%,其中包括紫癜性肾炎、系统性小血管性肾病、缺血性肾病、ANCA相关性血管炎性肾病各1例)。
1.2 方法 患者均行头静脉-桡动脉端侧吻合脉内瘘,术中取桡动脉组织少许(0.1 cm×0.1 cm)。去除血管外脂肪和结缔组织,生理盐水轻柔洗涤,清除管腔内残余的血细胞,避免损伤内膜和管壁。用10%中性甲醛溶液固定24 h后,脱水、透明、浸腊、石蜡包埋、切片(厚度3 μm)、脱蜡后分别进行HE染色、硝酸银(Von Kossa)染色,观察动脉钙化程度,并根据钙盐沉积情况分级。将血管钙盐沉积的程度分为0~4级〔2〕。0级:无钙盐沉积;1级:点状沉积;2级:单个节段钙盐沉积;3级:多部位钙盐沉积;4级:弥漫、环绕管壁的沉积,并将<1级定义为无钙化;1~2.5级为轻、中度钙化;>2.5级为重度钙化。每只标本染3张切片,取其平均值。所得结果与一般资料、化验指标及心脏彩超结果进行比较和统计学分析,最后得出血管钙化的危险因素。
1.3 统计学方法 使用SPSS18.0统计软件,正态分布计量资料用单因素方差分析,组间两两比较进行LSD检验或Dunnett t检验。计数资料进行χ2检验。偏态分布连续性计量用秩和检验(Kruskal-Wallis法)。采用有序多分类回归分析法分析血管钙化的危险因素。
2 结果
2.1 血管钙化与一般资料 重度钙化组9例、中度钙化组10例、轻度钙化组21例,无钙化组19例,4组间男女比例差异无统计学意义(P>0.05)。无钙化组年龄明显小于轻度钙化组、中度钙化组、重度钙化组(P<0.01),但轻、中、重三钙化组间差异无统计学意义(P>0.05)。59例患者中,有长期高血压病史患者占76.27%,组间总体差异无统计学意义(P>0.05),轻度钙化组与无钙化组之间比较,具有统计学差异(P<0.05)。长期吸烟患者35.59%,组间比较具有显著差异(P<0.01)。长期饮酒患者占13.79%,其中组间总体,各组间两两比较,无统计学差异(P均>0.05)。患者一般状况与患者血管钙化程度行Spearman相关分析得出结果,年龄、长期吸烟史、高血压病史呈显著正相关(P<0.01),与长期饮酒史无明显相关关系(P>0.05)。见表1。
2.2 血管钙化与实验室指标 4组间胆固醇、血磷、钙磷乘积、超敏C反应蛋白总体差异有显著性差异(P<0.01)。4组间低密度脂蛋白(LDL-C)、纤维蛋白原、血钙等差异显著(P<0.05),4组间血肌酐、尿酸、尿蛋白定量、甘油三酯、高密度脂蛋白(HDL-C)、血钾、血钠、血氯、二氧化碳结合力(LOSP)、总体差异无统计学意义(P>0.05)。见表2。
2.3 血管钙化与心脏彩超 4组间主动脉根部内径(ARD)、左室心肌重量(LVM)、左室短轴缩短率(FS)、射血分数(EF)有显著差异(P<0.01);4组间室间隔厚度(IVST)、左室舒张末径(LVDd)总体差异有统计学意义(P<0.05)。左室内径、右室内径、左室后壁厚度、相对室壁厚度、E峰、A峰等值总体差异无统计学意义(P>0.05)。见表3。
2.4 血管钙化相关因素有序多分类回归分析 血管钙化程度与年龄、长期吸烟史、高血压病史、胆固醇、纤维蛋白原、血磷、钙磷乘积、超敏C反应蛋白、呈显著正相关(P<0.01);与血尿酸、血钙水平呈正相关(P<0.05);与HDL-C呈负相关(P<0.05)。有序多分类回归分析显示年龄为ESRD患者血管钙化程度的危险因素(P<0.05)。见表4。
表1 4组一般情况比较(s)

表1 4组一般情况比较(s)
与无钙化组比较:1)P<0.01,2)P<0.05
变量 无钙化组 轻度钙化组 中度钙化组 重度钙化组 P值性别(男/女,n)218 10/9 15/6 9/1 8/1 0.098年龄(岁)41.89±14.72 53.95±13.771) 55.30±10.822) 59.56±15.561) 0.007高血压病史(年)2.00±3.02 6.26±8.952) 6.90±7.23 7.00±4.77 0.112吸烟史(年)7.52±2.15 19.27±3.841) 11.86±3.452) 8.30±3.67 0.007饮酒史(年)8.54±6.58 10.38±4.25 7.52±3.21 6.85±1.81 0.
表2 4组实验室指标比较(s)

表2 4组实验室指标比较(s)
与无钙化组比较:1)P<0.01,2)P<0.05;与轻度钙化组比较:3)P<0.05
变量 无钙化组(n=9)轻度钙化组(n=10)中度钙化组(n=21)重度钙化组(n=19)P值77钠(mmol/L)138.59±3.18 140.24±3.96 137.79±6.31 137.80±2.39 0.636氯(mmol/L)102.01±6.64 105.73±5.91 104.26±4.48 103.77±5.00 0.635 CO2CP(mmol/L)23.17±5.60 20.01±4.92 20.37±4.12 21.01±4.71 0.017超敏C反应蛋白(mg/L)3.21(2.02~5.23)3.80(1.69~7.54)12.64(4.90~134.75)1) 43.70(2.91~58.22)1) 0.000磷(mmol/L)1.37±0.44 2.23±0.701) 1.98±0.401) 2.22±0.501) 0.002钙(mmol/L)1.74±0.28 1.91±0.36 1.92±0.22 1.88±0.322) 0.028钙磷乘积 29.72±11.41 52.06±18.341) 45.02±12.882) 56.52±15.781) 0.007肌酐(μmol/L)834.63±338.98 1 050.97±541.27 920.24±527.99 768.53±196.54 0.318尿酸(μmol/L)292.74±158.22 305.57±120.34 326.60±130.92 415.22±122.842)3) 0.156尿蛋白定量(g/24 h)2.28±1.30 2.25±1.94 1.89±1.20 3.34±4.91 0.575 PTH(pg/ml)383.10±85.31 269.70±45.27 146.85±54.36 403.57±68.93 0.123 TG(mmol/L)1.45±0.73 1.55±0.692) 1.43±0.742) 2.18±1.032) 0.109 TC(mmol/L)4.27±1.45 4.23±1.171) 4.96±1.28 6.09±1.22 0.003 LDL-C(mmol/L)3.00±0.86 2.58±0.731) 2.65±0.782) 3.58±1.10 0.027 HDL-C(mmol/L)1.37±0.53 1.00±0.44 1.31±0.79 1.03±0.59 0.148纤维蛋白原(g/L)3.47±0.811)钾(mmol/L)4.78±0.95 4.70±0.94 4.64±0.69 4.76±0.80 0.0 3.75±0.83 4.08±0.69 4.38±1.02 0.046
表3 4组心脏结构及功能比较(s)

表3 4组心脏结构及功能比较(s)
与无钙化组比较:1)P<0.01,2)P<0.05;与轻度钙化组比较:3)P<0.01,4)P<0.05
变量 无钙化组(n=9)轻度钙化组(n=10)中度钙化组(n=21)重度钙化组(n=19)P值ARD(mm)29.26±1.76 33.24±3.401) 34.90±2.331) 33.78±3.031)0左房内径(mm)36.21±4.53 36.67±4.49 39.70±5.68 37.67±5.59 0.303右室内径(mm)19.05±2.12 20.38±2.87 19.90±3.60 20.00±2.06 0.483 IVST(mm)10.21±1.48 10.76±1.73 10.90±0.74 12.00±1.412)3) 0.038 LVDd(mm)46.79±3.97 48.71±4.82 52.30±6.382) 50.56±3.90 0.026左室后壁厚度(mm)9.79±1.58 10.10±1.41 10.70±1.49 9.896±1.70 0.485 LVM(g)191.38±42.27 219.44±59.97 259.19±54.541) 251.07±59.161) 0.006相对室壁厚度(mm)0.43±0.08 0.43±0.08 0.42±0.07 0.43±0.05 0.966 FS(%)35.79±3.71 34.19±4.58 28.90±3.451)4) 30.56±5.051)3) 0 EF(%)65.37±5.19 62.71±5.89 57.10±6.701)3) 58.56±6.191) 0.002 E峰 83.68±23.57 5.00±25.41 86.40±20.39 78.22±14.87 0.865 A峰 105.42±16.37 106.95±14.30 101.40±18.48 105.56±13.68 0.835
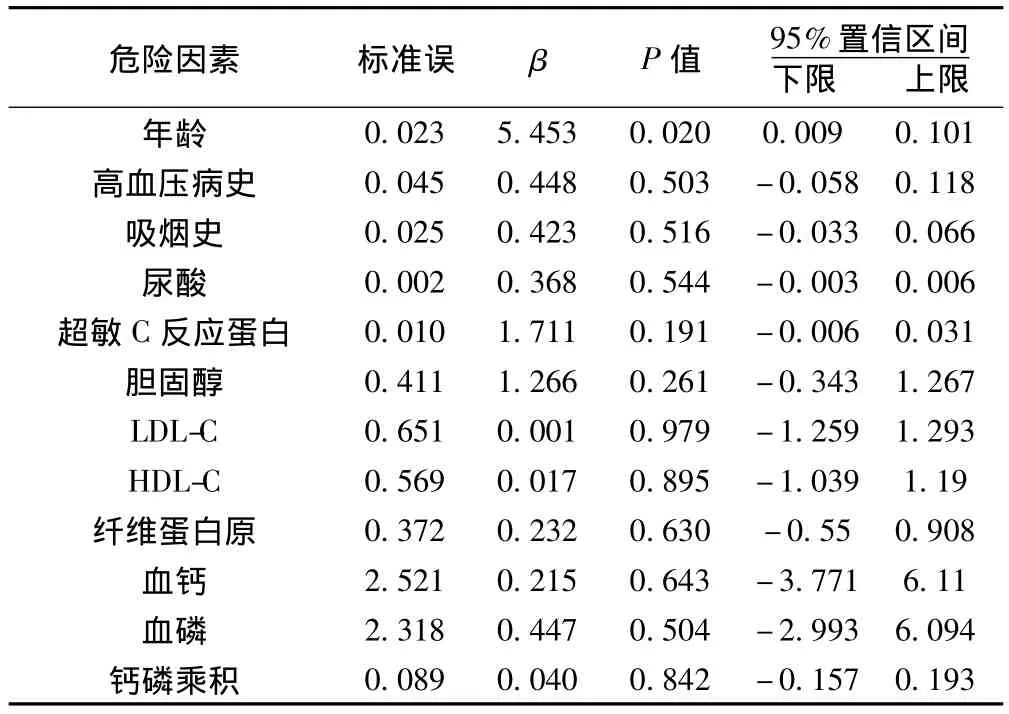
表4 老年患者桡动脉钙化程度危险因素有序多分类回归分析
3 讨论
血管钙化不仅与老年ESRD患者的心脑血管并发症的发生密切相关,还直接影响老年透析病人血液透析通路的建立及血透通路寿命。临床上,钙化严重的血管壁较无钙化患者弹性差、脆性大,行动静脉内瘘吻合术中常可见白色质硬颗粒,术后较无钙化患者更易出现管腔内血栓、吻合口不愈合等并发症。透析时较无钙化患者穿刺后出血更难控制,更易形成血肿、血栓等。本研究59例老年ESRD患者原发病因与西方国家所报道慢性肾衰竭病因构成中以糖尿病肾病为首要原因不同,与崔红云等〔3〕339例慢性肾衰竭糖尿病肾病114例(33.63%)居首位,慢性肾小球肾炎81例(29.90%)也不同。分析原因,可能与各研究的内容不同有关,因糖尿病肾病、高血压肾病等疾病并发症较多,临床症状较危重,本研究又设定了排除严重并发症等标准,可能导致入组ESRD患者原发病分布与既往流行病学统计有差异的原因。另外不排除统计样本量较小有关。
依赖的血管钙化是独立于血压及其他危险因素的。Al Humoud等〔4〕的研究也表明,对于透析时间不长的ESRD患者,年龄是血管钙化的危险因素。
心脏疾病并发症为老年ESRD患者主要死亡原因。有研究〔5〕发现心脏结构的几何学改变、动脉粥样硬化及周围动脉硬化三种心血管疾病在CKD患者中发生率较普通人高。肾功能减退易导致冠状动脉粥样硬化,明显增加心力衰竭病死率,引起缺血性心脏病以及脑血管疾病、外周血管疾病等。慢性肾衰竭与血管硬化相互影响,血管钙化可加重肾脏缺血,加速肾脏疾病进展,而肾功能全是动脉粥样硬化及血管钙化的危险因素。高血压、钠水潴留、贫血等为慢性肾衰患者主要临床症状。这些症状引起左室压力负荷过重,导致心室壁异常增厚,心腔增大,心室壁向心性或离心性肥厚。本研究中老年ESRD患者心脏结构以左心室的改变为主,主要表现为LVPWT增加、LVM增加、升主动脉内径增大等,这些改变与血管钙化程度呈正相关,支持了血管钙化是心脏结构改变的危险因素的结论。ESRD患者的心脏结构和功能受损,进一步加重血流动力学异常及心脏供血异常,反过来进一步加重肾脏损害,最终形成恶性循环。反映心脏结构和功能的超声心动图的各个指标在CKD患者病情进展的过程中出现相应的变化,说明心脏结构和功能的恶化与肾脏疾病的进展是相一致的。
钙磷代谢紊乱是非传统心血管疾病危险因素之一,有资料显示钙磷乘积的增加可导致冠状动脉、心肌等多组织的钙化沉积,并引起心血管组织的结构和功能异常〔6〕。主要机制可能为钙、磷诱导血管平滑肌细胞出现成骨细胞样的基因表达,并直接诱导转录因子-核心结合因子-1(Cbfa-1)等〔7,8〕的表达。体外研究也支持高磷在血管钙化中的作用。Jono等〔8〕的研究表明,体外培养血管平滑肌细胞时,当培养液的磷浓度达到210 mmol/L时,可以诱导血管平滑肌细胞出现钙化,进一步导致血管重塑和血管顺应性下降。甲状旁腺激素(PTH)为终末期肾脏疾病患者的一种心脏毒素,体内PTH的集聚可诱导心肌肥厚、心肌间质纤维化、增加心肌间质体积及心血管钙化等改变〔9,10〕,是ESRD患者心血管病变的主要原因之一。但也有学者认为PTH与血管钙化之间无明显相关关系〔9〕,或认为〔11〕可以抑制血管平滑肌的钙化。本研究结果支持钙磷代谢紊乱与血管钙化之间的关系。本研究表明PTH与血管钙化无明显相关一致,但不排除本研究样本量较小所致统计偏倚的有关。C反应蛋白作为一种非特异性炎症反应蛋白,是慢性炎症状态的最敏感而特异的指标。何朝生等〔12〕的研究发现在规律血液透析的尿毒症患者中C反应蛋白水平升高与心血管事件的发生率密切相关,是心血管事件的独立危险因子。本研究发现,超敏C反应蛋白与桡动脉钙化程度呈显著相关。这与陈观生等〔13〕利用CT检测60例维持性腹膜透析或血液透析的尿毒症患者的冠状动脉钙化情况,得出的冠状动脉钙化与C反应蛋白等因素密切相关的结论相符合,从而进一步证明机体微炎症状态在血管钙化发展中的作用。
1 Sarnak MJ.Cardiovascular complications in chronic kidney disease〔J〕.Am J Kidney Dis,2003;41(5):11-7.
2 Eguchi M,Tsuchihashi K,Takizawa H,et al.Detection of cardiac calcinosis in hemodialysis patients by whole-body scintigraphy with 99m-technetium methylene diphosphonate〔J〕.Am J Nephrol,2000;20(4):278-82.
3 崔红云,王宗谦,王准证.339例慢性肾衰竭的病因分析〔J〕.医学信息:手术学分册,2009;21(11):982-3.
4 Al Humoud H,Al-Hilali N,Ahmad AA,et al.Vascular calcification in dialysis patients〔J〕.Transplant Proc,2005;37(10):4183-6.
5 张 翥.慢性肾脏病的心血管并发症〔J〕.国外医学·泌尿系统分册,2004;24(3):402-5.
6 Capomolla S,Febo O,Gnemmi M,et al.(beta)-Blockade therapy in chronic heart failure:diastolic function and mitral regurgitation improvement by carvedilol〔J〕.Am Heart J,2000;139(4):596-608.
7 Moe SM,Duan D,Doehle BP,et al.Uremia induces the osteoblast differentiation factor Cbfa1 in human blood vessels〔J〕.Kidney Int,2003;63(3):1003-11.
8 Jono S,McKee MD,Murry CE,et al.Phosphate regulation of vascular smooth muscle cell calcification〔J〕.Circ Res,2000;87(7):E10-17.
9 戎 殳,叶朝阳,牛晓萍,等.血液透析患者心脏瓣膜钙化及其危险因素〔J〕.中华肾脏病杂志,2004;20(5):56-8.
10 Rostand SG,Drüeke TB.Parathyroid hormone,vitamin D,and cardiovascular disease in chronic renal failure〔J〕.Kidney Int,1999;56(2):383-92.
11 王政通,王 莉.终末期肾脏病患者血管钙化危险因素及其调节因子〔J〕.实用医院临床杂志,2001;8(5):168-71.
12 何朝生,史 伟,梁馨苓,等.尿毒症患者微炎症状况与心血管事件的相关性研究〔J〕.中华血液净化,2010;7(5):256-9.
13 陈观生,欣 洲,郑 磊,等.尿毒症透析患者冠状动脉钙化的相关因素分析〔J〕.海南医学,2006;17(10):5-7.

