氟喹诺酮类药物对动物源MRSA和MSSA的防耐药变异浓度比较
杨 帆,李淑梅,王沛珍,赵林静,何群力
2.河南科技学院,新乡 453003;Email:yangf77@163.com
耐甲氧西林金黄色葡萄球菌(Methicillin-resistantS.aureus,MRSA)和甲氧西林敏感的金黄色 葡 萄 球 菌 (Methicillin-susceptibleS.aureus,MSSA)是引起医院内感染和社区获得性感染的重要病原菌;同时也可引起动物的各种化脓性疾病。而且该病原菌可通过各种途径在人和动物之间传播,近年来研究报道耐药性的金黄色葡萄球菌(尤其是 MRSA)在动物和人之间传播呈现上升趋势[1-2],所以动物源MRSA引起了医学界的广泛关注。在治疗葡萄球菌感染时,无论是动物还是人,均使用抗生素。但随着抗菌药物的广泛使用,细菌耐药性日益严重,而且细菌耐药性可在不同的物种之间传播。目前在医学上基于 MIC(Minimal Inhibitory Concentration)的治疗方案可能会导致细菌中的突变亚群逐渐发展成为优势菌群,导致细菌发生耐药。据细菌耐药监测发现,一些抗生素对MRSA的最低抑菌浓度(MIC)向上漂移,细菌对其敏感性降低[3]。因此,如何合理应用抗菌药物、减少细菌耐药发生、防止耐药性在不同的物种之间传播一直是人们的研究的重点。
Zhao和Drlica在1999年提出了防耐药变异浓度(mutant prevention concentration,MPC)和突变选择窗(mutant selection window,MSW)理论,该理论从控制感染和防止细菌耐药突变株富集两方面考虑,为减少细菌耐药提供新的治疗策略[4-5]。关于对 MPC的研究,国内外学者开展了一些工作[6-7],但主要集中在一些模式菌株和人医临床分离敏感菌株,未见对动物源细菌的报到,也未见对MRSA和MSSA的MPC比较研究,为此本研究测定了4种氟喹诺酮类药物对动物源分离的MRSA和MSSA的MIC值和MPC值,比较各种氟喹诺酮类抗菌药物对细菌耐药突变体的选择能力,为兽医临床优化抗菌药物给药方案及限制耐药突变体选择性扩增提供依据,为兽医临床合理用药提供参考。
1 材料与方法
1.1 实验菌株 106株金黄色葡萄球菌来源于2010年4月至2010年10月河南科技学院兽医院临床分离株,其中牛源16株,猪源63株,禽源20株,犬源7株。经美国临床实验室标准化组织(CLSI)推荐的头孢西丁筛选试验检出21株为MRSA,85株 MSSA,冻存后-80。C保存,测定前复苏。质控菌株为ATCC29213(对苯唑西林敏感株)和ATCC43300(对苯唑西林耐药株)均购自中国药品生物制品检定所。
1.2 抗菌药物 环丙沙星(批号:130451-200703,含量:84.9% )、左氧沙星(批号:130455-200802,含量:97.2%)和加替沙星(批号:130518-200802,含量97.2%)标准品购自中国药品生物制品检定所;吉米沙星(含量:98.2% )由新乡佐今明药业有限公司提供。苯唑西林标准品购自中国药品生物制品检定所。
1.3 培养基 Muller-Hinton(M-H)肉汤和胰酶大豆琼脂、胰酶大豆肉汤为北京奥博星生物技术责任有限公司生产。
1.4 药物敏感性 参考文献[8],使用琼脂稀释法测定85株金黄色葡萄球菌对苯唑西林的MIC值。判断标准按照CLSI M100-S20中规定的标准,即金黄色葡萄球菌对苯唑西林的MIC值≥4μg/mL为耐药,MIC值≤2μg/mL为敏感。同时严格按照CLSI推荐的琼脂微量稀释法对各种药物的MIC进行测定,结果按2010版标准判读。质控跟随每批实验,以确保整个实验的准确性。
1.5 MPC的测定 参照文献报道的方法[9],将单个菌落接种于20mL MH肉汤中过夜培养,3 000 r/min离心后,再悬浮在200mL MH肉汤中,震荡培养6h离心后富集,将菌液浓度调整为3×1010CFU/mL。取100mL菌液均匀涂抹在含有抗菌药物的MH平皿上,每个浓度3个平皿,使每个药物浓度的细菌接种量约为1.5×1010CFU/mL。于37。C孵育72h测定,没有细菌生长的最低抗菌药物浓度即为MPC。
1.6 数据分析 根据测定的MIC及MPC结果,计算 MIC90(药物对90%菌株的 MIC)、MPC90、MPC/MIC比值(即选择指数SI);结合4种药物的药代动力学参数,推算给药后血药浓度Cmax>MPC90和MIC90的时间。
2 结 果
2.1 MSSA的MIC和MPC的测定 环丙沙星、左氧沙星、加替沙星和吉米沙星4种喹诺酮类药物对85株动物源性MSSA的MIC90值分别为1mg/L、0.5mg/L、0.25mg/L、0.125mg/L(见表1)。4种喹诺酮类药物 MICs≥2mg/L的菌株数分别为环丙沙星5株,左氧沙星6株,加替沙星0株,吉米沙星1株。4种药物的 MPC90值分别为4mg/L、2 mg/L、0.5mg/L、0.5mg/L。选择指数即 MPC90/MIC90比值分别为4、4、2、4。由此可见加替沙星防耐药突变能力优于其它3种药物。
2.2 MRSA的MIC和MPC的测定 4种喹诺酮类药物对21株MRSA的MIC值、MPC值均比对MSSA的高,环丙沙星、左氧沙星、加替沙星和吉米沙星 MIC90值分别为8mg/L、8mg/L、2mg/L、2 mg/L,MPC90值 分 别 为 128mg/L、64mg/L、16 mg/L、8mg/L(见表2)。选择指数(MPC90/MIC90)比值分别为16、8、8、4。由此可见在对 MRSA的防耐药突变能力方面,吉米沙星要强于其它3种药物。
2.3 4种氟喹诺酮类药物对动物源 MRSA和MSSA的比较 结合药代学参数,4种喹诺酮类药物对MRSA和MSSA的MIC/MPC的比较结果见表3,可见对MSSA,环丙沙星的MPC>Cmax,其余3种喹诺酮类药物的MPC<Cmax;对于MRSA,4种喹诺酮类药物MPC均>Cmax。结合血药峰值和半衰期,推算出常规用药推荐剂量的血药浓度维持在MIC90和 MPC90以上的时间。对 MSSA来说,4种喹诺酮对MSSA的血药浓度大于MIC90的时间顺序为加替沙星=吉米沙星>左氧沙星>环丙沙星,血药浓度大于MPC90的顺序为加替沙星>吉米沙星>左氧沙星>环丙沙星。对MRSA而言,用药后只有加替沙星血药浓度>MIC90维持8h,其余药物按推荐剂量血药浓度均达不到MIC90和MPC90值。
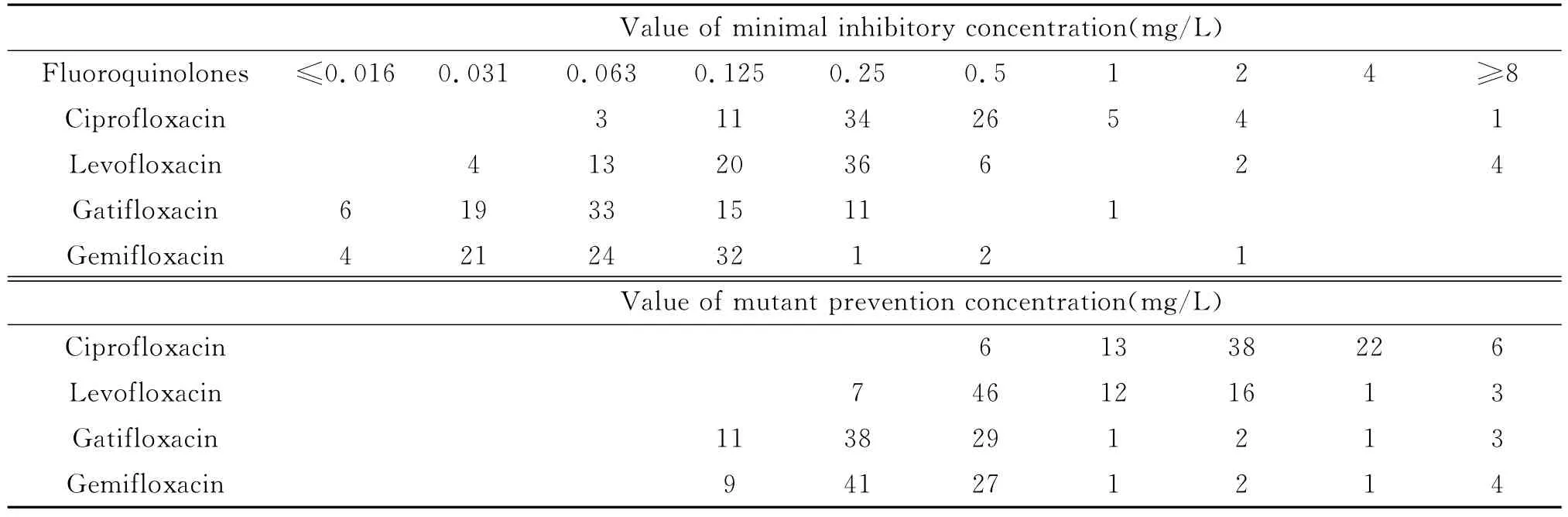
表1 4种喹诺酮类药物对85株MSSA的MIC和MPC值的分布Tab.1 The MIC and MPC distribution of 85isolates of methicillin-susceptible S.aureus against four fluoroquinolones
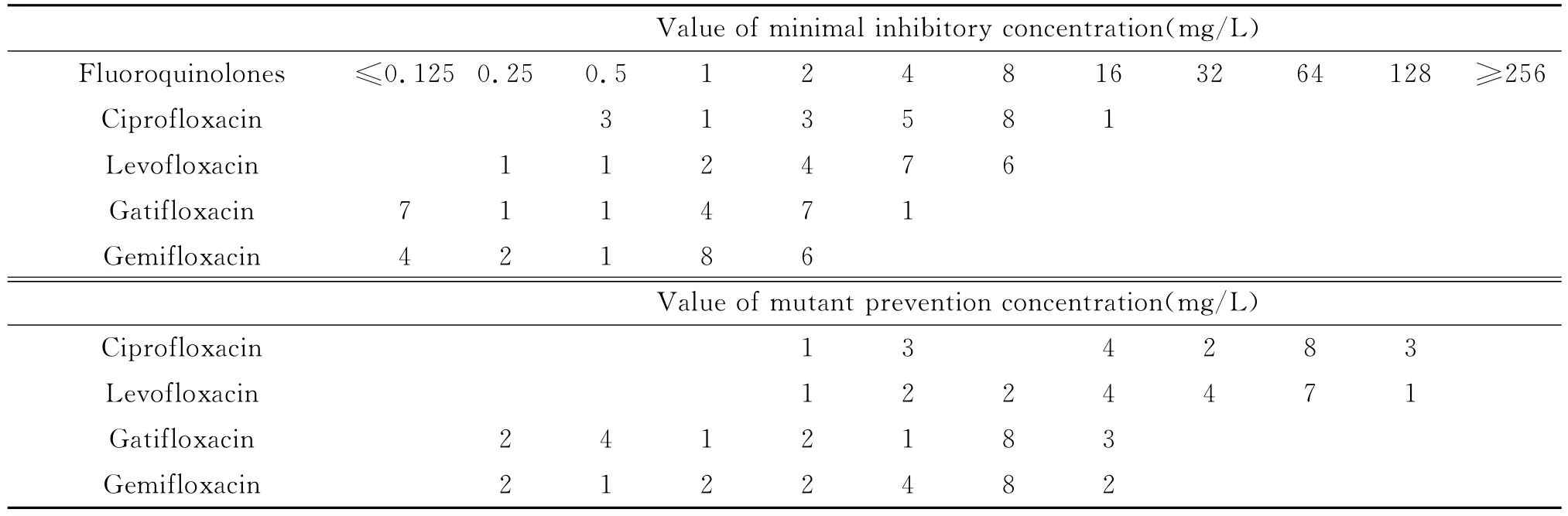
表2 4种喹诺酮类药物对21株MRSA的MIC和MPC值Tab.2 The MIC and MPC distribution of 21isolates of methicillin-resistant S.aureus against four fluoroquinolones
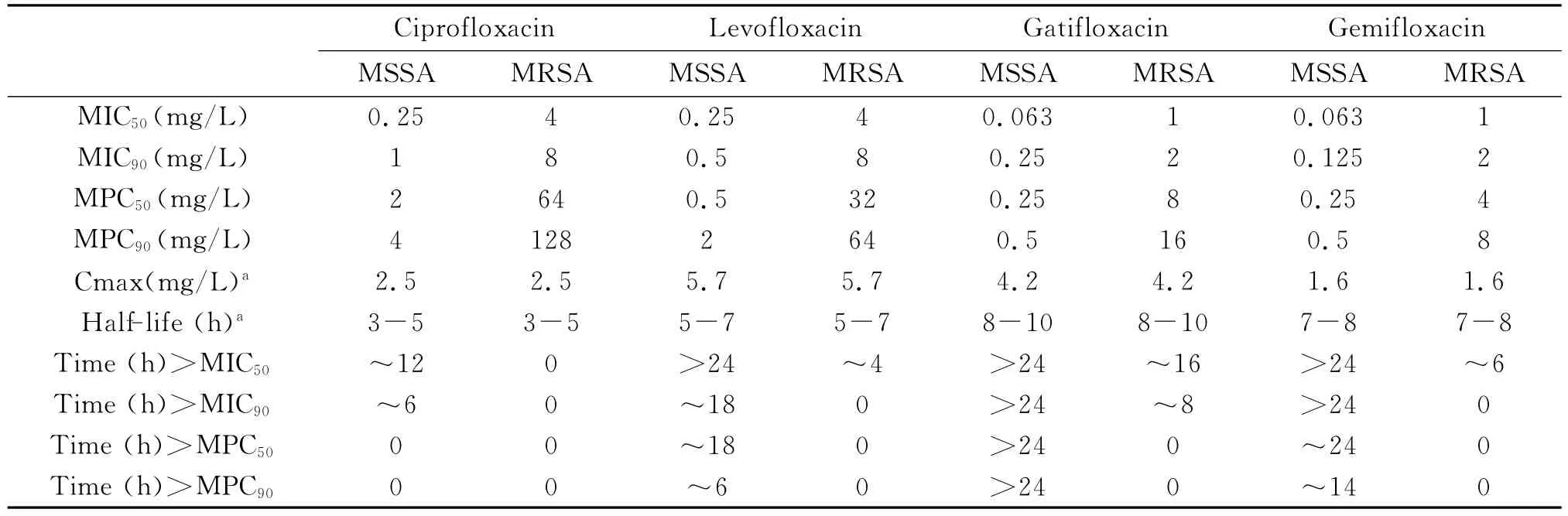
表3 4种喹诺酮类药物对动物源MRSA和MSSA的比较Tab.3 Comparative fluoroquinolone activity with MRSA and MSSA isolated from animal
3 讨 论
在养殖业上,由于抗菌药物的广泛应用,导致大量耐药菌出现,这些动物源耐药菌可通过食物链转移到人体,严重威胁人类的健康,因此如何有效预防细菌耐药性的产生和减少这些耐药菌从动物传递给人类,是目前研究的热点。目前除了控制抗菌药物的使用量、加强耐药性的监测和加强抗生素替代产品的研发等措施外,就是采用合理有效的治疗方案。传统的基于细菌MIC的治疗方案,仅阻止大部分敏感菌的生长,而使耐药突变株得到选择性富集。因此,基于MPC理论的治疗策略日益受到实验室与临床的重视,尽管国内外的一些学者研究了部分FQ药物对金黄色葡萄球菌的MPC,但其选用的菌株多为模式菌株或临床分离的敏感菌株[6-7,9]。但在实际中,MRSA和MSSA的感染往往同时存在,故仅检测敏感菌株的MPC/MIC不能有效指导临床选择药物。本研究中测定了4种FQ药物对动物源性MRSA和MSSA分离菌的MPC值,结合已有的药代动力学参数,评价了不同FQ药物限制耐药突变株选择的能力,为新的临床用药策略提供参考。
从实验结果来看,85株 MSSA的MPC90的大小顺序为加替沙星=吉米沙星<左氧沙星<环丙沙星,而且加替沙星 MPC90/MIC90比值最小,所以对MSSA临床分离株加替沙星防耐药突变能力强于其它3种药物,这与相关文献报道一致[13]。结合药物临床推荐剂量的药代动力学参数,加替沙星的血药浓度Cmax=4.2mg/L,是 MPC90的8.4倍,而加替沙星的T1/2为8-10h,按临床推荐方法给药,在整个给药期间血Cmax均高于MPC90,因而单药治疗即能限制耐药突变株的选择。吉米沙星血药浓度Cmax=1.6mg/L,为 MPC90的3.2倍,其T1/2为7-8h,给药期间血Cmax高于MPC90的时间为14h,因而单药治疗需要每隔12h加强给药才能有效限制耐药突变株的选择。左氧沙星血药浓度Cmax=5.7mg/L,为 MPC90的2.85倍,其 T1/2为5-7h,给药期间血Cmax高于MPC90的时间为6h,为了限制耐药突变株的选择,单药治疗时应增加每日给药次数,但随着给药次数增多,易诱导耐药性产生。而环丙沙星的血药浓度Cmax在给药期间大部分时间位于MSW内,单药治疗将很容易选择出耐药突变株,从而导致耐药。这与临床上使用环丙沙星治疗后导致金黄色葡萄球菌对环丙沙星耐药率快速增加相一致[9]。
21株MRSA的MPC90大小顺序吉米沙星<加替沙星<左氧沙星<环丙沙星,而且吉米沙星MPC90/MIC90比值最小,所以从理论上讲对于MRSA临床分离株吉米沙星限制耐药突变株选择的能力优于其它3种药物,但结合药代动力学参数发现,按常规剂量给药,4种药物血药浓度Cmax均达不到MPC90。单药治疗均易选择出耐药突变株而导致耐药。但值得注意的是,用药后加替沙星血药浓度>MIC90维持8h,预示在治疗 MRSA感染中,4种氟喹诺酮类药物中加替沙星可作为首先。
综上所述,对动物源性MSSA,加替沙星防耐药突变能力优于吉米沙星、左氧沙星和环丙沙星,加替沙星和吉米沙星单药能有效限制耐药突变株的选择,而左氧沙星和环丙沙星则不能。对动物源性MRSA,4种药物单药均不能有效限制耐药突变株的选择。但考虑到在动物养殖生产中,不会对每个感染病例都测定MPC,建议在治疗金黄色葡萄球菌感染时首选加替沙星,而不是笼统的使用氟喹诺酮类的任一种。有关联合用药与MPC之间的关系有待进一步深入研究。
[1]de Neeling AJ,van den Broek MJ,Spalburg EC,et al.High prevalence of methicillin resistantStaphylococcusaureusin pigs[J].Vet Microbiol,2007,122(3/4):366-372.DOI:10.1016/j.vetmic.2007.01.027
[2]Sanchini A,Pantosti A.MRSA:new troubles from the animal farm[J].Future Microbiol,2011,6(10):1113-1115.DOI:10.2217/fmb.11.98
[3]Xu XL,Zhang PL,Fan X,et al.2008Mohnarin report:Results ofStaphylococcusandEnterococcusresistance[J].Chin J Antibiot,2010,35(7):536-542.(in Chinese)徐修礼,张鹏亮,樊新,等.Mohnarin 2008年度报告:葡萄球菌和肠球菌耐药监测[J].中国抗生素杂志,2010,35(7):536-542.
[4]Zhao X,Drlica K.Restricting the selection of antibiotic-resistant mutants:ageneral strategy derived from fluoroquinolone studies[J].Clin Infect Dis,2001,33(Suppl 3):S147-S156.DOI:10.1086/321841
[5]Drlica K,Zhao X.Mutant selection window hypothesis updated[J].Clin Infect Dis,2007,44(5):681-688.DOI:10.1086/511642
[6]Cui JC,Liu YN,Wang R.et al.Mutant selection windows of fluoroquinolones for isogenic resistant mutants ofStaphylococcus aureus[J].Chin J Antibiot,2006,31(4):212-215.(in Chinese)崔俊昌,刘又宁,王睿,等.氟哇诺酮药物对金黄色葡萄球菌同源耐药突变株的耐药突变选择窗的研究[J].中国抗生素杂志,2006,31(4):212-215.
[7]Lu T,Zhao X,Li X,et al.Effect of chloramphenicol,erythromycin,moxifloxacin,penicillin and tetracycline concentration on the recovery of resistant mutants ofMycobacteriumsmegmatisandStaphylococcusaureus[J].J Antimicrob Chemother,2003,52(1):61-64.DOI:10.1093/jac/dkg268
[8]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing;Twentieth informational supplement.CLSI documents M100-S20[M].Wayne:Clinical and Laboratory Standards Institute,2010:121-136.
[9]Cui JC,Liu YN,Wang R.et al.Mutant prevention concentra
tions of fluoroquinolones forStaphylococcusaureus[J].Chin Med J,2004,84(22):1863-1866.(in Chinese)
崔俊昌,刘又宁,王睿,等.4种氟喹诺酮类药物对金黄色葡萄球菌的防耐药变异浓度[J].中华医学杂志,2004,84(22):1863-1866.
[10]Hansen GT,Metzler K.Mutant prevention concentration of gemifloxacin for clinical isolates ofStreptococcuspneumoniae[J].Antimicrob Agents Chemother,2003,47(1):440-441.DOI:10.1128/AAC.47.1.440-441.2003
[11]Casillas JL,Rico G,Rodriguez-Parga D,et al.Multicenter e-valuation of the efficacy and safety of gatifloxacin in Mexican adult out patients with respiratory tract infections[J].Adv T-her,2000,17(6):263-271.
[12]Tang X,Huang Y,Wen Q,et al.Bioequivalence of ciprofloxacin tablets in healthy volunteers[J].Chin Pharmac Bull,2005,21(9):1116-1119.(in Chinese)唐欣,黄英,温泉,等.环丙沙星片剂人体生物等效性研究[J].中国药理学通报,2005,21(9):1116-1119.
[13]Li ZX,Liu YN,Wang R,et al.Invitrostudies of mutant prevention concentration and mutant selective window forStaphylococcusaureusand its isogenic mutants strain[J].Chin J Clin Pharmacol Ther,2006,11(6):696-701.(in Chinese)李朝霞,刘又宁,王睿,等.氟喹诺酮类药物对金黄色葡萄球菌及其耐药突变体的耐药性研究[J].中国临床药理学与治疗学杂志,2006,11(6):696-701.

