fQRS、Tp-ec、QTd与急性心肌梗死PCI术后恶性心律失常发生的关系
李牧蔚,王 地,高传玉,张 优,肖文涛
1)河南省人民医院心内科 郑州 450003 2)郑州市第七人民医院心内科 郑州 450006
随着溶栓、PCI术的广泛应用,急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者的病死率明显下降,而恶性心律失常事件(malignant arrhythmia events,MAE)在急性STEMI患者中仍有很高的发生率,是心源性猝死的重要原因之一。MAE是急性STEMI患者预后不良的主要原因之一,因此早期预测MAE的发生对STEMI患者预后的改善具有重要意义。寻找能够准确预测MAE发生的无创检查指标一直是心血管领域的研究热点。一些心电图指标与MAE的发生关系密切[1]。作者对碎裂QRS波(fragmented QRS,fQRS)、校正Tp-e间期(corrected Tp-e interval,Tp-ec)、QT离散度(QT dispersion,QTd)等心电图指标与STEMI患者PCI术后MAE的关系进行了探讨。
1 对象与方法
1.1病例来源收集2010年10月至2012年10月入住河南省人民医院心内科和急诊科的急性STEMI并成功实施急诊PCI的患者96例的资料,急性STEMI的诊断依据2010年急性ST段抬高型心肌梗死诊断和治疗指南[2]。患者男78例,女18例,年龄(59.0±11.4)岁。排除完全性或不完全性束支阻滞、心脏起搏器植入术后、预激综合征、严重电解质紊乱、严重脑部疾病、严重肝肾功能不全、急慢性感染、肿瘤及免疫系统疾病、近期服用明显影响QT间期和T波形态药物的患者。随访过程中发生MAE(MAE组)24例,年龄(60.4±12.5)岁,随访1周猝死1人,随访1个月猝死1人;随访过程中未发生MAE(NMAE组)72例,年龄(58.5±12.2)岁。同时选择60例正常人心电图作为正常对照,受检者年龄(59.4±11.8)岁。
1.2心电图分析
1.2.1 心电图检查 患者入院后常规做12导联心电图,完善术前准备,在胸痛发作12 h内行球囊扩张加支架植入术,术后残余狭窄<25%、TIMI血流达3级以上为PCI成功。PCI术后持续行床旁心电监护72 h,连续3 d复查心电图,分别于术后1周和1个月复查心电图并行24 h动态心电图监测。观察记录fQRS和MAE的发生情况。MAE定义为Lown分级Ⅲ级以上的室性早搏、室性心动过速和心室颤动等引发的血流动力学及心电不稳定事件及猝死。
1.3一般资料和血液学指标的收集记录患者年龄、性别、吸烟史、体质量、身高,计算体质指数(BMI)。测量血压,PCI术后次日清晨空腹静脉采血,应用罗氏COBAS INTEGRA 800全自动生化分析仪检测空腹血糖、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。
1.4统计学处理使用SPSS 17.0进行统计分析。MAE和NMAE组间一般资料的比较采用χ2检验或两独立样本t检验,Tp-ec和QTd的比较采用重复测量数据的方差分析;急性STEMI患者Tp-ec、QTd与正常对照的比较采用两独立样本t检验;采用logistic回归分析筛选急性STEMI成功PCI术后发生MAE的危险因素。检验标准α=0.05。
2 结果
2.1MAE组和NMAE组PCI术前一般资料的比较见表1。

表1 MAE组和NMAE组PCI术前一般资料的比较
*:校正χ2。
2.2MAE组和NMAE组Tp-ec、QTd的变化正常对照组QTd、Tp-ec水平分别为(30.1±10.2)和(81.1±8.6) ms,急性STEMI患者PCI术前QTd、Tp-ec分别为(72.6±12.6)和(108.7±11.2) ms,均大于正常对照组(t=17.652, 23.947,P<0.001)。PCI术后1周、1个月时Tp-ec、QTd逐步恢复,但仍高于正常对照组(P<0.05)。MAE组与NMAE组Tp-ec、QTd的比较见表2。

表2 MAE组和NMAE组Tp-ec、QTd的比较
*:F组间=33.476,P<0.001;F时间=178.179,P<0.001;F交互= 0.110,P=0.741。#:F组间=32.675,P<0.001;F时间=173.792,P<0.001;F交互= 0.755,P=0.387。
2.3MAE发生相关危险因素的筛选以年龄、性别(男=0,女=1)、吸烟(是=1,否=0)、BMI、高血压病(是=1,否=0)、糖尿病(是=1,否=0)、TG、TC、HDL-C、LDL-C、fQRS(阳性=1,阴性=0)、Tp-ec≥100 ms(是=1,否=0)、QTd≥70 ms(是=1,否=0)为自变量,以MAE发生为因变量,行logistic回归分析。结果显示fQRS阳性、Tp-ec≥100 ms、QTd≥70 ms是急性STEMI患者PCI术后发生MAE的独立危险因素,见表3。
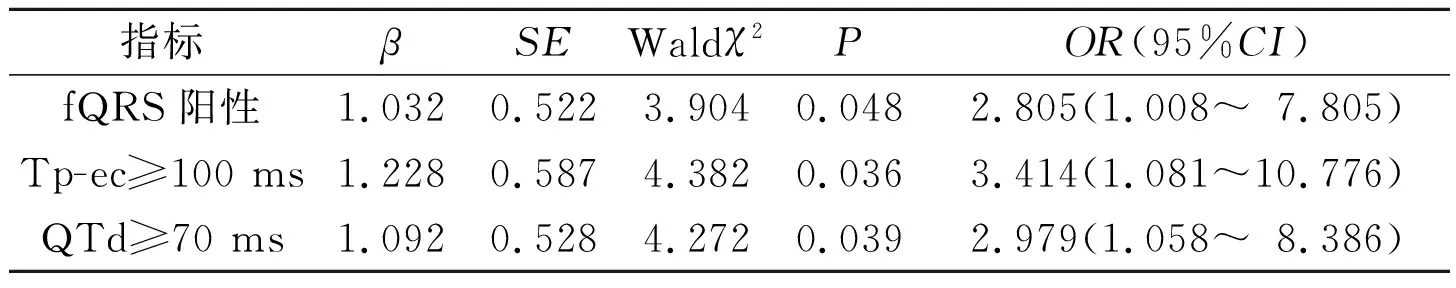
表3 Logistic回归分析结果
3 讨论
MAE是急性STEMI患者预后不良的主要原因之一。由于心肌坏死瘢痕区除极的电活动延迟,动作电位0相超射值减低,导致传导能力下降,同时瘢痕组织完全丧失电活动,使心室肌的除极方向不断变化,结果使面向梗死区的相关导联记录到时限和振幅不等的多个S波或R’波的顿挫,从而形成fQRS波。Pietrasik等[3]对Q波心肌梗死患者的研究显示,fQRS阳性患者比fQRS阴性患者的远期心脏事件高出2.68倍。Maehara等[4]的研究表明fQRS可以预测扩张型心肌病患者频发室性早博和心源性猝死事件。Calore等[5]通过延迟MRI发现冠心病患者因心肌缺血或坏死形成的瘢痕可以是跨壁性和阶段性的。对冠心病合并室性心律失常的患者心脏进行电极标测发现,在心肌瘢痕组织周围很大范围内存在着不规律的电压阶梯,而由移植心脏取得的标本研究显示纤维条索分隔的心肌内存在着传导延迟[6],造成心肌内容易形成折返,易于诱发MAE的发生。作者发现MAE组体表心电图fQRS阳性率显著高于NMAE组,fQRS阳性是急性STEMI患者PCI术后发生MAE的危险因素。
心室肌细胞由心内膜、M细胞层和心外膜组成,其组织学相似,但电生理存在异质性。心外膜细胞动作电位时限(APD)最短,复极结束最早,对应心电图T波的顶点。M细胞动作电位曲线呈尖峰圆顶形,APD较心外膜细胞和心内膜细胞长,复极时程对应心电图T波终点。在M细胞层和心内外膜之间形成的复极不同步即称为跨壁复极离散度(TDR)[7]。急性STEMI造成局部心肌急性缺血、缺氧,心肌细胞外向整流钾流(Ik)和ATP敏感钾通道增加,导致心肌细胞APD缩短,但由于M细胞Ik较心外膜和心内膜细胞明显减弱,使M细胞APD相对延长,从而造成三层细胞组织间TDR增大,在M细胞层易形成功能性单向传导阻滞,激动可在三层细胞间折返,形成室性心律失常的电生理基础,从而容易诱发室性心律失常[8]。Watanabe等[9]研究发现Tp-e间期与室性心律失常事件的发生相关;Antzelevitch等[10]研究认为Tp-e间期可预测室性心律失常的发生。作者也发现MAE组的Tp-ec明显大于NMAE组,Tp-ec≥100 ms为急性STEMI患者PCI术后MAE发生的独立危险因素。
由于不同部位心室肌的除极、复极方向和时程存在差异,其产生的综合心电向量在不同导联轴投影的时程也不相同。由于代表心室除极的QRS波时限较短,因此QTd反映了不同部位心肌复极的不均一性[11]。急性STEMI时,梗死部位发生急性缺血、坏死,缺血心肌边缘与正常心肌细胞间APD差异增大,局部心肌传导阻滞加重,因而与正常心肌之间复极不均一性增大;同时交感神经兴奋、跨膜APD延长、梗死部位低温也会导致QTd增大。心肌正常的复极均一性受到影响,易形成折返环,造成MAE的发生。该研究也发现MAE组QTd大于NMAE组,急性STEMI患者PCI术后QTd≥70 ms与MAE发生密切相关。
研究中还发现,MAE组和NMAE组PCI术后1个月内Tp-ec、QTd均逐渐减小。PCI术可使闭塞的冠状动脉血管再通,增加心肌梗死区心肌氧供、血供,恢复冬眠心肌的细胞生化代谢及电活动,促进细胞间传导偶联的恢复,改善心室肌复极的不均一性,从而使Tp-ec、QTd间期减少。PCI术后Tp-ec、QTd缩短反映了循环再灌注的有效性。
综上所述,fQRS、Tp-ec、QTd可能成为预测急性STEMI患者PCI术后MAE的心电指标,但因该研究样本量较少,上述指标的预测价值还有待深入研究。
[1]肖文涛,王宪沛,高传玉,等.急性心肌梗死溶栓前后校正QT间期、校正Tp-e间期、Tp-e/QT的变化及其预测价值[J].中华心血管病杂志,2012,40(6):473
[2]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.急性ST段抬高型心肌梗死诊断和治疗指南[J].中华心血管病杂志,2010,38(8):675
[3]Pietrasik G, Goldenberg I,Zdzienicka J,et al.Prognostic significance of fragmented QRS complex for predicting the risk of recurrent cardiac events in patients with Q-wave myocardial infarction[J].Am J Cardiol,2007,100(4):583
[4]Maehara K,Kokubun T,Awano N, et al. Detection of abnormal high-frequency components in the QRS complex by the wavelet transform in patients with idiopathic dilated cardiomyopathy [J].Jpn Circ J,1999,63(1):25
[5]Calore C,Cacciavillani L,Boffa GM,et al.Contrast enhanced cardiovascular magnetic resonance in primary and ischemic dilated cardiomyopathy[J].J Cardiovasc Med (Hagerstown) 2007,8(10):821
[6]Stevenson WG,Soejima K. Catheter ablation for ventricular tachycardia[J]. Circulation, 2007,115(21):2750
[7]Glukhov AV,Fedorov VV,Lou Q,et al .Transmural dispersion of repolarization in failing and nonfailing human ventricle[J].Circ Res,2010,106(5):981
[8]Yan GX,Joshi A,Guo D,et al.Phase 2 reentry as a trigger to initiate ventricular fibrillation during early acute myocardial ischemia[J].Circulation, 2004, 110(9):1036
[9]Watanabe N,Kobayashi Y,Tanno K,et al.Transmural dispersion of repolarization and ventricular tachyarrhythmias[J].J Electrocardiol,2004,37(3):191
[10]Antzelevitch C,Sicouri S,Di Diego JM, et al. Does Tpeak-tend provide an index of transmural dispersion of repolarization?[J].Heart Rhythm,2007,4(8):1114
[11]刘莹,黄永麟.QT间期离散度的发生机制[J].临床心血管病杂志,2001,17(9):391

