离子液体中酶促转酯化合成咖啡酸苯乙酯的新工艺
张磊霞, 王 俊, 顾双双, 肖 维, 李 晶, 吴福安, 2, 郭锡杰, 2
(1.江苏科技大学 生物与化学工程学院,江苏 镇江 212018)(2.中国农业科学院 蚕业研究所,江苏 镇江 212018)
咖啡酸苯乙酯(caffeic acid phenethyl ester,CAPE)是一种具有抗肿瘤、抗病毒、抗氧化、抗动脉硬化、抗菌消炎等多种药理活性的天然酚酸类化合物[1].由于提取咖啡酸苯乙酯的蜂胶等天然原料来源受限,制备工艺繁琐、成本高,提取法难以规模化;而化学合成法又存在副反应多,能耗高及污染环境等问题[2].因此,近年来生物合成法因其反应条件温和、得率高、成本低、副反应少以及对环境友好等,成为今后规模化制备咖啡酸苯乙酯的有效途径.
以往酶法合成酯类化合物,常选择有机溶剂作为反应介质.通过调控溶剂的极性及生物相容性,不仅能够改善底物溶解度,还可以改变酶的构象进而改变催化的立体选择性.在酶促合成咖啡酸苯乙酯的文献报道中,常用异辛烷和叔丁醇等溶剂.如文献[3]利用脂肪酶Novozym 435在叔丁醇中催化咖啡酸与苯乙醇酯化反应,产物得率达40%.但这些溶剂往往存在易挥发、毒性大、生物相容性差等缺点,近年来已逐渐被一种新兴的环境友好型介质——离子液体所取代.离子液体具有蒸汽压低、热稳定性高等优点,能提高酶的热稳定性,并增强酶的活性[4].文中以离子液体[Emim][Tf2N]为介质,采用脂肪酶催化咖啡酸与苯乙醇酯化合成咖啡酸苯乙酯,72 h后转化率达98.76%,得率达63.75%[5].因此,在离子液体中酶促合成咖啡酸苯乙酯明显优于传统的溶剂介质.
目前脂肪酶催化咖啡酸与苯乙醇酯化合成咖啡酸苯乙酯的转化率相对较低,原因主要有:反应生成的水严重影响脂肪酶的催化活性,若采用咖啡酸的低碳脂肪醇酯代替咖啡酸,所产生的低级脂肪醇易挥发,有助于酶促可逆反应的持续进行;咖啡酸易氧化,在反应体系中很不稳定,而采用咖啡酸低碳脂肪醇酯代替咖啡酸提高了底物的热稳定性,并极大地增大了底物在反应体系中的溶解度[6].
然而,利用咖啡酸的低碳烷基酯与苯乙醇的转酯化合成尚未见报道.因此,文中以咖啡酸甲酯和苯乙醇为底物,筛选合适的脂肪酶和离子液体分别作为催化剂和反应介质,通过考察酶促反应体系中的反应温度、底物摩尔比、酶用量等对咖啡酸苯乙酯得率的影响,进而建立离子液体中酶促转酯化合成咖啡酸苯乙酯的新工艺.
1 材料与方法
1.1 材料
1) 原料及主要试剂
咖啡酸甲酯(实验室自制,纯度达98%);咖啡酸苯乙酯(标准品,美国西格玛公司);甲醇、乙腈均为色谱纯,苯乙醇、冰醋酸均为分析纯(国药集团化学试剂有限公司);纯净水购自杭州哇哈哈集团有限公司.
2) 酶制剂
Novozym 435(丹麦诺维信公司);东京猪胰脂肪酶(东京仁成工业株式会社);阿拉丁脂肪酶(阿拉丁化学试剂(上海)有限公司);工业级脂肪酶(湖北远成药业有限公司);Sigma 猪胰脂肪酶(美国西格玛公司).
3) 离子液体
1-丁基-3-甲基咪唑六氟磷酸盐([Bmim][PF6]),1-丁基-3-甲基咪唑双三氟甲磺酰亚胺盐([Bmim][Tf2N]),1-丁基-3-甲基咪唑三氟甲基磺酸盐([Bmim][CF3SO3]),N-甲基咪唑硫酸氢盐([Nmim][HSO4]),三辛基甲基铵双三氟甲磺酰亚胺盐([TOMA][Tf2N])及1-己基-3-甲基咪唑硫酸氢盐([Hmim][HSO4])均购自上海成捷化学有限公司.
1.2 仪器
高效液相色谱系统 (配有平流2PB0540型,北京卫星制造商);全波UV-VIS检测器PLC-2型 (上海金达生化仪器有限公司);N-2000色谱工作站(浙大智达自动化工程有限公司);色谱柱HC-C18(美国格雷斯公司);水浴恒温振荡器SHZ-88型(金坛市医疗仪器厂);电子精密天平AR1530型(中国奥豪斯国际贸易有限公司).
1.3 离子液体中酶促转酯化合成咖啡酸苯乙酯
称取咖啡酸甲酯(0.05 mM)、苯乙醇(0.80 mM)放入5 mL反应瓶内,加入1 mL离子液体,置于90℃恒温水浴摇床内反应72 h.每隔12 h取样20 μL,稀释50倍后用HPLC检测分析,每组重复3次.分别对脂肪酶种类、离子液体种类、反应温度、苯乙醇与咖啡酸甲酯的摩尔比、酶量及时间等因素进行考察,选出最佳反应条件.
1.4 酶促合成产物的HPLC分析
色谱柱:HC-C18反相柱(250 mm×4.6 mm,5 μm);柱温30 ℃;流动相:乙腈∶水(0.5 %冰醋酸)=50∶50(V/V);流速:1.0 mL/min;检测波长:325 nm;进样量20 μL[7].进样HPLC分析前,样品用0.45 μm微孔滤膜过滤.
酶促合成产物咖啡酸苯乙酯的得率

(1)
2 结果与分析
2.1 离子液体的筛选
离子液体的带电基团不同引起疏水常数不同,会影响底物与酶的结合及酶的活性,结合文献[8],文中从6种离子液体中选出酶促转酯化合成咖啡酸苯乙酯的最佳反应介质.图1表明在离子液体中酶促转酯化合成咖啡酸苯乙酯的得率随反应时间延长,先增加后降低,反应24 h达到峰值,得率最高.6种离子液体中[Bmim][PF6]、[Bmim][Tf2N]、[Bmim][CF3SO3]和[TOMA][Tf2N]是相对较好的反应介质,咖啡酸苯乙酯的最高得率分别为50.27 %,51.77 %,33.11 %和28.97 %;在[Nmim][HSO4]中咖啡酸苯乙酯的最高得率仅为3.47 %,而[Hmim][HSO4]中几乎不产生咖啡酸苯乙酯.这是因为[Bmim][Tf2N]、[Bmim][PF6]溶解性较弱,阳离子具有较强的疏水性,能够防止脂肪酶与水的氢键作用,保护酶分子的空间构型,从而能最大程度地维持酶的催化活性.因此,在离子液体介质中,脂肪酶的活性、稳定性、选择性受介质的溶解性、疏水性、氢键等[9]影响很大.

图1 不同离子液体对酶促转酯化合成咖啡酸苯乙酯得率的影响Fig.1 Effect of different ionic liquids on the yield of CAPE by enzymatic transesterification
2.2 脂肪酶的选择
脂肪酶的催化活性与其来源密切相关,图2表明5种脂肪酶均可以催化咖啡酸甲酯和苯乙醇转酯化合成目标产物咖啡酸苯乙酯,且不同的脂肪酶具有不同的催化效率.其中,Novozym 435明显是催化转酯化反应合成产物最高效的酶,其合成产物的得率为62.40 %,阿拉丁脂肪酶为催化效率最低的酶,产物得率仅0.26 %.一般说来,酶在离子液体中的活性与离子液体和酶的种类以及两者之间的相溶性有关[10]:1)离子液体层保持了脂肪酶表层微环境的“必需水”,其阳离子具有较强的疏水作用,能防止酶与水的氢键作用而保护其空间构型,从而能维持酶的催化活性.2)不同来源的脂肪酶具有不同的催化特点和催化活力,微生物脂肪酶比动物脂肪酶具有更广的作用温度范围、更高的催化活性和热稳定性以及反应选择性.图中阿拉丁脂肪酶为牛胰腺脂肪酶,东京猪胰脂肪酶和Sigma猪胰脂肪酶为猪胰脂肪酶,都属于动物脂肪酶;而 Novozym 435和工业级脂肪酶均为微生物脂肪酶.3)反应中酶的固定化、化学修饰、表面活性剂涂层等是提高酶活性和稳定性的重要反应策略,Novozym 435是一种耐热型的固定化酶,它能在高温下仍然发挥较高的催化活性.4)工业级脂肪酶的有效作用温度为15~45 ℃[11],因高温易破坏其蛋白质分子结构致使酶分子发生不可逆的失活而降低其催化活性.综上所述,酶促转酯化合成咖啡酸苯乙醇的最佳催化剂是Novozym 435.

图2 90℃下不同脂肪酶对酶促转酯化合成咖啡酸苯乙酯得率的影响Fig.2 Effect of different lipase on the yield of CAPE by enzymatic transesterification at 90℃
2.3 反应温度
在离子液体中,温度不仅会影响脂肪酶的催化活性,还会影响到底物在反应介质中的溶解度.文中考察了不同反应温度(其他反应条件均相同)对酶促转酯化合成咖啡酸苯乙酯得率的影响(图3).由图可知,在30,45和60 ℃下[Bmim][Tf2N]转酯化合成咖啡酸苯乙酯的得率60 h内随着反应时间的增加而增加,60 ℃时达到最高,为59.34%,这是因为温度低时酯交换速率低,从而酶促反应转化率低,致使反应时间延长;而在75℃和90℃较高温度条件下,产物的得率随反应时间的增加先不断增加后逐渐降低,均在24 h时最高,其中90℃下反应24 h时的得率最大,达63.95%,由此可见高温可缩短达到最高得率的反应动态平衡时间,且提高了产物的得率.另外,在前24 h内产物的得率均随着温度的升高而升高,超过24 h后低温(30,45及60℃)下的反应得率随反应的进行仍不断升高,而高温(75,90℃)下的产物得率却不断下降,这一方面可能是因为咖啡酸甲酯在反应体系中发生水解反应生成了甲醇,且由于水解反应是吸热过程,温度过高会促进水解反应,从而生成更多的甲醇,甲醇的积累则会使化学平衡向逆反应方向移动,导致转酯化反应的正反应速率下降,产物的得率也随之下降;另一方面可能是因为高温时间太久,部分酶失去活性,酶整体的催化活性有所下降[12].因此,综合考虑温度对酶以及转酯化反应和产物稳定性的影响,文中选取的最佳反应温度为90℃.

图3 温度对酶促转酯化合成咖啡酸苯乙酯得率的影响Fig.3 Effect of temperature on the yield of CAPE by enzymatic transesterification
2.4 底物摩尔比
文中考察了不同醇酯摩尔比(5∶1,10∶1,15∶1,20∶1,25∶1及30∶1)对产物得率的影响,结果见图4,图中R为nPE∶nMC(mol/mol).由图可知,90℃下酶促转酯化合成咖啡酸苯乙酯的最佳醇酯摩尔比为20∶1,得率最高64.01 %,随着醇酯比的增加,得率逐渐增大,当酯醇比达到20∶1后,再增加醇的量,得率反而降低.这是因为转酯化反应为可逆反应,底物苯乙醇的加入量在一定范围内的增多会使反应的化学平衡向正反应方向移动,然而过多的醇分子可通过其疏水性侧链与脂肪酶活性中心周围的非极性氨基酸相互作用,引起酶构象的局部改变,不利于酶与底物的结合[13].
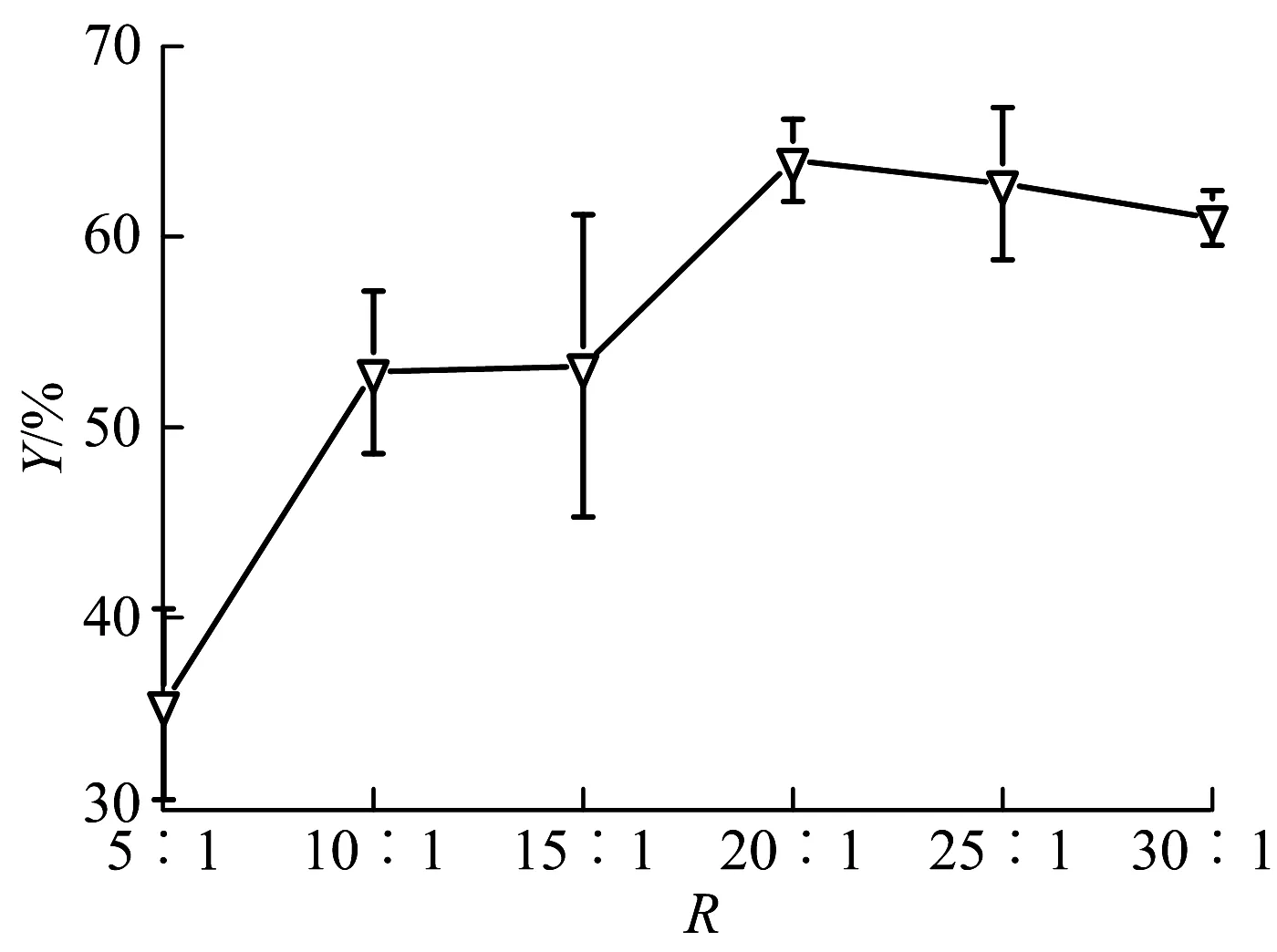
图4 醇酯摩尔比对酶促转酯化合成咖啡酸苯乙酯得率的影响Fig.4 Effect of molar ratio of PE to MC on the yield of CAPEby enzymatic transesterification
2.5 酶用量
文中采用前述实验得出的最佳条件:离子液体[Bmim][Tf2N]、Novozym 435,反应温度90℃,醇酯摩尔比为20∶1,咖啡酸甲酯0.05 mM.将酶酯的质量比分别取为1∶1、5∶1、10∶1、15∶1、20∶1,恒温振荡反应24 h,结果见图5.当酶酯质量比为10∶1时,咖啡酸苯乙酯的得率随着酶量的增加而增大,其得率达到最高为66.40%;而当脂肪酶用量继续增大时,得率反而降低.这是因为Novozym 435是固定化酶,过多的酶会导致固定化酶之间相互占用酶自身的有效位点,使得酶促反应的实际表面积减少,减少了底物与酶的接触,从而导致产物得率降低[14].因此,酶促转酯化合成反应的最佳酶酯质量比为10∶1.

图5 酶酯质量比对酶促转酯化合成咖啡酸苯乙酯得率的影响Fig.5 Effect of mass ratio of Novozym 435 to MC on the yield of CAPE by enzymatic transesterification
2.6 酶促酯化与酶促转酯化的工艺比较
已报道的离子液体中生物合成咖啡酸苯乙酯的方法,只有脂肪酶催化咖啡酸和苯乙醇的酯化法.文中首次建立离子液体中脂肪酶催化咖啡酸甲酯和苯乙醇的转酯化法,与课题组前期对离子液体中咖啡酸和苯乙醇的酶促酯化法的对比见表1.由表1可看出,文中建立的酶促转酯化法与酶促酯化法合成咖啡酸苯乙酯相比,不仅产物的得率得到提高,而且反应时间大幅度缩短,为原来的1/2,显著提高了酶促合成的效率.

表1 酶促酯化与酶促转酯化反应合成咖啡酸苯乙酯的工艺参数比较Table 1 Comparative results of the enzymatic synthesis of caffeic acid phenethyl ester by esterification and transesterification reactions
3 结论
文中建立了离子液体中酶促转酯化合成咖啡酸苯乙酯的新工艺,其最佳工艺条件:离子液体[Bmim][Tf2N]为介质,Novozym 435为催化剂,反应温度90℃,醇酯摩尔比20∶1,酶酯质量比10∶1,24 h时产物得率达到最高66.40%.与酶促酯化法相比,新工艺不仅提高了产物得率,且大幅度缩短了反应时间,大大提高了酶促合成效率.
参考文献(Reference)
[1] Teke Z,Bostanci E B,Yenisey C,et al. Caffeic acid phenethyl ester alleviates mesenteric ischemia/reperfusion injury[J].JournalofInvestigativeSurgery,2012,25(6): 354-365.
[2] 王俊,吴福安,陶士强,等.国产槲寄生多糖提取纯化工艺的研究[J].江苏科技大学学报:自然科学版,2008,22(3): 77-82.
Wang Jun,Wu Fuan,Tao Shiqiang,et al.Study on separation and purification technology of polysaccharides fromViscumcoloratum(Kom.) Nakai[J].JournalofJiangsuUniversityofScienceandTechnology:NatureScienceEdition,2008,22(3): 77-82.(in Chinese)
[3] Stevenson D E,Parkar S G,Zhang J,et al.Combinatorial enzymic synthesis for functional testing of phenolic acid esters catalysed byCandidaantarcticalipase B (Novozym 435)[J].EnzymeandMicrobialTechnology,2007,40(5): 1078-1086.
[4] Wang J,Sun G,Yu L,et al.Enhancement of the selective enzymatic biotransformation of rutin to isoquercitrin using an ionic liquid as a co-solvent[J].BioresourceTechnology,2013,128: 156-163.
[5] Wang J,Li J,Zhang L,et al.Lipase-catalyzed synthesis of caffeic acid phenethyl ester in ionic liquids: Effect of specific ions and reaction parameters[J].ChineseJournalofChemicalEngineering,2013.doi:10.1016/S1004-9541(13)60563-7.
[6] Pang N,Wang F,Cui H,et al.Lipase-catalyzed synthesis of caffeic acid propyl ester in ionic liquid[C]∥AdvancedMaterialsResearch,2013,634-638: 555-558.
[7] Wang J,Gu S,Pang N,et al.A study of esterification of caffeic acid with methanol using p-toluenesulfonic acid as a catalyst[J].JournaloftheSerbianChemicalSociety,2013.doi:10.2298/JSC120802101W.
[8] Findrik Z,Nemeth G,Gubicza L,et al.Evaluation of factors influencing the enantioselective enzymatic esterification of lactic acid in ionic liquid[J].BioprocessandBiosystemsEngineering,2012,35(4): 625-635.
[9] 李晶,王俊,张磊霞,等.离子液体中脂肪酶催化酯类合成的新进展[J].有机化学,2012,32(7): 1186-1194.
Li Jing,Wang Jun,Zhang Leixia,et al.Progress of lipase-catalyzed ester synthesis in ionic liquid[J].JournalofOrganicChemistry,2012,32(7): 1186-1194.(in Chinese)
[10] 李俊奎,鲁吉珂,王芳,等.固定化脂肪酶催化毛油合成生物柴油[J].生物工程学报,2009,25(6): 941-945.
Li Junkui,Lu Jike,Wang Fang,et al.Synthesis of biodiesel from crude oil by immobilized lipase[J].ChineseJournalofBiotechnology,2009,25(6): 941-945.(in Chinese)
[11] 季青春,曹艳,任伟,等.假单胞菌脂肪酶手性拆分研究进展[J].化工进展,2010,29(4): 722-727,744.
Ji Qingchun,Cao Yan,Ren Wei,et al.Research progress in Pseudomonas lipase for chiral resolution[J].ChemicalIndustryandEngineeringProgress,2010,29(4): 722-727,744.(in Chinese)
[12] Xin J,Chen L,Zhang Y,et al.Lipase-catalyzed transesterification of ethyl ferulate with triolein in solvent-free medium[J].FoodandBioproductsProcessing,2011,89(4): 457-462.
[13] Raita M,Laothanachareon T,Champreda V,et al.Biocatalytic esterification of palm oil fatty acids for biodiesel production using glycine-based cross-linked protein coated microcrystalline lipase[J].JournalofMolecularCatalysisB:Enzymatic,2011,73(1-4): 74-79.
[14] Herbst D,Peper S,Niemeyer B.Enzyme catalysis in organic solvents: influence of water content,solvent composition and temperature onCandidarugosalipase catalyzed transesterification[J].JournalofBiotechnology,2012,162(4): 398-403.

