血清脑源性神经营养因子水平与血管性痴呆的相关性研究
冯学敏, 刘晓冰, 张仁生, 周春奎
血管性痴呆(vascular dementia,VD)是指因多次脑卒中或长期慢性脑缺血等脑血管病变引起的脑损害所致的痴呆。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)属于神经营养因子家族,支持多种神经元生存、发育、分化及修复,在海马有丰富的表达,参与学习和记忆过程[1],近年来越来越多的证据表明BDNF与学习和记忆等认知过程密切相关[2,3],在改善认知功能方面起着重要的作用。有动物试验推测血清中BDNF的水平或许可反映脑中BDNF的水平[4]。但目前关于VD患者血清中BDNF浓度表达的报道较少。本文通过对3组中血清BDNF的水平进行比较,探讨BDNF与VD的相关性。
1 资料和方法
1.1 研究对象
1.1.1 血管性痴呆组 收集2010年3月 ~2010年10月入住我院神经内科缺血性脑血管病患者,用简易智能量表(Mini-Mental State Examnation,MMSE)检测患者的智能并进行初筛,用美国精神病学会的精神障碍诊断和统计手册(DSM-IV)标准诊断痴呆。所有VD患者的诊断均符合NINDS-AIREN标准。本组32例,男19例,女13例;年龄40~77岁,平均62.66±9.26岁;受教育年限平均5.94±2.71年;根据MMSE评分文盲(未受教育)≤17分、小学文化(受教育年限≤6年)≤20分、中学或以上(受教育年限﹥6年)≤24分,Hachinski缺血指数量表评分≥7分。
1.1.2 脑梗死组 同期住院脑梗死患者中,年龄、性别、受教育程度与VD组相匹配者35例,男19例,女16例;年龄46~77岁,平均61.49±8.78岁;受教育年限6.43±2.83年;经临床评估及体检,无严重躯体疾病,MMSE评分文盲≥17分、小学文化≥20分、初中以上文化≥24分。
1.1.3 正常对照组 为本院同期健康体检记忆及认知功能正常者,共35例,其中男17例、女18例,年龄48~78岁,平均62.97±8.33 岁;受教育年限8.86±2.43 年。
1.2 方法 血液标本采集及血清BDNF的测定:于非急性期进行神经心理量表评定,并于评定后2d,抽取清晨空腹肘静脉血4ml,置于促凝管中,室温凝集60min,以1000r/min离心10min,取血清分装于EP管中,置-80℃低温冰箱冻存备用。采用ELlSA法检测血清BDNF,ELISA试剂盒购自美国R&D生物公司。
1.3 统计学分析 所得数据均用“社会科学统计软件包”SPSS17.0作统计学处理。计数资料的比较用χ2检验,多组样本均数的比较用单因素方差分析,两两比较用t检验。
2 结果
2.1 各组间相关病史及危险因素分析 高血压病史3组间比较有统计学意义(P<0.05),说明高血压病可能是VD的危险因素,糖尿病史、吸烟史、饮酒史比较,3组间比较无统计学意义(P>0.05)(见表1)。
2.2 3组血清中BDNF浓度比较 VD组、脑梗死组、正常组之间进行BDNF比较,统计采用单向方差分析(One-way ANOVA)。VD组血清中BDNF的平均浓度在3组中水平最低,脑梗死组血清中BDNF平均浓度在3组中水平最高。通过统计分析,VD组和正常组进行比较,P>0.05,两组间无统计学意义;VD组和脑梗死组进行比较,P<0.05,两组间有统计学意义;脑梗死组和正常组进行比较,P>0.05,两组间无统计学意义。(见表2、表3)
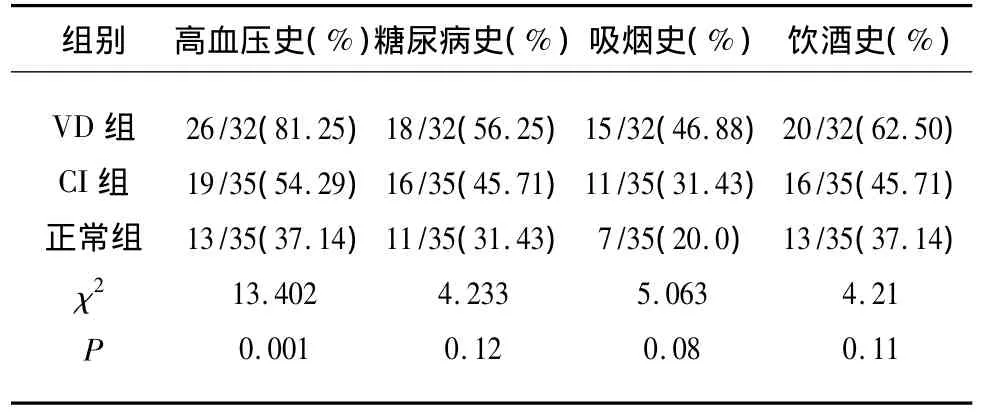
表1 3组相关病史及危险因素的比较
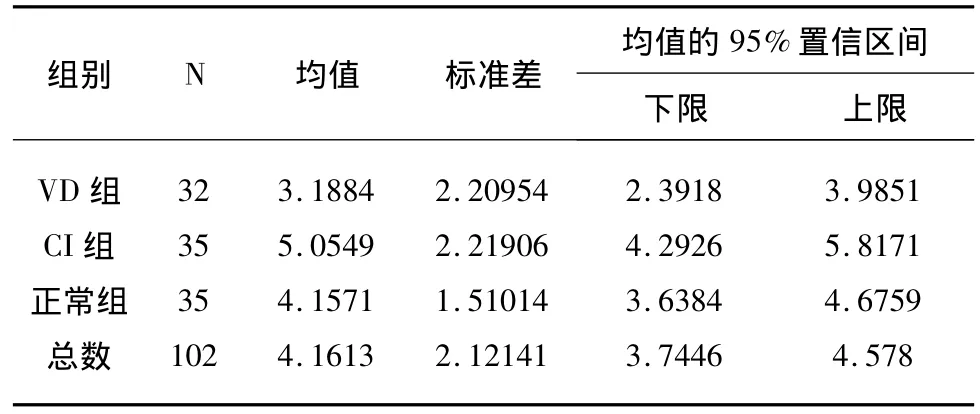
表2 3组血清中BDNF的ELISA实验结果

表3 血清中BDNF在各实验组间的比较
3 讨论
众多的研究均证实[5,6],高血压、高血糖与其正常者相比较,其VD的发生率明显升高(P<0.05)。本研究中,3组中伴随疾病最多的是高血压病,VD患者其高血压构成比分别与脑梗死组及正常组相比都具有明显的差异。积极预防和控制高血压可能会降低VD的发病率。但在本实验中糖尿病在3组中并未见明显的差异,考虑可能与本实验样本量小有关,若明确糖尿病与VD的相关性可能需进一步大样本的研究。
缺血性脑血管病引起的痴呆是VD的主要形式,有研究表明在脑缺血早期,BDNF表达增高,其特异的功能受体TrKB表达也明显上升,BDNF与TrkB相结合,产生相应的效应分子而对缺血的神经元起保护作用[7,8]。Yamasaki等[9]也发现,脑缺血早期在海马放射层BDNF的表达显著增加。同时有研究发现[10,11]对缺乏BDNF基因的小鼠进行研究,发现其梗死灶面积明显大于对照组,而提高内源性BDNF水平可明显减轻脑缺血后的神经元损伤程度。向脑缺血大鼠侧脑室内注射BDNF,可明显减少脑梗死灶的体积,促进感觉及运动功能的恢复[12]。
这些实验结果提示脑缺血后BDNF反应性增强对机体早期神经元缺血、缺氧产生保护作用。Schabitz等[13]发现,BDNF显著下调半暗带的凋亡前体蛋白Bax的表达,并上调该区域抗凋亡蛋白Bcl-2的表达,抑制半暗带脑细胞的凋亡,促进半暗带脑细胞的存活。研究认为caspase家族是凋亡的执行者,BDNF能通过阻止caspase-3的活性而抑制细胞凋亡[14]。有动物实验发现[15],BDNF 在 VD 小鼠早期表达增多,后期表达持续降低。但Yasutake等[16]研究发现,AD患者外周血清中BDNF水平与正常对照组有明显差异,而VD患者与正常对照组未见明显差异。也有实验[17]发现血管性认知障碍患者与正常对照组外周血清中BDNF水平无明显差异。
本文研究发现VD组患者血清BDNF浓度虽低于正常对照组,但无显著性差异,与上述得出的结论一致。本研究发现,脑梗死组和正常组相比,虽然脑梗死组血清BDNF浓度稍高于正常组,但并无显著性差异。薛永等[18]也发现脑梗死患者血清BDNF水平与对照组比较无统计学意义。此结果与相关动物实验结果并不完全相符合,脑梗死后人脑组织病理学检查及BDNF在脑组织中表达情况国内外罕见报道,脑梗死后人脑组织病理学检查人体血清BDNF水平与脑梗死时大脑组织内BDNF含量和时相变化是否一致仍需进一步研究。
在本研究中,3组中血清BDNF浓度水平在VD组最低,脑梗死组最高,对3组血清BDNF浓度水平进行统计学分析显示:VD组和脑梗死组分别与正常对照组相比无显著性差异,但VD组与脑梗死组相比有显著性差异,我们考虑是否为脑梗死初期由于神经元受损导致BDNF水平反应性增高,但随着神经元受损的进一步加重以及BDNF的产生减少,导致脑梗死进展为血管性痴呆时BDNF下降,提示BDNF可能参与了脑梗死进展为血管性痴呆的病理生理过程。由于本研究标本量较小,且可能有其他混杂因素影响,如患者在不同时间段的标本是否有差异,不同检测系统之间以及不同实验方法之间的可比性等有待进一步探讨。由于目前对血清中BDNF水平是否能表示脑组织中BDNF水平尚无明确定论,BDNF在血管性痴呆患者中表达及其作用有待更深入细致的研究。同时对于BDNF在脑梗死进展为血管性痴呆过程中如何发挥作用仍需大量的实验去研究,其含量从脑梗死进展为血管性痴呆降低的机制以及是否可以通过外源性给予BDNF阻断脑梗死进展为血管性痴呆需进一步的探讨。
[1]Castillo DV,Figueroa-Guzman Y,Escobar ML.Brain-derived neurotrophic factor enhances conditioned taste aversion retention[J].Brain Res,2006,1067:250-255.
[2]Bekinschtein P,Cammarota M,Izquierdo I,et al.BDNF and memory formation and storage[J].Neuroscientist,2008.14:147-156.
[3]Hall J,Thomas KL,Everitt BJ.Rapid and selective induction of BDNF expression in the hippocampus during contextual learning[J].Nat Neurosci,2000,3(6):533-535.
[4]Karege F,Schwald M,Cisse M.Postnatal developmental profile of brain-derived neurotrophic factor in rat brain and platelets[J].Neurosci Lett,2002,328:261-264.
[5]Forette F,Seux ML,Staessen JA,et al.Prevetion of dementia in randomised double-blind placebo-controlled systolic hypentention in Europe(Syst-Eur)trail[J].Lancet,1998,352(9137):1347-1351.
[6]Moroney JT,Tang MX,Berglund L,et al.Low-density lipoprotein cholesterol and the risk of dementia with stroke[J].JAMA,1999,282(3):254-260.
[7]Kim MW,Bang MS,Han TR,et al.Exercise increased BDNF and trkB in the contralateral hemisphere of the ischemic rat brain[J].Brain Res,2005,1052(1):16-21.
[8]Lang EM,Asan E,Plesnila N,et al.Motoneuron survival after C7 nerve root avulsion and replantation in the adult rabbit:effects of local ciliary neurotrophic factor and brain-derived neurotrophic factor application[J].Plast Reconstr Surg,2005,l 15(7):2042-2050.
[9]Yamasaki Y,Shigeno T,Furukawa Y,et al.Reduction in brain-derived neurotrophic factor protein level in the hippocampal CAl dendritic field precedes the delayed neuronal damage in the rat brain[J].JNeurosci Res,1 998,53(3):318-329.
[10]Pera J,Zawadzka M,Kaminska B,et al.Neurotrophic factor expression after focal brain ischemia preceded by different preconditioning strategies[J].Cerebrovasc Dis,2005,19(4):247-252.
[11]Saarelainen T,Lukkarinen JA,Koponen S,et al.Transgenic mice overexpressing truncated trkB neurotrophin receptors in neurons show increased susceptibility to cortical injury after focal cerebral ischemia[J].Mol Cell Neurosci,2000,16(2):87-96.
[12]ScMbitz W R,Steigleder T,Cooper-Kuhn CM,et al.Intravenous brain-derived neurotrophic factor enhances poststroke sensorimotor recovery and stimulates neoro genesis[J].Stroke,2007,38(7):2165-2172.
[13]Schabitz WR,Sommer C,Zoder W,et al.Intravenous brain-derived neurotrophic factor reduces infarct size and counterregulates Bax and Bcl-2 expression after temporary focal cerebral ischemia[J].Stroke,2000,31:2212-2217.
[14]Han BH,D’Costa A,Back SA,et al.BDNF blocks caspase-3 activation in neonatal hypoxia-ischemia[J].Neurobiol Dis,2000,7(1):38-53.
[15]王玉良,周永翠.血管性痴呆大鼠海马B D N F表达的长时程变化[J].潍坊医学院学报,2008,30(5):385-388.
[16]Yasutake C,Kuroda K,Yanagawa T,et al.Serum BDNF,TNF-a and IL-1b levels in dementia patients:comparison between Alzheimer’s disease and vascular dementia[J].Eur Arch Psychiatry Clin Neurosci,2006,256(7):402-406.
[17]王冬欣,黄 娣.脑源性神经营养因子基因多态性与血管性认知障碍的相关性研究[J].中华老年心脑血管病杂志,2010,12(1)37-39.
[18]薛 永,李桂香,孙传英,等.脑梗死患者血清BDNF及雌二醇水平测定[J].临床和实验医学杂志,2008,7(10):14-15.

