梨形环棱螺抗氧化系统对六氯苯的毒性响应
黄 俊,李家园,朱 祎,张清顺,侯建军*
(1. 污染物分析与资源化技术湖北省重点实验室 (湖北师范学院),湖北 黄石 435002;2. 湖北师范学院 生命科学学院,湖北 黄石 435002 )
0 前言
六氯苯(HCB)是一类典型的持久性有机污染物(POPs),能在环境中持久残留,不易降解;能通过食物链的富集作用对生物造成严重影响;也能够经过长距离迁移到达远离污染源的地区,对接触该物质的生物造成损害[[1,2]。六氯苯在12种POPs中属于较易挥发的农药,所以在合成和使用过程中,一定量的HCB能够进入环境并存留于水体、大气、土壤和沉积物中[3,4],对鱼类和底栖生物产生较大威胁。目前,关于重金属对水生生物生态毒理效应的研究报道较多[5-7],而关于有机物尤其是HCB对水生生物的影响研究相对较少。HCB毒性作用的主要靶器官是动物的肝脏[8],鳃是直接暴露于水体的组织,其生理变化对HCB的胁迫较为灵敏[9]。HCB在体内代谢时,可产生多种中间代谢产物,并伴随产生大量的活性氧自由基(如O2-,·OH)[10]。人们在研究污染物的致毒机理中,发现污染物暴露过程中,机体在产生活性氧的同时,能诱导体内相应的抗氧化防御系统发挥作用,而抗氧化防御系统的酶活性或含量也会随着污染物的胁迫而发生相应改变,如SOD,CAT,GST,GSH等均可被诱导,从而使机体免受氧化伤害[11]。因而,这些生物标志物的活性变化能间接反映环境中氧化应激的存在,可作为环境污染胁迫的指标[12]。如 Peters等[13]据此认定可以将抗氧化酶活性作为指示污染引起氧化胁迫的生物标志物。
梨形环棱螺在我国分布广泛,多生活在河流、池塘、湖泊等水体,是大型底栖生物的重要组成部分,在水生态系统中起着重要的作用,它们很容易捕获和在室内饲养繁殖,对污染物敏感性高[14]。本研究选用梨形环棱螺作为实验材料,通过暴露实验方法研究不同浓度 HCB对梨形环棱螺肝脏和鳃组织抗氧化指标(SOD、CAT、GST、GSH)的变化情况,初步探讨HCB对梨形环棱螺的的氧化胁迫及防御作用机理,为水环境POPs污染的早期诊断及生态风险评价提供科学的依据。
1 材料与方法
1.1 材料
梨形环棱螺(Bellamya purificata)采自于湖北省黄石市磁湖,质量2±0.2g。实验前选择健康的环棱螺放在水箱中适应和驯养一个星期。驯养期间,实验用水为曝气 3d 的自来水,每日换水一次,其它饲养环境条件是:pH 6.4,饲养温度20~25 ℃;急性毒理实验前1天停止喂食,实验期间不喂食[15]。
1.2 仪器试剂
1.2.1 实验仪器
相关仪器设备需要:紫外可见分光光度计(美国Thermo公司),高速冷冻离心机(德国Eppendorf,5430R),DIAX900微量匀浆机(德国Heidolph公司)等,HP300G-C型智能光照培养箱(瑞华仪器),雷磁PHS-25(上海精科)。
1.2.2 实验试剂
六氯苯(HCB)、NBT、EDTA 、L-Met 、磷酸二氢钠、十二水合磷酸氢二钠、NaOH固体、95%乙醇、85%磷酸、Brillisnt Blue G250、30%H2O2、DTNB、三氯乙酸(以上试剂购自国药集团化学试剂公司),维生素C、硫代巴比妥钠、二甲基亚砜(DMSO)(上述药品均购自Sigma公司)。
1.3 实验方法
1.3.1 HCB在体毒物毒性暴露实验
急性毒性试验方法和在体毒性暴露试验采取我们实验室已经建立和使用的方法[15]。
1.3.2 酶样的制备
酶样制备方法和相关程序采用本实验室已经建立和优化的方法[15]。
1.3.3 抗氧化酶活性的测定
SOD活性的测定采用NBT法[16],酶活力单位定义为:每mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为1个活性单位(U)。CAT活性的测定采用紫外分光光度法[17],酶活力单位定义为:每mg组织蛋白在1 mL反应液中每分钟分解1μmol的H2O2的量为1个活性单位(U)。GST活性的测定采用CDNB法[18],酶活力单位定义为:在25 ℃,pH 6.5,基质CDNB与GSH终浓度均为1 mmol/L的条件下,1分钟催化1 μmol/L CDNB与GSH结合的GST酶量为1U。
1.3.4 GSH的测定
GSH采用DTNB法测定[19]。
1.3.5 数据处理方法
试验结果采用平均数±标准误(Means ±SD)表示,全部试验数据均采用SPSS 16. 0统计软件包进行统计分析。各组间的显著性检验采用单因素方差分析,采用LSD法进行对照组与各剂量组的两两比较,抗氧化指标间的相关分析采用Pearson相关分析,差异显著用P<0.05表示,差异极显著用P<0.01表示。绘图软件采用Orgin 8.0作图。
2 结果与分析
2.1 不同浓度的HCB对梨形环棱螺肝脏和鳃SOD活性的影响
由图1A可知,各剂量组肝脏中SOD的活性在暴露的第1d 被诱导升高,8.0、16.0剂量组的酶升高了33%,2.0、4.0剂量组的酶活性升高了11%~16%(p<0.05);随后各剂量组SOD活性呈剂量依赖性回落,直至达到各自的最低值,此时,16.0与对照组相比下降了40%(p<0.01);随后除2.0剂量组保持缓慢上升趋势直到实验结束外,其余剂量组SOD活性均经历一个先上升后下降的过程;到第14天时,与对照组相比,2.0、4.0剂量组SOD活性约上升了5.6%(p>0.05),而16.0剂量组约下降了39%(p<0.01),已受到极显著抑制,并且各剂量组的活性与其剂量呈负相关。
图1B显示,各剂量组鳃组织中SOD活性在暴露起始时均被显著诱导升高,直至达到各自峰值,此时与对照组相比,2.0、8.0剂量组SOD活性上升了173%,4.0、16.0剂量组上升了100%左右(p<0.01);随后各剂量组SOD活性开始下降,其中2.0剂量组一直下降,至第7d时已降至对照组附近,并维持这一水平;16.0剂量组与对照组相比下降了32%后,处于抑制状态,而8.0剂量组仍处于诱导状态。随着暴露时间延长,各剂量组均呈现先上升后下降的波动变化;到第14d时,与对照组相比,16.0剂量组SOD下降了32%,处于显著抑制状态(p<0.05),4.0与8.0剂量组SOD活性虽分别上升了23.8%和43.5%,仍处于诱导状态。
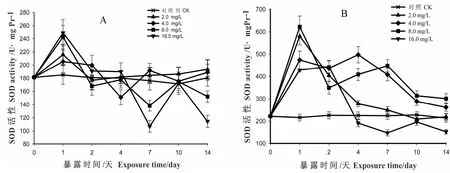
图1 HCB 对梨形环棱螺肝脏(A)和鳃(B)中SOD 活性的影响
2.2 不同浓度HCB对梨形环棱螺肝脏和鳃组织CAT活性的影响
在图2A中,肝脏各剂量组CAT在HCB暴露起始时,活性就被诱导升高,其中8.0剂量组升高率为45%(p<0.05),其他剂量组则上升了 15%左右; 除了 4.0剂量组的活性维持稳定直到实验结束,而其他剂量组均下降到对照组附近,但仍处于诱导状态(p>0.05);从第2d开始,各剂量组CAT活性均被持续诱导升高,低剂量组(2.0mg/L)上升到了对照组的230%,其他则上升了67%(p<0.01);之后,各剂量组CAT活性又急剧下降,到第14天时,2.0剂量组CAT活性为对照组的140%(p<0.01);与对照组相比,8.0、16.0剂量组活性下降了11%,略低于对照组,最终表现出低浓度诱导,高浓度抑制的现象。
图2B显示,鳃组织CAT在HCB暴露后活性被诱导升高,其中2.0和4.0剂量组上升幅度较大,4.0剂量组的CAT活性上升到了对照组的300%(p<0.01);然后活性开始下降,到第14天时,2.0剂量组的CAT活性为对照组的 125%(p<0.05),4.0剂量组为对照组的 167%(p<0.01)。8.0和16.0约上升了62%(p<0.05),之后又回落至对照组附近,但此时8.0剂量组酶活性略高于对照组,而16.0剂量组酶活性略低于对照组(p>0.05)。从第2d开始,这两组酶的活性被持续诱导升高,达到峰值时,16.0剂量组CAT升高了80%,而8.0剂量组活性则上升到了对照组的260%(p<0.01);之后其活性急剧下降,至第14d时,8.0剂量组与对照组活性相当,而16.0剂量组与对照组相比,其活性下降了16%,已受到了轻微抑制(p>0.05)。
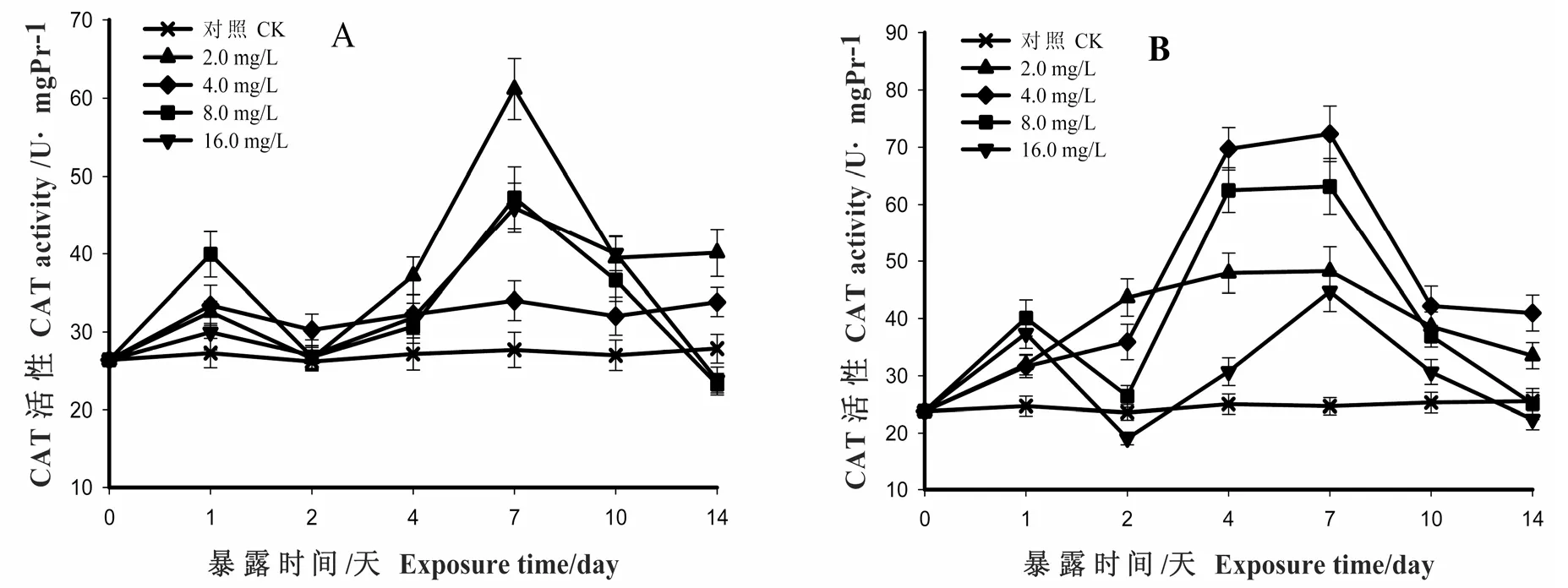
图2 HCB对梨形环棱螺肝脏(A)和鳃(B)中CAT 活性的影响
2.3 不同浓度HCB对梨形环棱螺肝脏和鳃组织GST活性的影响
从图3A可见,各剂量组肝脏中GST在暴露的第1d内活性就被诱导上升,较对照组升高了15%~30%;之后各剂量组GST活性又回落到对照组附近(p>0.05);随后GST活性又被持续诱导升高,直至达到各自的峰值,此时2.0剂量组GST活性升到了对照组的250%,4.0、16.0升到了对照组的200%,8.0升到了对照组的160%(p<0.01)。然后GST活性持续下降至第10天,在第10-14d其活性维持稳定,其中2.0、4.0剂量组仍处于诱导状态,而8.0和16.0剂量组则处于抑制状态,其中4.0剂量组的GST活性较对照组上升了25%(p<0.05)。
在图3B中,各剂量组鳃组织中的GST在暴露的第1d内,其活性被诱导轻微上升(其中最高仅上升了2.5%),然后开始回落,第2d时,2.0和4.0剂量组略高于对照组,而8.0和16.0剂量组低于对照组(p>0.05);随后GST活性均被诱导上升到较高水平。此时,与对照组相比,2.0、4.0剂量组GST活性上升了175%左右,8.0、16.0剂量组上升了150%左右(p<0.01);随后GST活性急剧下降;到第14d时,中低剂量组的GST活性约为对照组的175%,仍处于显著被诱导状态(p<0.05),高剂量组(16.0 mg/L)与对照组相比约下降了15%,已受到轻微抑制。
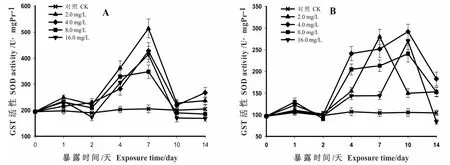
图3 HCB对梨形环棱螺肝脏(A)和鳃(B)中GST 活性的影响
2.4 不同浓度HCB对梨形环棱螺肝脏和鳃中GSH含量的影响
在图4A中,在暴露的第1d内,肝脏各剂量组的GSH均被诱导而缓慢上升,上升约25%后略有下降,至第2d时仅略高于对照组(p>0.05),然后GSH被显著诱导升高,直至达到各自的峰值,并且其峰值与各自的剂量呈正相关。此时与对照组相比,高剂量组(16.0 mg/L)约上升了180%,低剂量组(2.0 mg/L)约上升了120%(p<0.01)。随后各剂量组的GSH含量均持续下降,并且其下降的幅度同样与各剂量呈正相关,低剂量组(2.0 mg/L)GSH含量仅仅有轻微回落,其他剂量组下降明显;到第14d时,0.2剂量组仅下降了10%,含量仍极显著高于对照组(p<0.01);4.0剂量组约下降了58%,含量仍显著高于对照组(p<0.05);而8.0剂量组已下降至对照组附近,与对照组相比差异不显著(p>0.05);16.0剂量组的GSH含量已降至对照组以下,约下降了360%,其含量已被显著抑制(p<0.05)。
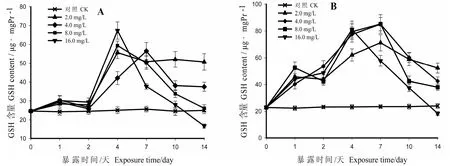
图4 HCB对梨形环棱螺肝脏(A)和鳃中GSH(B)活性的影响
鳃组织GSH变化规律与肝脏相似(图4B)。各剂量组鳃组织GSH在暴露的第1d内均被诱导升高,含量均上升了200%-250%(p<0.01);除2.0和8.0剂量组在第2d稍经回落并再度持续上升外,其他各剂量组均保持上升趋势,直至达到各自的峰值。其中,16.0剂量组最早达到峰值。此时,与对照组相比,高剂量组(16.0 mg/L)约上升了300%,中剂量组(4.0、8.0 mg/L)约上升了325%,低剂量组(2.0 mg/L)约上升了250%,其含量均极显著高于对照组(p<0.01)。随后,各剂量组GSH含量开始下降,并且其下降幅度与各剂量呈正相关,到第 14d时中低剂量组已下降至对照组的 175%-250%,但仍极显著高于对照组(p<0.01);16.0剂量组约下降了400%,并已降至对照组以下,其GSH含量已被抑制(p>0.05)。
3 讨论及结论
3.1 HCB对梨形环棱螺SOD活性的影响
进入生物体的 HCB能产生过多的活性氧(reactive oxygen species, ROS),而广泛存在于螺组织细胞内的超氧化物歧化酶(SOD)可将超氧阴离子自由基歧化成H2O2和O2·以保护细胞免受活性氧自由基的损伤[20,21]。实验结果表明,在较短的暴露时间内(1d),梨形环棱螺肝脏和鳃组织中的SOD活性能迅速升高,说明 HCB胁迫已产生了氧化应激反应,引起 ROS大量生成,从而诱发了 SOD活性增强,ROS被大量清除,因此又迅速降至对照水平或略低于对照组。随着暴露时间的进一步延续,自由基大量积累,过量积累的自由基则对抗氧化酶产生显著的诱导作用,使 SOD活性代偿性增强以平衡螺机体内的氧化与抗氧化反应[21,22]。当HCB作用浓度过高,暴露时间过长, SOD的清除能力达到饱和时,活性氧大量积累,未被及时清除的自由基可对细胞产生毒性损伤,可导致 SOD活性受抑制[23]。所以在 HCB暴露后期,各剂量组 SOD酶活性急剧下降,并且高剂量组 SOD活性已处于抑制状态。蒋舜尧等[24]在研究HCB对鲫鱼肝脏线粒体保护酶 SOD、CAT活性的影响时,也有相似的现象出现,酶活性在低浓度受诱导,而高浓度下则受抑制。
3. 2 HCB对梨形环棱螺CAT活性的影响
过氧化氢酶(CAT)作为 H2O2浓度的调节器,可进一步将 H2O2转化成H2O,从而使机体免受活性氧的损伤[25]。HCB暴露起始时,由于 ROS产生及 SOD对活性氧的歧化作用,导致 H2O2升高,刺激体内 CAT表达释放和活力增强;当 H2O2被分解后,CAT活性同样降至对照组附近,即表现出短期激活然后下降的的变化规律,这与李康等[26]对鲫鱼的报道颇为相似。随着暴露时间延长,一方面由于螺体内积累的 HCB激发了H2O2大量生成,另一方面因 ROS大量生成,导致 SOD应激产生歧化反应,也产生大量 H2O2,使CAT活性被诱导而增强。但随后CAT活性显著下降,这说明 CAT等作为活性氧清除剂,只能在一定程度上清除体内过量活性氧,来维持体内活性氧代谢平衡,降低脂质过氧化作用。一旦 HCB在机体内蓄积引起浓度升高,将导致机体产生大量的氧自由基不能及时被清除,进一步对包括抗氧化酶在内的细胞胞内酶形成抑制,因此其清除活性氧的功能也随之下降[27]。
3.3 HCB对梨形环棱螺GST活性的影响
GST是细胞内解毒系统Ⅱ阶段中具有解毒作用的重要酶蛋白[28],具有消除体内自由基和解毒的双重功能,它可以催化GSH与许多次级底物结合,包括脂质过氧化的次级产物,从而解除内源性或外源性毒物的毒性作用[29],所以在保护细胞膜免受过氧化损伤中意义重大。本实验刚开始时,因自由基的生成引发 GST同样表现出一种应激反应,酶活性被诱导增强;当活性氧被清除,GST活性降至对照组附近。随着暴露时间进一步延长,活性氧大量产生,GST与其他抗氧化酶如 SOD、GPx 等在组织中协同表达而使其活性显著升高[30];当 GST达到峰值后,可能由于机体内抗氧化系统其他成分如 SOD、CAT等的介入,体内活性氧被清除,此时 GST浓度急剧下降,其原因可能是由于螺体内 GST代谢 HCB的能力被饱和,使螺出现中毒现象,进而使 GST活性受到抑制[31]。GST在实验结束时,也同样表现出低浓度诱导、高浓度抑制的现象。
3.4 HCB对梨形环棱螺抗氧化指标GSH的诱导和抑制
GSH是动物体内重要的水溶性抗氧化剂,是 GST和 GPx的辅助因子,两酶均能催化其与污染代谢物和H2O2结合而达到解毒目的,同时它还能够清除氧自由基、阻止脂质过氧化以保护机体免受氧化损伤[32],或通过消除有害的脂质过氧化代谢产物如MDA,来阻断脂质过氧化连锁反应,从而保护细胞膜结构和功能的完整性[33]。此过程中 GSH的含量会因污染胁迫而发生改变。本试验中,在 HCB暴露的1d内,GSH含量就被诱导升高,可能是 GSH因HCB的暴露而产生了适应性的诱导反应;同时,GSH与 HCB结合而产生的解毒效应又导致GSH消耗。短时间内当这两个过程达到动态平衡时,GSH含量下降到正常值附近。实验结果显示,随暴露时间延长GSH含量表现为先诱导后抑制,这是因为随着HCB暴露时间进一步延长,自由基大量生成,为调节生物体内自由基浓度平衡,GSH含量被诱导显著升高。在一定暴露浓度范围内,GSH 对HCB的适应性能力随着污染程度的增加而降低,HCB对GSH 的抑制效应随着污染程度的增加而加大,GSH因中毒过深而导致其含量降低。GSH达到峰值后,其含量急剧下降,一方面,GSH可直接通过供H+,拮抗氧自由基毒性,本身被氧化而使其含量降低;另一方面,GSH与作为底物的HCB及其代谢物发生共轭作用也会导致其含量下降[34]。至14d时,中低剂量组的GSH仍显著高于对照组,而高剂量组已被抑制,表明低浓度HCB可对GSH的含量产生显著诱导效应,而高浓度产生抑制效应。张景飞等[12]对鲫鱼进行原油暴露实验时也发现,低浓度毒物暴露时,GSH被诱导,而高浓度暴露时GSH则被抑制。试验结果显示,HCB的短期暴露就会造成 GSH含量上升,GSH含量显著降低则暗示着污染的加剧。
4 实验结论
HCB对梨形环棱螺肝脏和鳃中SOD、CAT、GST活性和GSH含量均有明显影响。各抗氧化指标在HCB暴露后均受到诱导而升高,随后又回落。随着暴露时间的延长,各抗氧化指标又呈现出显著的先上升后下降趋势,最终表现为低浓度诱导,高浓度抑制。
[1]史双昕, 周丽, 邵丁丁, 等. 北京地区土壤中有机氯农药类POPs残留状况研究[J]. 环境科学研究, 2007, 20(1): 25-29.
[2]黄俊, 李刚, 钱易. 我国的持久性有机污染物问题与研究对策[J]. 环境保护, 2001, 11: 3-6.
[3]Bailey R E. Global hexachlorobenzene emissions[J]. Chemosphere, 2001, 43(2): 167-182.
[4]邹小兵, 孟刚, 郑泽根. 湖泊POPS污染的来源与质量平衡[J]. 环境科学与技术, 2004, 27(1): 103-106.
[5]张曙光.重金属污染对黄河鲤鱼的致突变效应[J].环境科学研究, 1989, 9(3): 54-57.
[6]方展强, 王春风, 卫焕荣. 汞和硒对剑尾鱼Na+-K+-ATPase活性的影响[J]. 应用与环境生物学报, 2006, l2(2): 220-223.
[7]谭树华, 邓先余, 蒋文明. 高浓度铬对克氏原螯虾抗氧化酶系统的影响[J]. 农业环境科学学报, 2007, 26(4): 1356-1360.
[8]Randi A S, Hernandez S. Hexachlorobenzene increases ornithine decarboxylase activity, free polyamines content and c-Myc,c-Fos and c-Jun protein levels in rat liver[J]. Toxicology Letters, 2003, 144(1): 168-173.
[9]江天久, 牛涛. 重金属Cu2+, Pb2+和Zn2+胁迫对近江牡蛎SOD活性影响研究[J]. 生态环境, 2006, 15(2): 289-294.
[10]Winston G W. Oxidants and antioxidants in aquatic animals[J]. Comparative Biochemistry Physiology, 1991.173-176.
[11]张景飞, 王晓蓉, 沈骅. 低浓度2,4-DCP对鲫鱼肝脏抗氧化防御系统的影响[J]. 中国环境科学, 2003, 23: 531-534.
[12]戴雅奇, 由文辉. 苏洲河铜锈环棱螺生物标志物初步研究[J]. 华东师范大学学报, 2005, (3): 105-108.
[13]Peters LD, Porte CJ, Albaiges J and Livingstone D R. 7-ethoxyresorufin-O-deethylase(EROD)and antioxidant enzyme activities in larvae of sardine(Sardina pilchardus)from the North coast of Spain[J]. Mar.Pollut.Bull, 1994, 28(5): 299-304.
[14]王银东, 熊邦喜, 杨学芬. 武汉市南湖大型底栖动物的群落结构[J]. 湖泊科学, 2005, 17(4): 327-333.
[15]朱祎,李家园,黄俊,等. 六氯苯暴露导致梨形环棱螺脂质过氧化及DNA损伤研究[J]. 武汉纺织大学学报, 2013, 26(3):88-94.
[16]Beauchamp C O, Fridovich I. Superoxide dismutase: Improved assays and anassayapplicable to acrylamide gel [J]. Anal. Biochem,1971, 44: 276-287.
[17]Beers RF, Sizers IW. A spectrophotometric method for measuring the breakdownof hydrogen peroxide by catalase[J]. J. Biol. Chem,1952: 125-133.
[18]Habig WH, Pabst MJ, Jakoby WB. Glutathione-S-transferases. The first enzymatic stepin mercapturic acid formation[J]. J Biol Chem, 1974, 249(22): 7130-7139.
[19]Boyne AF, Ellman GL. A methodology for analysis of tissue sulfhydry components[J]. Anal Biochem, 1972, 46(2): 639-653.
[20]Frédéric Silvestre, Jean-François Dierick, Valéry Dumont, et al.. Differential protein expression profiles in anterior gills of Eriocheir sinensis during acclimation to cadmium[J]. Aquat Toxicol, 2006, 7(9): 46-58.
[21]孟顺龙, 陈家长, 胡庚东,等. 低浓度阿特拉津对鲫鱼超氧化物歧化酶(SOD)活性的影响[J]. 农业环境科学学报, 2007, 26(1):170-174.
[22]李响, 刘征涛, 沈萍萍, 等. 卤代酚类物质对抗氧化酶活性的影响研究及构效分析[J]. 环境科学学报, 2004, 24(5):901-904.
[23]孙淑红, 焦传珍, 刘小林, 等. Cd(Ⅱ)对泥鳅抗氧化酶活性和脂质过氧化的影响[J]. 大连水产学院学报, 2009, 24(1): 53-56.
[24]蒋舜尧, 周培疆, 董玉良. 六氯苯对离体鱼肝线粒体抗氧化酶的作用[J]. 中国环境科学,2007, 27(1): 102-105.
[25]Papadimitriou E, Loumbourdis NS. Exposure of the frog Rana ridibunda tocopper impact on two biomarkers, lipid peroxidation, and glutathione[J]. BullEnviron Contam Toxicol, 2002, 69: 885-891.
[26]李康, 周忠良, 王明山, 等. 苯并(a)芘对鲫鱼(Carassiusnatus)肝脏抗氧化酶的影响[J]. 应用与环境生物学报, 2003, 10(1):88-91.
[27]陈家长, 孟顺龙, 胡庚东, 等. 低浓度阿特拉津对鲫鱼过氧化氢酶(CAT)活性的影响[J]. 农业环境科学学报, 2008, 27(3):1151-1156.
[28]邓红艳. 谷胱苷肽-S-转移酶与肿瘤耐药机制的探讨[J].中国医药情报, 1999, 5(2): 75-75.
[29]陈晓妮, 吴志强, 王玉彬. 孔雀石绿胁迫下鲫肝脏抗氧化系统的动态变化[J]. 江西科学, 2008, 26(5): 712-713.
[30]Hayes JD, Strange RC. Invited commentary: potential contribution of the glutathone S-transferase supergene family to resistance to oxidative stress[J]. Free Rad Res., 1995, 22(3): 193-207.
[31]高春生, 王春秀, 张书松. 水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响[J]. 农业环境科学学报, 2008,27(3): 1157-1162.
[32]Ross D. Glutathione, free radicals and chemotherapeutic agents. Mechanisms of free radical induced toxicity and glutathionedependent protection[J]. Pharmacol Therapeut, 1988, 37: 231-249.
[33]路雪雅. 抗坏血酸和硫酸亚铁诱导鼠肝线粒体损伤的实验研究[J]. 生物化学与生物物理进展, 1989, 16(5): 372-377.
[34]Sun Y, Yu H, Zhang J, et al. Bioaccumulation, depuration and oxidative stress in fish Carassius auratus under phenanthrene exposure[J]. Chemosphere, 2006, 63(8): 1319-1327.

