发酵法生产葡萄糖酸钠工艺的优化
陈 芬
(武汉职业技术学院 生物工程学院,湖北 武汉 430074)
葡萄糖酸钠又称五羟基己酸钠, 是一种白色或淡黄色结晶粉末, 易溶于水, 微溶于醇, 不溶于醚。其分子式为C6H11O7Na, 相对分子质量为218. 14[1]。葡萄糖酸钠是合成葡萄糖酸盐的中间体,同时自身具有优良的螯合作用,在食品工业可用作食品添加剂、营养增补剂、食品保鲜剂、品质改良剂等[2],也可广泛应用于医药、化工和建筑等方面,葡萄糖酸钠市场潜力巨大。
目前葡萄糖酸钠的生产方法主要有生物发酵法、催化氧化法和电解氧化法[2-4]等。生物发酵法[5-7]逐渐成为主要的葡萄糖酸钠生产方法。该方法是利用葡萄糖经过黑曲霉产的葡萄糖氧化酶简单的脱氢作用而得到葡萄糖酸内酯和双氧水,再经过进一步水解为葡萄糖酸,双氧水经过水解作用转化为水和氧,同时添加一定量的氢氧化钠溶液保持一定的pH值而得到葡萄糖酸钠,若用碳酸钙来调节pH,则产物的形式为葡萄糖酸钙。在黑曲霉发酵葡萄糖过程中,发酵条件影响葡萄糖酸钠的得率。本研究通过工艺优化,创造适合菌体生长和生物代谢的最佳条件,充分发挥菌种的生产潜力,从而显著提高发酵产量,为黑曲霉发酵葡萄糖产葡萄糖酸钠提供相应的工艺参数,以期进一步提高生产效率和降低生产成本。
1 材料与方法
1.1 材料
1.1.1 原料 葡萄糖:上海秉奇化工科技有限公司生产。营养琼脂
1.1.2 菌种 从华中农业大学购得的黑曲霉菌种2089。
1.1.3 培养基
斜面培养基:葡萄糖8g/L,酵母膏2g/L,蛋白胨2g/L,MgS040.2g/L,NaH2P040.1g/L,KH2P040.1g/L MnS040.01g/L,琼脂1.5g/L。
种子培养基:葡萄糖60 g/L,MgS04,0.02 g/L,NaH2P040.1 g/L,KH2P040.1 g/L,MnS04100.01 g/L。
发酵培养基:葡萄糖100g/L,MgS040.03 g/L,KH2P040.29/L,(NH4)2HP04,0.9g/L,MnS040.06g/L,CaC0326g/L。灭菌后接入菌种,振荡培养。
1.1.4 仪器
恒温调速摇床、pH计、电炉、电热培养箱、无菌操作台、电子天平、722s型分光光度计。
1.1.5 试剂
葡萄糖酸钠、硫酸铜、磷酸二氢钾、硫酸镁、碳酸钙、氢氧化钠。试剂均为分析纯。
1.2 方法
1.2.1 培养方法
斜面培养:将保藏管中的菌种接种于斜面培养基上,在培养箱中培养,28℃,培养72小时。
种子培养:取新鲜的斜面活化菌种,在无菌操作台上用接种环刮下菌体接种于装有100mL 种子培养基的250mL摇瓶中,培养24小时,摇床220r/min,30℃。
发酵培养:将一定量种子液接种到装有100mL发酵培养基的250mL摇瓶中,用不同的培养24小时,摇床220r/min,30℃。
1.2.2 葡萄糖浓度的测定方法——用DNS法
DNS试剂的配制:将6.3 g 3,5-二硝基水杨酸(DNS)溶于少量热蒸馏水中,加入2mol/L NaOH溶液262mL,加入192g酒石酸钾钠, 5.0g亚硫酸钠,加热搅拌溶解,冷却后定容至1000mL容量瓶中,保存于棕色瓶中,一周后使用。
配制1.0mg/mL葡萄糖标准溶液。
葡萄糖标准曲线的绘制:分别取0,0.2,0.4,0.6,0.8,1.00mL葡萄糖标准溶液于6支25mL的具塞试管中,分别加入DNS试剂2.0mL,于沸水浴中加热2min进行显色,取出后用流水迅速冷却,各加入蒸馏水9.0mL,摇匀,在540nm处测定吸光度,绘制标准曲线。
1.2.3 发酵过程中葡萄糖酸钠的测定——用分光光度法
配制0.1mol/L葡萄糖酸钠标准溶液和0.1mol/L硫酸铜溶液。
葡萄糖酸钠标准曲线的绘制:分别取0,1,2,3,4,5,6,7,8,9,10mL葡萄糖酸钠标准溶液于11支50mL的具塞试管中,分别加入10mL硫酸铜溶液,蒸馏水定容,沸水中加热3分钟,取出用自来水冲洗试管外部使其迅速冷却至室温,722s型分光光度计在700nm波长下,以不加葡萄糖酸钠的溶液作空白,测其吸光度,绘制标准曲线。
1.2.4 菌体量的测定方法
取100mL培养液,过滤,用蒸馏水洗至中性,在80℃下烘干8小时至恒重,冷却至室温测定其质量。
1.2.5 黑曲霉发酵葡萄糖条件的优化
发酵条件的优化是改变培养基的组成、改变接种量及发酵时间、在发酵过程中改变培养温度、通气量、搅拌转速、调节pH等措施,从而强化微生物的生物合成的全过程,提高发酵产量。通过工艺条件优化,创造适合菌体生长和生物代谢的最佳条件,充分发挥菌种的生产潜力,从而显著提高发酵产量。
在实际的生产中,影响黑曲霉发酵的主要因素有葡萄糖浓度、发酵温度、发酵时间、接种量、充氧量和pH等。
本实验选择了影响微生物发酵的三个主要因素:发酵时间、温度、和黑曲霉的接种量。分别测定20小时内发酵液中残糖量与菌体浓度,确定三个因素对发酵的影响,得到最佳优化工艺。
2 结果与讨论
2.1 葡萄糖的起始浓度对菌体发酵的影响
通过考察葡萄糖的起始浓度分别为60g/L、80g/L、100 g/L、120g/L,发酵20h时,测定葡萄糖酸钠的产量,结果如图1。
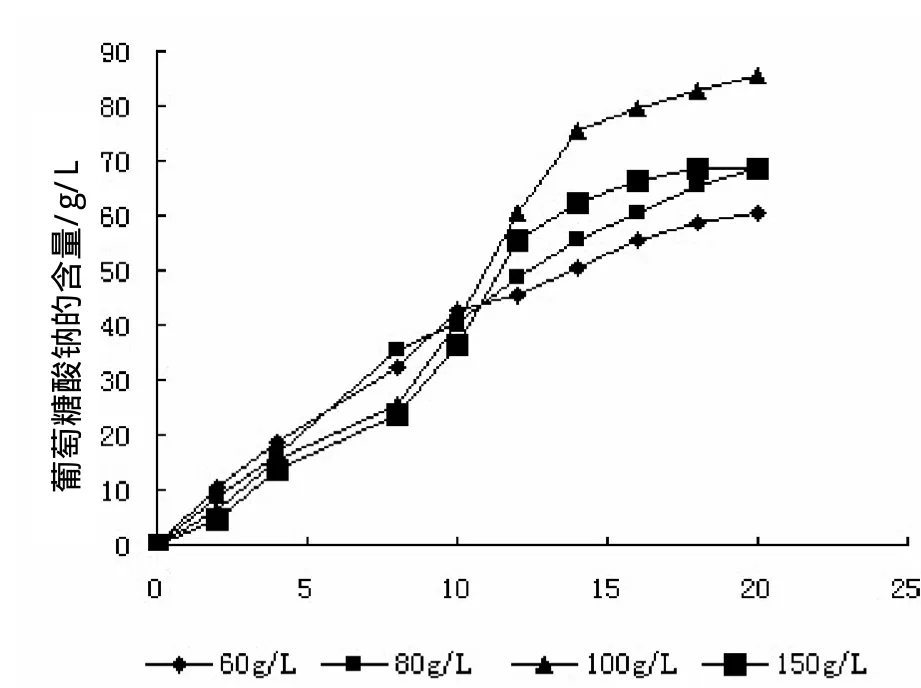
图1 葡萄糖不同初始浓度对产葡萄酸钠的影响
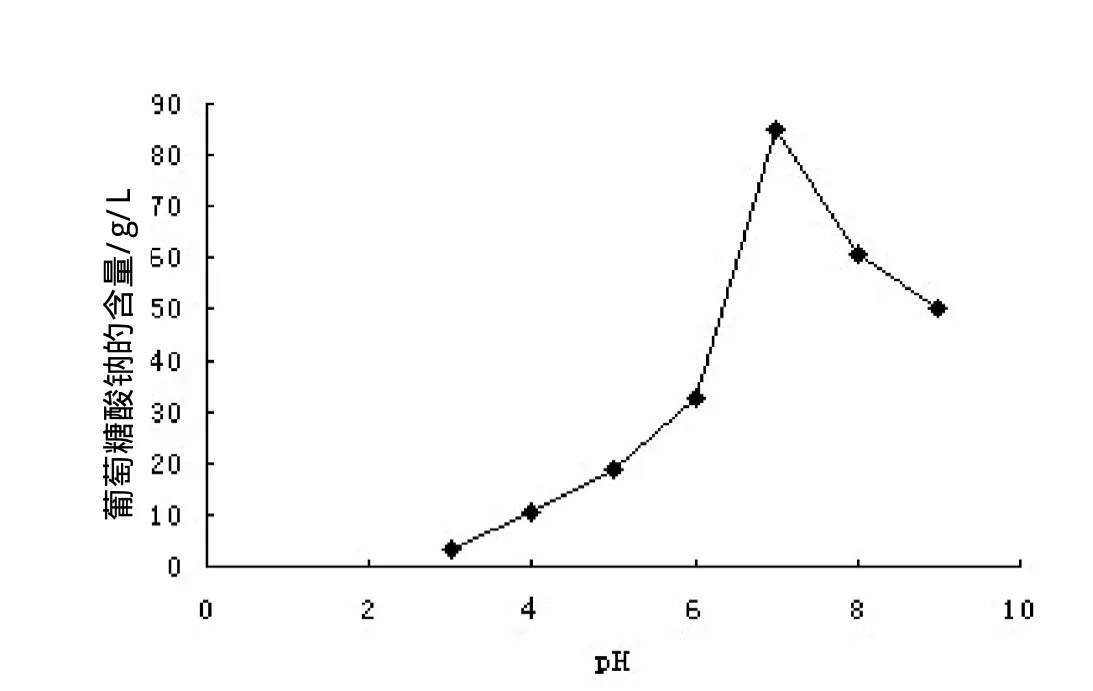
图2 pH值对葡萄糖酸钠含量的影响
从图1可以看出,葡萄糖最佳起始浓度为100g/L左右,在这种条件下,葡萄糖酸钠的产量可达到85g/L以上。
在整个发酵过程中,葡萄糖一部分被用于菌体生长和维持等生理代谢过程,另一部分则被菌体代谢过程中产生的葡萄糖氧化酶催化生成预期产物。由于葡萄糖经葡萄糖氧化酶作用生成葡萄糖酸的过程需要氧气的参与,因而决定了氧气在黑曲霉发酵产葡萄糖酸工艺过程的中心地位。黑曲霉发酵对葡萄糖浓度度要求高,当葡萄糖浓度较低时,发酵液中的溶氧水平较高,反应速度较快,但葡萄糖浓度太低,生产量小。而当葡萄糖浓度增加时,随着反应的进行,蛋白质的浓度降低,当发酵液中有Ca2+时,生成的钙盐就会结晶析出,将导致系统溶氧的降低而使黒曲霉产酶速度变慢甚至停滞。
2.2 pH对菌体发酵的影响
微生物的生长及产物的形成必须进行多种多样的酶催化反应,pH的变化会引起各种酶活力的改变,对菌体形态和代谢途径影响很大。黑曲霉可产生多种弱有机酸,如柠檬酸,葡萄糖酸,草酸等,这些有机酸的生产取决于反应液的pH。当pH低于3.5时可推动TCA循环,从而产生柠檬酸,葡萄糖酸钠的产量很低。pH在4.5到8时,可产生葡萄糖酸。本实验控制pH值从3-9,分别发酵20h, 观察葡萄酸钠的产量,结果如图2,将发酵液的pH值控制在7左右,产量最大,在实验中通常是通过在发酵液中加入一定量的CaC03以维持黑曲霉生长发酵过程中发酵液pH值的稳定,防止由于黑曲霉发酵产酸使发酵液中pH值过低而得到柠檬酸等有机酸而降低生产效率。
2.3 发酵时间对菌体发酵的影响
通过测定发酵液中菌体含量随时间的变化趋势证明当发酵到20h时,发酵液中的菌体含量达到最高值,在发酵后阶段,黑曲霉开始衰亡,产酶能力下降,酶活力也随之逐渐降低,菌体的含量基本保持平衡。
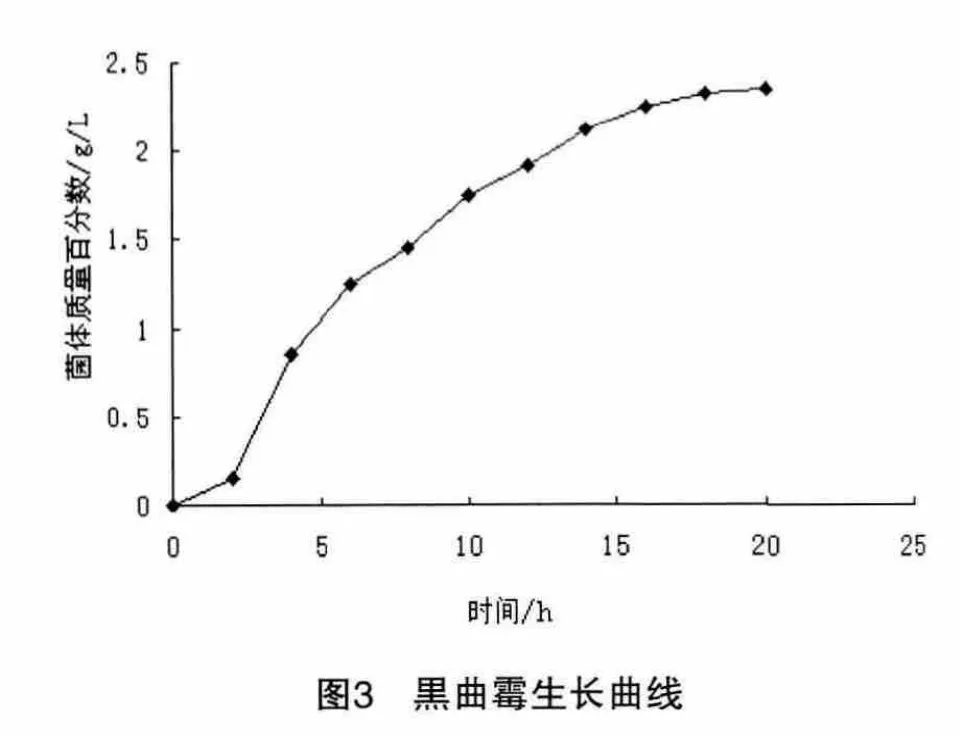
对发酵液每隔2小时测菌体量的变化情况,绘制菌体生长曲线,如图3所示。
从图3可以看出,黑曲霉菌体在从种子培养液接入发酵培养液的最初2小时中,逐渐适应周围的生长环境,2小时后进入对数生长期,菌体量迅速增加,直到l2小时后质量增长变缓,菌体进入稳定期,15小时后菌体质量变化不大,此时发酵培养基中的营养物质基本全部消耗掉,产酶量达最大。在发酵后阶段,黑曲霉开始衰亡,产酶能力下降,酶活力也随之逐渐降低。
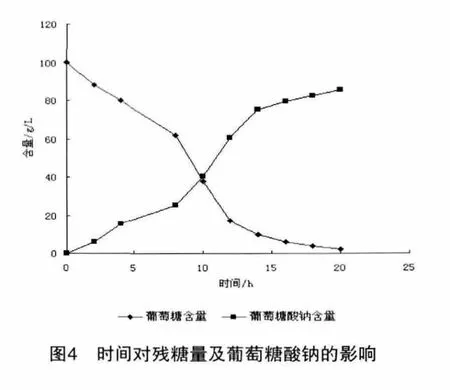
从图4也可以看出黑曲霉在发酵开始阶段为黑曲霉生长阶段,此时菌体量增加较快,葡萄糖含量逐步下降,此时所产葡萄糖酸钠增量较小,黑曲霉经过一段时间产酸量增加,葡萄糖含量下降速度较快,此时菌体量变化不大,用CaCO3控制发酵液的pH值为7,并不断搅拌,葡莓糖酸钠产量增加较快,发酵至20h,发酵液中葡萄糖基本消耗,含量不足2%班,葡萄糖酸钠的浓度基本保持平衡,此时可认为发酵结束。
2.4 温度对菌体生长的影响
微生物的生长和产物的合成都是在各种酶的催化下进行的,温度是保持酶活性的最重要条件,从酶促反应动力学来看,温度升高,酶促反应速度加快,生长繁殖快,但温度越高,酶失活越快,菌体易于衰老,影响产物生成。温度还影响营养物和氧在发酵液中的溶解、菌体生物合成方向以及菌体的代谢调节。在最适温度下,菌种可以获得最佳的生长代谢效果,往往各种代谢途径也比较旺盛。因此确定菌体发酵最适温度对产酸量的影响至关重要。改变摇床温度,黑曲霉在不同培养温度下对发酵终结发酵液中残糖量的影响情况如图5所示。
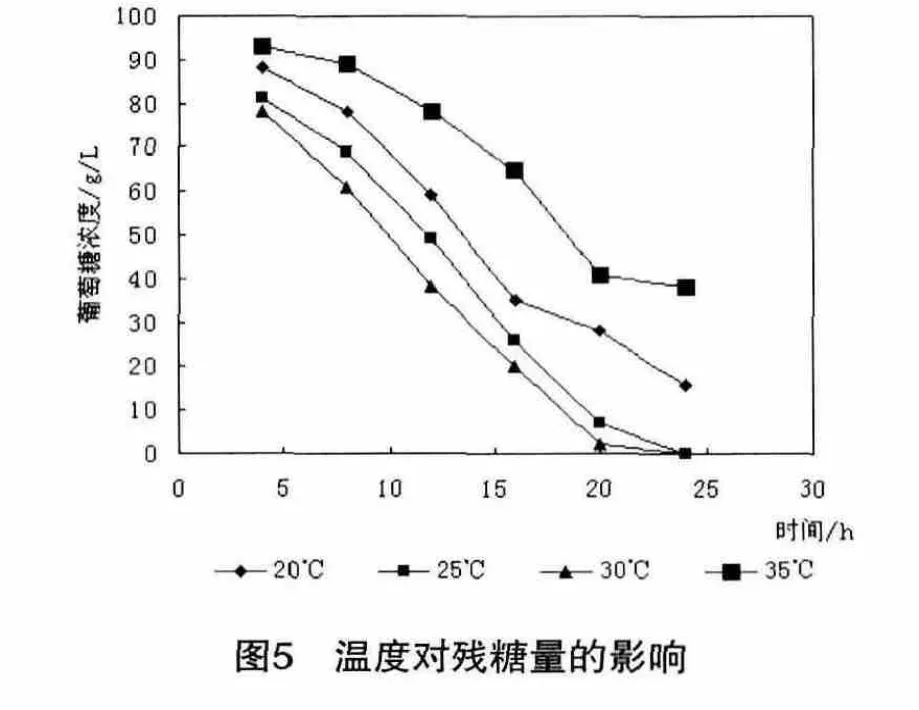
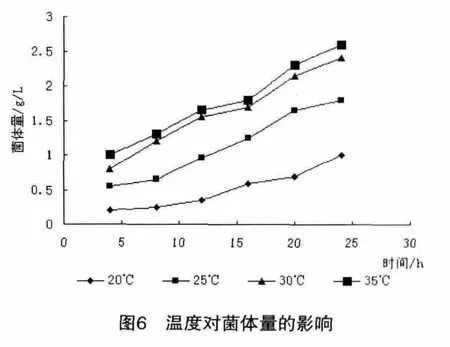
从图5和图6看出,从发酵液中葡萄糖的消耗速度和黑曲霉的菌体量随温度的升高而增加,温度低于30℃时发酵终结发酵液中存在一定浓度的葡萄糖,反应不完全,黑曲霉所产酶活力降低,摇床温度为30℃时,黑曲霉生长情况最好,因而最佳发酵温度为30℃。
2.5 接种量对菌体发酵的影响
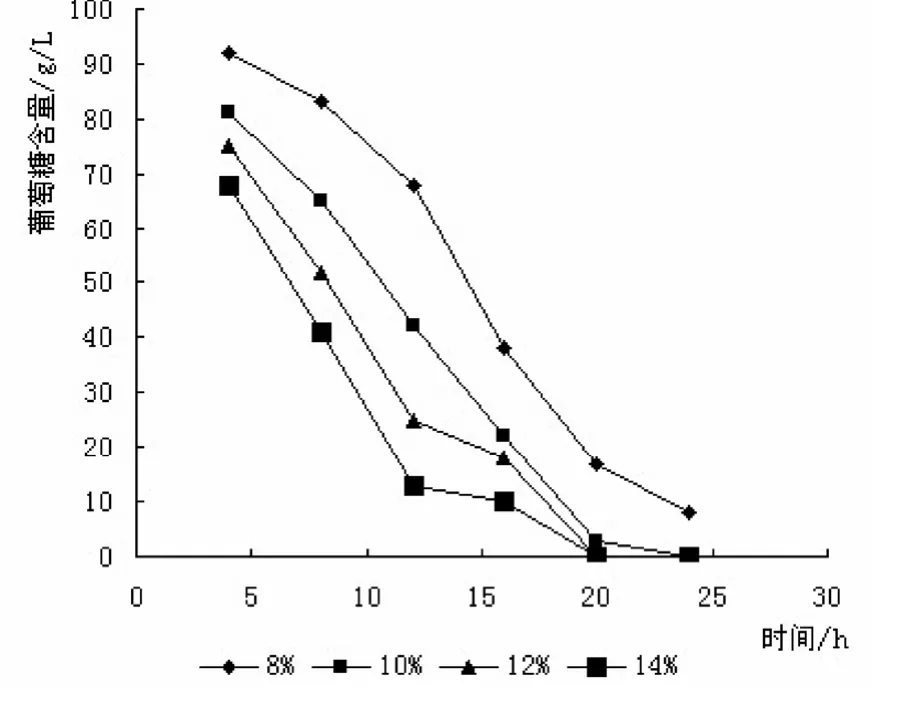
图7 接种量对残糖量的影响
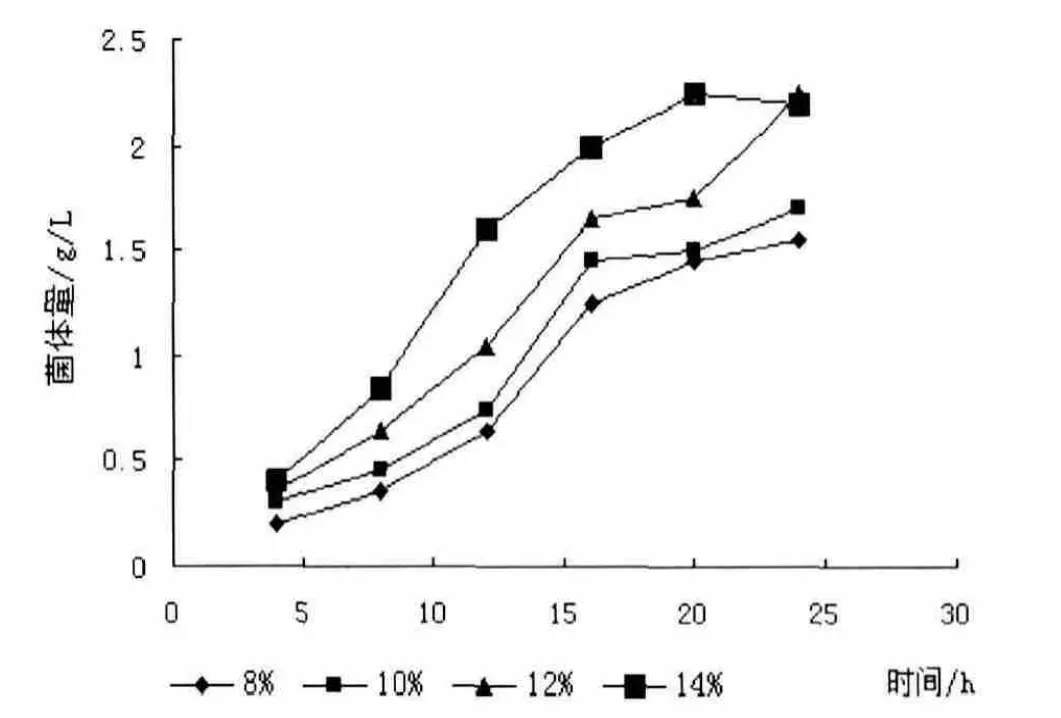
图8 接种量对菌体量的影响
接种量对黑曲霉发酵过程中有很重要的影响,接种量低会延长发酵时间,降低生产效率,太高会过多消耗发酵液中营养物质和葡萄糖,降低产量。因此,采用发酵培养基,考察了8%、10%、12%、14%不同接种量下菌体发酵情况,分别测定了接种量对发酵终结残糖量和菌体量的影响。
从图7和图8可以看出,接种量在8%时,发酵终结发酵液中有很高的残糖量,且菌体量较小,接种量在10%以上时,发酵液中葡萄糖全部消耗,接种量高于10%时,虽然葡萄糖全部消耗,但有一部分作为黑曲霉营养物质被消耗,接种量过高,发酵液中过高的菌体量反而阻止了黑曲霉的进一步生长发酵。采用较大的接种量可以缩短菌体繁殖达到高峰的时间。但如果接种量过多,营养物质迅速消耗,菌体早衰,造成发酵后劲不足,从而使产酶量降低。而接种量过小,延长发酵周期,同时菌体的生长与产酶均受显著影响,
2.6 最佳发酵培养条件的确定
通过上述实验,最后确认黑曲霉发酵葡萄糖产葡萄糖酸钠的最佳发酵条件葡萄糖初始浓度为100g/L,pH7,发酵温度为30℃,发酵时间为20h,接种量10%,在此条件下发酵液葡萄糖酸钠的含量可达85g/L以上,产量比其它方法都高[3]。
3 结论
葡萄糖酸钠已广泛应用于食品、医药、建筑及化工等领域,近年来,随着其用途的不断开发,葡萄糖酸钠产量和需求量也不断增加。通过黑曲霉发酵葡萄糖产葡萄糖酸钠逐渐成为葡萄糖酸钠生产的主要方法。
通过本试验探究,确定了黑曲霉发酵葡萄糖产葡萄糖酸钠的最佳发酵条件,此条件下黑曲霉产葡萄糖酸钠量最高。为黑曲霉发酵葡萄糖产葡萄酸钠提供了相应的工艺参数,有利于提高葡萄糖酸钠的得率。也为进一步在发酵罐中黑曲霉发酵大量生产葡萄糖酸钠的研究提供参考。
[1]周秀琴.新功能呈味调料葡萄糖酸钠与葡萄糖酸钾[J].江苏调味副食品,2003,20(5):28-29.
[2]陈建初,郭均高,徐润秋. 葡萄糖酸钠水剂产品生产与应用研究[J]. 中国混凝土外加剂, 2008,(4):40-44.
[3]梁洁,王冲,刘红梅,等.葡萄糖酸钠的制备方法[J].河北化工,2007,30(1):12-14.
[4]Sankpal N V,Kulkarni B D.Optimization of fermentation conditions for gluconic acid production using Aspergillus niger immobilized on cellulose microfibrils [J].Process Biochem, 2002,(37):l343-1350.
[5]Singh 0 V,Jain RK,Singh R P.Gluconic acid production under varying fermentation Conditions by Aspergillus niger[J].Chem Technol Biotechnol, 2003,(78):208-212.
[6]LIU J Z,WANG L P,ZHANG Q L.Optimization of glucose oxidase production by Aspergillus niger in a benchtop bioreactor using response sur-face methodology[J].Joumal of Microbiology and Biotechnology,2003,19:317-323.
[7]黄腾华. 葡萄糖酸钙和葡萄糖酸钠发酵[J].发酵科技通讯,2006,(2):21-23.

