围绝经期肥胖妇女腰臀比、游离睾酮指数、脂联素、胰岛素抵抗指数等指标的分析
阳晓敏 冯 毅 陈静平 黄旭美 郑小敏 丘丽玉
(广西贵港市人民医院妇二科,贵港市 537100)
肥胖是指人体内由遗传和环境因素(包括激素内环境异常)共同作用引起的体内脂肪堆积过多,其与包括性激素异常在内的内分泌紊乱密切相关,激素的分泌方式、代谢途径及其在靶器官的作用水平发生了改变。肥胖可影响性激素的水平,而肥胖与性激素在体内的作用关系较为复杂。本研究探讨不同月经状态围绝经期肥胖妇女腰臀比(WHR)、游离睾酮指数(FAI)、胰岛素抵抗指数(HOMA-IR)、脂联素(APN)等指标的差异。
1 资料与方法
1.1 临床资料 选择在我院妇科就诊的围绝经期肥胖妇女共96例作为研究对象,符合以下标准:①年龄:40~50岁(围绝经期);②以体重指数(BMI)或WHR为肥胖诊断指标,BMI≥25为肥胖,WHR>0.8为中心性肥胖。排除标准:①急性炎症、糖尿病、高泌乳素血症、肾上腺疾病、高血压、甲状腺、肝肾功能异常或心血管疾病;②近3个月曾使用减肥药、激素类药物或影响糖脂代谢的药物;③子宫及卵巢肿瘤;④吸烟、酗酒者。分组:Ⅰ组:月经周期规律,共30人;Ⅱ组:2次月经周期改变≥7 d,停经 <2个月,共33人;Ⅲ组:闭经2~12个月,共33人。
1.2 检测方法 所有研究对象于月经第3~5天上午8~9时(闭经患者B超检查卵泡<1 cm时)采集静脉血,分离血清后放入-80℃冰箱保存待测。空腹胰岛素(FINS)、E2、FSH及总睾酮测定采用化学发光法进行,采用全自动化学发光免疫分析仪(Cobase 601,瑞士罗氏公司)及配套试剂。APN及性激素结合球蛋白(sex hormone-binding globulin,SHBG)检测使用放射免疫分析法,试剂分别购自美国Millipore Corporation公司及法国Cisbio Bioassays公司生产的放射免疫试剂盒,均按说明书标准操作。空腹血糖(FPS)的检测:日立7600(HITACHI7600)全自动生化分析仪,采用己糖激酶法,试剂盒购自日本和光纯药工业株式会社。
1.3 评估指标及方法 FAI=[(总睾酮×100)/SHBG]作为反映雄激素生物学活性高低的指标[2]。胰岛素抵抗指标采用稳态模式。HOMA-IR=FPG×FINS/22.5。
1.4 统计学分析 采用SPSS 19.0统计分析软件包进行分析,计量资料用均数±标准差±s)表示,3组间的比较用单因素方差分析,并进行两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 均衡性比较 3组患者血清雌激素(E2)、年龄和体重比较差异无统计学意义(P>0.05),具有可比性。见表1。
表1 3组患者E2、年龄及体重比较 (±s)

表1 3组患者E2、年龄及体重比较 (±s)
组别 n E2(pg/mL) 年龄(岁) 体重(kg)Ⅰ33 32.40 ±64.16 44.45 ±3.46 70.06 ±7.39 30 25.15 ±13.60 44.33 ±3.59 67.33 ±6.34Ⅱ 33 22.67 ±14.13 44.52 ±3.33 68.91 ±6.29Ⅲ
2.2 各项指标比较 3组WHR、APN、FAI和 HOMA-IR等差异具有统计学意义,见表2。Spearman相关分析示WHR与FAI、HOMA-IR正相关,与血清APN呈负相关;FAI与HOMA-IR呈正相关,差异均有统计学意义。
表2 3组围绝经期妇女各项指标比较 (±s)
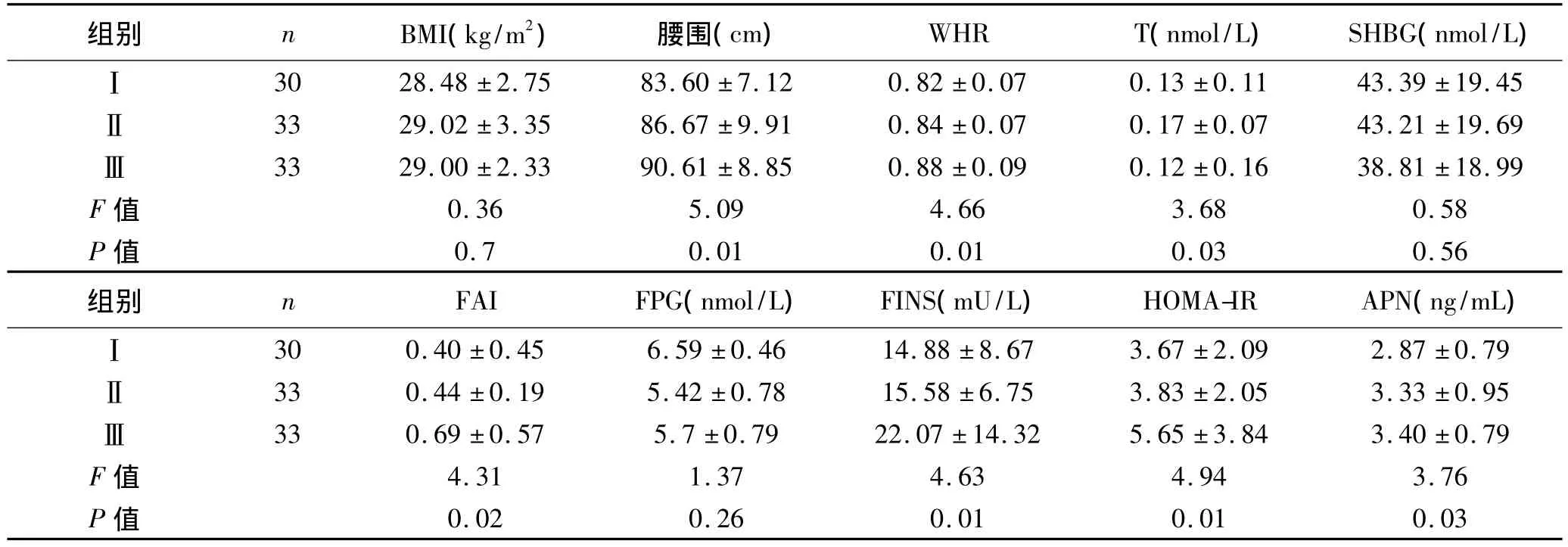
表2 3组围绝经期妇女各项指标比较 (±s)
组别 n BMI(kg/m2) 腰围(cm) WHR T(nmol/L) SHBG(nmol/L)1 43.39 ±19.45Ⅱ33 29.02 ±3.35 86.67 ±9.91 0.84 ±0.07 0.17 ±0.07 43.21 ±19.69Ⅲ33 29.00 ±2.33 90.61 ±8.85 0.88 ±0.09 0.12 ±0.16 38.81 ±18.99 F 值 0.36 5.09 4.66 3.68 0.58 P 值 0.7 0.01 0.01 0.03 0.56组别 n FAI FPG(nmol/L) FINS(mU/L) HOMA-IR APN(ng/mL)Ⅰ30 28.48 ±2.75 83.60 ±7.12 0.82 ±0.07 0.13 ±0.1 2.87 ±0.79Ⅱ33 0.44 ±0.19 5.42 ±0.78 15.58 ±6.75 3.83 ±2.05 3.33 ±0.95Ⅲ33 0.69 ±0.57 5.7 ±0.79 22.07 ±14.32 5.65 ±3.84 3.40 ±0.79 F 值 4.31 1.37 4.63 4.94 3.76 P值Ⅰ30 0.40 ±0.45 6.59 ±0.46 14.88 ±8.67 3.67 ±2.09 0.02 0.26 0.01 0.01 0.03
3 讨论
肥胖是以脂肪堆积为特征,可以导致内分泌系统的功能改变,影响血液中性激素的水平,改变激素的分泌方式与代谢途径及其在靶器官的作用[3]。近年来的研究表明,性激素也可以直接影响脂肪组织的新陈代谢、脂肪的堆积与分布[4]。Ivandic 等[5]研究发现,围绝经期女性体重指数、腹部脂肪增加与雄激素活性增强、胰岛素抵抗相关。Ross等[6]报告围绝经期女性的相对雄激素水平升高与内脏型肥胖及胰岛素抵抗密切相关。研究表明,高雄激素血症的女性患者内脏脂肪含量较正常女性增加并且具有较高的腰/臀比率[7]。本研究结果显示,肥胖围绝经期妇女WHR、FAI、HOMA-IR呈正相关,与文献报道的相一致。有研究发现,部分超重或肥胖妇女有月经失调、不孕和流产。研究发现肥胖妇女无排卵周期、月经稀发、多毛症等发病率显著高于体重正常的妇女[8]。本研究中,不同月经状态的三组患者年龄、体重及E2相当,WHR与HOMA-IR、FAI及APN水平有差异,与文献报道的相一致。
肥胖女性由于胰岛素抵抗引起的高胰岛素血症对卵巢和肾上腺雄激素合成具有刺激作用,所以肥胖常伴有高雄激素血症。Grace等[9]对875名绝经后妇女研究后认为,游离睾酮与IR成线形关系,为正相关。游离睾酮与腰围、WHR呈正相关,而腰围是胰岛素抵抗的独立的预测因子[10],BMI增加常与腹部脂肪的堆积与胰岛素抵抗有关[11],WHR是胰岛素抵抗和高胰岛素血症的标志物[12]。本研究中 WHR与 FAI、HOMA-IR正相关,FAI与HOMA-IR正相关,差异均有统计学意义。
目前已发现的脂肪细胞因子有数十种,如瘦素、抵抗素、APN、白细胞介素-6等,肥胖正是通过白色脂肪组织分泌的这些激素和细胞因子从不同机制干扰着女性生殖内分泌和代谢。文献报道APN的增加与臀围的减少显著相关[13]。TNF-α可以降低肥胖患者的酪氨酸活性,而APN可以抑制TNF-α,因此肥胖者APN减少可能是导致胰岛素抵抗的分子机制之一[14]。本研究中APN与WHR呈负相关,差异有统计学意义。
总之,APN、胰岛素抵抗、游离睾酮可能与肥胖及其相关疾病的发生、发展密切相关 。绝经过渡期女性体内游离睾酮的上升、SHBG的下降是心血管疾病发病的危险因素[15]。所以继续深入开展这方面的研究将可能为肥胖症、胰岛素抵抗及代谢综合征的发病机制和治疗提供了一个新的方向。
[1]叶任高主编.内科学[M].第5版.北京:人民卫生出版社,2000:89.
[2]Wheeler MJ.The determination of bioavailable testosterone[J].Ann Clin Biochem,1995,32(Pt 4):345 -357.
[3]Pasquali R.Obesity,fat distribution and infertility[J].Maturitas,2006,54(4):363 -3711.
[4]Mayes JS,Watson GH.Direct effects of sex steroid hormones on adipose tissues and obesity[J].Obes Rev,2004,5(4):197-216.
[5]Ivandic A,Prpic-Krizevac I,Bozic D,et al.Insulin resistance and androgens in Healthy women with different body fat distributions[J].Wien Klin Wbehensclir,2002,11(8-9):321-326.
[6]Ross R,Freeman J,Hudson R,et al.Abdominal obesity,muscle composition,and insulin resistance in premenopausal women[J].J Clin Endoerinol Metab,2002,87(11):5044-5051.
[7]Derman RJ.Effects of sex steroids on women's health:implication for practitioners[J].Am J Med,1995,9(1):137 -143.
[8]Mulders AG,Laven JS,Eijkemans MJ,et al.Patient predictors for outcome of gonadotrophin ovulation induction in women with normogonadotrophic anovulatory infertility:a meta-analysis[J].Hum Reprod Update,2003,9(5):429 -449.
[9]Grace MK,Elizabet h BC,Laughlin GA,et al.Association of endogenous sex hormones and insulin resistance among postmenopausal women:results from the postmenopausal estrogen progestin intervention trial[J].The Journal of Clinical Endocrinology & Metabolism,2003,88(4):1646-1652.
[10]Hwu CM,Fuh JL,Hsiao CF,et al.Waist circumference predicts metabolic cardiovascular risk in postmenopausal Chinese women menopause[J].Menopause,2003,10(1):73 -80.
[11]Ivandic A,Pp rpic KI,Bozic D,et al.Insulin resistance and androgens in healthy women different body fat distributions[J].Wien Klin Wochenschr,2002,114(829):321 -326.
[12]Borugian M J,Sheps SB,Kim SC,et al.Waist-to-hip ratio and breast cancer mortality[J].Epidemiol,2003,158(10):963-968.
[13]Yang Ws,Lee WJ,Funahashi T,et al.Weight reduction increases plasma levels of an adipose-derived anti-inflammatory protein adiponectin[J].J Clin Endocrinol Metab,2001,86(8):3815-3819.
[14]Matsuzawa Y.Adipocyte function and insulin resistance[J].Nippon Rinsho,2000,58(2):338 -343.
[15]Hellry G.Burger,Emma C.Dudley,JiSheng Cui,et al.A prospective longitudinal study of serum testosterone,dehydroepiandrosterone sulfate,and sex hormone-binding globulin levels through the menopause transition[J].J Clin Endoerinol Metab,2000,(85):2832 -838.

