脱壳病和吻肿病东风螺体内致病菌及条件致病菌菌相研究
李淑芳,邱德全,张继东*,杨世平,贾春红,邱明生
(1.广东海洋大学动物医学系,广东 湛江 524088;广东海洋大学水产学院,广东 湛江 524088)
东风螺(Babyloniaareolata)属软体动物腹足纲、蛾螺科、东风螺属。我国的主要养殖品种有方斑东风螺(Babyloniaareolata)、泥东风螺(Babylonialutosa)和台湾东风螺(Babyloniaformosae)三种。2000年以来,东风螺在我国广东、海南、福建等南海地区已实现人工规模化养殖。目前,对东风螺规模化养殖危害严重的主要疾病为脱壳病和吻肿病。东风螺脱壳病在我国首次发生于2002年,且在2004年出现较大规模暴发,至今在东风螺养殖场时有发生,发病率可高达80%以上,具有传染性和复发性[1]。为探讨东风螺脱壳病和吻肿病与条件致病菌的相关性,从2011年开始,本课题组对广东省湛江市某大型东风螺规模化养殖场发病螺池和未发病螺池的水样进行了异养菌菌落总数检测,并对脱壳病和吻肿病病螺以及健康螺进行了条件致病菌的分离与鉴定,以期找出东风螺脱壳病、吻肿病与致病菌及条件致病菌感染的相关关系,为东风螺疾病的病因学研究和防治技术研究提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
2011年,湛江市某东风螺养殖场(循环水养殖),方斑东风螺发生脱壳病,同场养殖的泥东风螺发生脱壳病和吻肿病混合感染。选择脱壳病方斑东风螺养殖池、脱壳病-吻肿病混合感染的泥东风螺养殖池和未发病的方斑东风螺养殖池各1个,每池采集水样各200 mL。从脱壳病方斑东风螺池选取5只脱壳后健活的软体螺,从脱壳病-吻肿病混合感染螺池选取5只吻肿病螺,从未发病方斑东风螺螺池选择临床健康螺5只,分别放入盛有适量原池水的灭菌三角瓶备检。
1.1.2 主要试剂与培养基
MightyAmp®DNA Polymerase 试剂盒及 DNA Marker,购自Takara 公司大连分公司;细菌16S rDNA鉴定通用引物,由上海英骏生物技术有限公司广州分公司合成。科玛嘉弧菌显色培养基,购于上海科玛嘉微生物技术有限公司;TCBS培养基,购自广东环凯微生物科技有限公司;弧菌科细菌生化鉴定管,购于浙江天和微生物试剂有限公司;5%兔血琼脂平板,由本试验室自行制备。
1.1.3 主要仪器
PCR仪,Biometra Tg PCR;DYY-8C型电泳仪,北京六一仪器厂;SPX-250B-Z型生化培养箱,上海博迅实业有限公司。
1.2 试验方法
1.2.1 水体异养菌菌落总数测定
采用常规平皿倾注计数法,测定发病池和未发病池内异养菌的菌落总数。培养温度35 ℃,培养时间48 h。
1.2.2 条件致病菌的分离
将脱壳病病螺软体、带壳吻肿病病螺及健康螺样品用灭菌生理盐水冲洗,采用无菌钳破碎螺壳,取出完整软体,分别用灭菌生理盐水冲洗3遍后,用灭菌手术剪剪断螺的足部肌肉,将新鲜断面涂布接种于5%兔血琼脂平板,并用灭菌接种环蘸取螺生殖腺内容物划线接种于另一兔血琼脂平板。35 ℃培养18~24 h。
1.2.3 TCBS培养基和科玛嘉弧菌显色培养基培养
从上述兔血琼脂平板上挑选溶血和不溶血的单个菌落,每板挑选3~5个菌落,分别划线接种于3.5%NaCl营养琼脂培养基(pH6.8)进行纯化培养。然后,从营养琼脂平板上分别转接至TCBS培养基和科玛嘉弧菌显色培养基,35 ℃培养18~24 h。根据细菌在不同培养基上的生长特性和菌落特征,初步判定细菌种类。
1.2.4 16S rDNA PCR扩增与序列分析
将上述试验分离得到的菌株,用其18 h的新鲜培养菌落,进行16S rDNA PCR扩增与序列分析。
1.2.4.1 引物设计与合成
根据E.coli16S rDNA基因序列保守区域设计两段引物(16SF:5′-AGA GTT TGA TCC TGG CTC AGA ACG AAC GCT-3′;16SR:5′-TAC GGC TAC CTT GTT ACG ACT TCA CCC C-3′),由上海英骏生物技术有限公司广州分公司合成。
1.2.4.2 16S rDNA扩增与琼脂糖凝胶电泳
将分离菌株分别划线接种于3.5%NaCl营养琼脂(pH7.8),35 ℃培养18 h,用于16S rDNA扩增。
根据TaKaRa公司产品MightyAmp®DNA Poiymerase Ver.2使用说明,用菌落PCR方法进行扩增。反应体系包括2×MightyAmp buffer25 μL,Primer 1和Primer 2各15 pmol, MightyAmp DNA Polymerase 1 μL(0.025 U/μL),加ddH2O至50 μL。
PCR反应程序为:98 ℃预变性2 min;98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸90 s,进行40个循环;68 ℃延伸90 s; 4 ℃保存。PCR扩增产物进行1%琼脂糖凝胶电泳。
1.2.4.3 16S rDNA PCR产物测序
将16S rDNA扩增反应体系与引物一同系送上海英骏生物技术有限公司广州分公司测序部测序。
1.2.5 生化反应试验
将分离菌株的新鲜固体培养物,分别接种于葡萄糖、蔗糖、阿拉伯糖、甘露糖、肌醇、VP试验、蛋白胨水、赖氨酸、精氨酸、0%NaCl胨水、3%NaCl胨水、6%NaCl胨水、8%NaCl胨水、10% NaCl胨水等生化反应试验管,35 ℃培养,按规定时间观察并记录结果。
2 结 果
2.1 水体菌落总数测定
水体异养菌菌落总数检测结果显示,未发病方斑东风螺螺池水体异养菌菌落总数为7.6×104cfu/mL,脱壳病方斑东风螺螺池水体异养菌菌落总数为1.34×106cfu/mL,泥东风螺脱壳病-吻肿病螺池水体异养菌菌落总数为1.46×107cfu/mL。由检测结果可见,发病东风螺池内异养菌数量明显高于未发病池内异养菌数量。
2.2 细菌分离鉴定
用兔血琼脂平板从2种发病东风螺、健康东风螺体内共分离到131株细菌,该131株细菌在TCBS培养基和科玛嘉弧菌显色培养基上均能生长。根据细菌在TCBS培养基和弧菌显色培养基上的生长特性,结合生化试验和16S rDNA序列分析,共110株细菌得到鉴定,结果如下:脱壳病方斑东风螺样品分离得到37株细菌,鉴定结果为副溶血弧菌10株、哈氏弧菌17株、创伤弧菌2株、河流弧菌2株、Vibriohepatarius2株、腐败希瓦氏菌1株、海藻希瓦氏菌2株、芽孢杆菌1株,其中优势菌株为哈氏弧菌和副溶血弧菌(溶血菌株);吻肿病泥东风螺样品分离得到33株细菌,分别是副溶血弧菌3株、哈氏弧菌7株、鲍鱼希瓦氏菌9株、海藻希瓦氏菌12株、芽孢杆菌2株,其中优势菌株为海藻希瓦氏菌、鲍鱼希瓦氏菌和哈氏弧菌;健康方斑东风螺样品分离得到40株细菌,分别是副溶血弧菌26株、创伤弧菌1株、Vibriohepatarius10株、海藻希瓦氏菌1株、美人鱼发光杆菌2株,其中优势菌株为副溶血弧菌(非溶血菌株)和Vibriohepatarius。其余21株细菌因测序失败和生化反应不确定,未能作出鉴定。各类试验样品中细菌种类及溶血菌株的分布情况见表1。
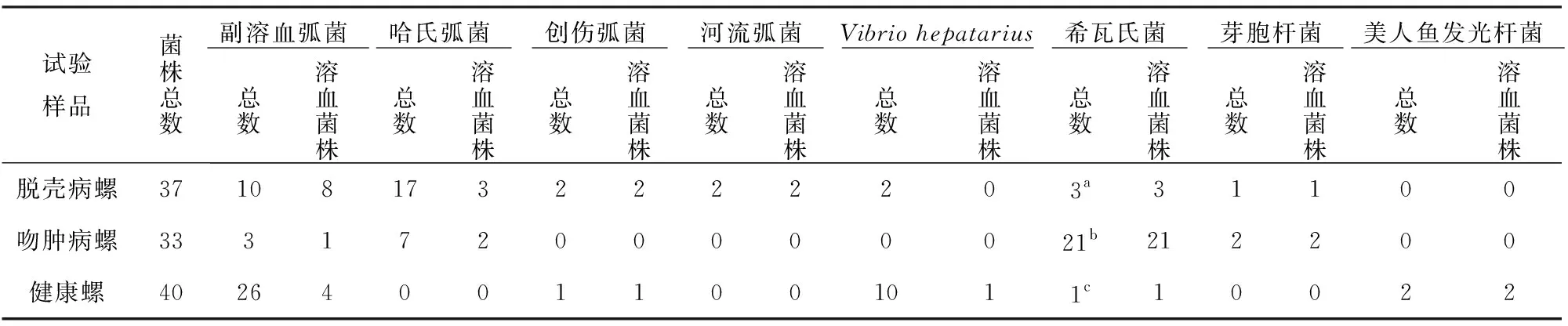
表1东风螺体内条件致病菌分离鉴定结果(株)Table 1 The Isolated and Identified Results of the conditional pathogenic bacteria in abylonia areolate (strains)
注:a:脱壳病螺样品分离的3株希瓦氏菌包括:腐败希瓦氏菌1株,海藻希瓦氏菌2株;b:吻肿病螺样品分离的21株希瓦氏菌包括:鲍鱼希瓦氏菌9株、海藻希瓦氏菌12株;c:健康螺样品分离的1株希瓦氏菌为海藻希瓦氏菌
2.3 16S rDNA序列分析
分离菌株的16S rDNA扩增产物,经1%琼脂糖凝胶电泳,均扩增出1 490 bp的基因片段,其16S rDNA测序结果,通过NCBI的Blast程序(http:∥blast.ncbi.nih.gov/blast)进行核苷酸序列比对分析,结果表明,有共39株细菌与副溶血性弧菌ATCC 1782菌株(GenBank序列注册号为NR 041838)同源性100%,24株细菌与哈氏弧菌NCIMB 1 280菌株(GenBank 序列注册号为NR 043165)同源性100%,3株细菌与创伤弧菌324号菌株(GenBank序列注册号为NR 036888)同源性99%,2株细菌与河流弧菌VL 5125菌株(GenBank序列注册号为NR 036790)同源性98%,12株细菌与Vibriohepatarius与LMG 20362菌株(GenBank序列注册号为NR 025491)同源性为100%,1株细菌与腐败希瓦氏菌LMG 26268菌株(GenBank序列注册号别为NR 044863)同源性100%,15株细菌与海藻希瓦氏菌同源性OK-1菌株(GenBank序列注册号NR028673)同源性99%,9株细菌与鲍鱼希瓦氏菌DW.1菌株(GenBank序列注册号为NR 044134)同源性99%,另有3株细菌与aerius芽胞杆菌 NBRC15535菌株(GenBank序列注册号为NR 041455)同源性100%,2株与美人鱼发光杆菌与ATCC 33539菌株(GenBank序列注册号为NR 040831)同源性100%。其他菌株因测序失败没有进行分类。
131株分离菌株经16S rDNA序列分析,共鉴定出弧菌属细菌5种,希瓦氏菌属细菌3种,芽胞杆菌属细菌1种和美人鱼发光杆菌1种。各类细菌在不同试验样品中的分布见表1。
2.4 溶血特性及生化反应特性
分离菌株在兔血琼脂平板上的生长情况显示,脱壳病方斑东风螺体内分离的副溶血弧菌多数菌株对兔红细胞具有溶血活性(8/10),健康螺螺体内分离的副溶血弧菌仅有少数菌株具有溶血活性(4/26)。脱壳病和吻肿病病螺体内分离的哈氏弧菌仅有少数菌株具有溶血活性(5/24),且溶血菌株在兔血琼脂平板上形成狭窄的透明溶血环。Vibriohepatarius多没有溶血活性,创伤弧菌、河流弧菌、所有希瓦氏菌、芽胞杆菌、美人鱼发光杆菌均呈完全溶血,详见表2。
除芽胞杆菌和美人鱼发光杆菌外,其余菌株的生化反应试验结果表明,分离到的副溶血弧菌、哈氏弧菌、创伤弧菌、河流弧菌的生化反应特性与资料记载相符[2]。希瓦氏菌生化反应结果显示,有3种生化反应类型,分别为腐败希瓦氏菌、海藻希瓦氏菌和鲍鱼希瓦氏菌,结果详见表2。

表2 分离细菌的生化反应特性Table 2 Biochemical characteristics of isolated bacteria
注:“+/-”表示产酸不产气;“-/-” 表示不产酸不产气; “±”表示多数菌株试验阳性,少数阴性;“-/+”表示多数菌株试验阴性,少数阳性
3 讨 论
3.1 脱壳病和吻肿病东风螺体内细菌菌相分析
本试验从脱壳病和吻肿病病螺及健康螺体内分离到的细菌多为条件致病菌,脱壳病和吻肿病病螺样品以及健康螺样品中细菌种类各不相同,而且各类试验螺样品中,各自的优势菌株种类也存在较大差异。脱壳病方斑东风螺体内分离出8种细菌,优势菌株为副溶血弧菌(溶血菌株)和哈氏弧菌;吻肿病泥东风螺体内分离出4种细菌,优势菌株为海藻希瓦氏菌、鲍鱼希瓦氏菌和哈氏弧菌;健康方斑东风螺体分离出5种细菌,优势菌株为副溶血弧菌(非溶血菌株)和Vibriohepatarius。哈氏弧菌、河流弧菌、海藻希瓦氏菌、鲍鱼希瓦氏菌仅分离于病螺体内,副溶血弧菌同时存在于病螺和健康螺体内,健康螺体内副溶血弧菌数量虽然多于病螺体内的数量,但病螺体内副溶血弧菌以能够溶解兔红细胞的溶血性菌株占多数(9/13),健康螺体内副溶血弧菌的溶血菌株较少(4/26),因此认为,副溶血弧菌(溶血菌株)、哈氏弧菌、河流弧菌、鲍鱼希瓦氏菌和海藻希瓦氏菌可能与东风螺脱壳病与吻肿病有关。哈氏弧菌是存在于两种病螺体内的共同优势菌株,可能在疾病发生发展过程中是主要致病性细菌。
3.2 东风螺脱壳病和吻肿病病因分析
东风螺脱壳病的病因至今尚不清楚,杨章武等[3]通过试验将正在发生脱壳病的东风螺与健康螺养在同一个水池混合饲养,观察17~40 d后,健康螺生长、摄食、存活基本正常,未出现感染脱壳病的症状。王国福等[1]利用抗菌药物对方斑东风螺脱壳病进行治疗试验,结果表明土霉素、新诺明等多种抗生素对脱壳病无明显治疗效果。关于东风螺吻肿病发病原因的报道不多,2009年黄郁葱等[4]从吻肿病方斑东风螺体内分离到一株哈氏弧菌,经肌肉注射和浸浴法人工感染健康东风螺均获得成功,分离菌株对东风螺的LD50值为6.8×105cfu/g,证明哈氏弧菌能引发方斑东风螺吻管水肿病。本试验结果显示,脱壳病和吻肿病东风螺养殖水体中异养菌数量显著高于健康螺养殖水体中细菌的数量,且两种病螺体内致病菌和条件致病菌的种类和数量与健康螺体内的存在较大差异,表明东风螺脱壳病和吻肿病的发生、发展与水体环境中异养菌的数量及体内条件致病菌的感染程度具有密切关系,其原因:一方面,由于水体环境异养菌数量的增加,水体环境正常微生物区系平衡破坏,致使致病菌和条件致病菌大量繁殖,而引起东风螺发病或加重病情发展;另一方面,由于气候改变、饲料转换等其他原因诱发东风螺发病,导致病螺代谢产物在水体积累引起环境中异养菌数量增加,体内条件致病菌的大量繁殖,加重病情发展,引起发病率和死亡率的增高。在本试验中,哈氏弧菌作为脱壳病和吻肿病病螺体内共同的优势菌株,可能与脱壳病和吻肿病发生有关。
溶血素被认为是致病性弧菌中分布最广泛的毒素之一[5-8],本试验利用兔血琼脂平板从试验螺体内分离致病性细菌,两种病螺体内分离到的副溶血弧菌多数菌株、河流弧菌、创伤弧菌、希瓦氏菌均具有较强的溶血活性。但是,从脱壳病和吻肿病病螺分离到的哈氏弧菌多数菌株在兔血琼脂平板上却没有溶血活性,仅有少数菌株在兔血琼脂平板上形成狭窄的β溶血环。哈氏弧菌含有热不稳定性溶血素TLH,不含热稳定性溶血素TDH[5],其溶血素的主要致病作用机理为破坏红细胞,释放出血红素以及结合铁成分,铁浓度高时能催化形成致死性的羟自由基,对细胞具有很强毒害作用[9]。Zhang 等[6-7]研究发现致病性哈氏弧菌VIB645 胞外产物对大西洋鲑和虹鳟的红细胞具有高滴度(1:32)的溶血活性,而且胞外产物对兔红细胞的溶血活性比对绵羊、马及驴的红细胞的溶血作用更强,并认为该哈氏弧菌胞外产物的溶血活性在鲑科鱼类的发病中起重要作用。但是,王斌等[10-11]研究证明,哈氏弧菌分泌的胞外酶含量和活性高低与细菌培养温度关系不大,而与培养时间有一定关系,哈氏弧菌在35 ℃培养36 h时分泌的胞外酶含量和活性最高。因此,本试验分离所得哈氏弧菌致病因子及其致病机理有待进一步深入研究。
海藻希瓦氏菌和鲍鱼希瓦氏菌是脱壳病-吻肿病共患泥东风螺的主要优势菌,在脱壳病病螺体内也分离到海藻希瓦氏菌,但不是优势菌株,海藻希瓦氏菌是否与吻肿病发生有关还有待深入研究。海藻希瓦氏菌能够分泌河豚毒素[12],是能够感染人的一种条件有致病性细菌[13]。鲍鱼希瓦氏菌的生物学特性及其致病性目前尚未见报道。
东风螺脱壳病和吻肿病的病因与发病机制虽然至今不明,但本试验通过分析病螺体内致病菌及条件致病菌的菌相,证明环境中及体内致病菌及条件致病菌对脱壳病和吻肿病的发生、发展具有一定影响。因此,在脱壳病与吻肿病防治过程中,应重视和加强养殖环境中异养菌数量及条件致病菌的检测与控制。本试验分离到致病菌及条件致病菌对东风螺脱壳病和吻肿病的致病作用及机理,有待后续动物感染试验及相关试验进一步深入研究。
参考文献(References):
[1] WANG G F, ZHANG R Z, ZENG L M, et al. The method of prevention and treatmeat of shell-flesh seperating disease ofBabyloniaareolate[J]. Hebei Fishery,2008,176:37-40. 王国福,张瑞姿,曾令明,等. 方斑东风螺肉壳分离病的防治方法[J]. 河北渔业,2008,176:37-40.
[2] FANG H, CHEN C Z, ZHANG X J. Aquacultural animal pathogenic bacteriology [M].Beijing: China Agriculture Press, 2010:313-350. 房海,陈翠珍,张晓君.水产养殖动物病原细菌学[M].北京:中国农业出版社, 2010:313-350.
[3] YANG Z W, ZHANG Y B. The contacting infected testing of the shelling disease of Babylonia[J]. Journal of Aquaculture, 2010,3l(9):1-3. 杨章武,张扬波.东风螺脱壳病活体接触感染试验[J]. 水产养殖,2010,3l(9):1-3.
[4] HUANG Y C, JIAN J C, WU Z H, et al. Preliminary study on the pathogenic bacteria isolated from proboscis edema-diseasedBabyloniaareolata[J]. Fishery modernization , 2009,36(4):37-41. 黄郁葱,简纪常,吴灶和,等.方斑东风螺吻管水肿病病原菌的初步研究[J]. 渔业现代化,2009,36(4):37-41.
[5] WANG S X, ZHANG X H, SUN B G,et al. Distribution of five kinds of haemolysin genes in different vibrios and their correlation with activities of haemolytic and phospholipase [J].Journal of Fishery Sciences of China,2007,14(4):570-577. 王淑娴,张晓华,孙铂光,等.不同海洋弧菌中5类溶血素基因的分布及其与溶血活性和磷脂酶活性的相关[J]. 中国水产科学,2007,14(4):570-577.
[6] ZHONG Y B,ZHANG X H,CHEN J X,et al. Overexpression,purification,characterization and pathogenicity ofVibrioharveyihemolysin VHH [J].Infection and Immunity,2006,74(10):6001-6005.
[7] ZHANG X H,MEADEN P G,AUSTIN B D. Duplication of hemolysin genes in a virulent isolate ofVibrioharveyi[J]. Applied Environment Microbiology,2001,67(7):3161-3167.
[8] ZHANG X H,AUSTIN B. Haemolysins inVibriospecies[J]. Applied Microbiology,2005,98:1009-1011.
[9] ZHONG Y B, ZHANG X H, CHEN J X, et al. Expression ofVibrioharveyihemolysin gene vhhA inE.coliand its biological activities [J].Periodical of Ocean University of China, 2007, 37(1):97-102. 钟英斌,张晓华,陈吉祥,等. 哈氏弧菌溶血素基因vhhA 在大肠杆菌中的表达及活性研究[J]. 中国海洋大学学报,2007,37(1):97-102.
[10] WANG B, YU L P, HU L, et al. Isolation and identification of bacteriosis pathogen from culturedFuguobscuruswith canker of skin [J]. Journal of Fishery Sciences of China, 2008,15(2):352-358. 王斌,于兰萍,胡亮,等. 红鳍东方鲀皮肤溃烂病病原菌的分离与鉴定[J]. 中国水产科学,2008,15(2):352-358.
[11] WANG B, YU L P, YUAN T, et al. Pathogenicity of extracellular products ofVibrioharveyito Fugu obscurus[J]. Journal of Fishery Sciences of China, 2010,17(1):188-96. 王斌,于兰萍,袁甜,等.哈氏弧菌胞外产物对红鳍东方鲀的致病性[J]. 中国水产科学,2010,17(1):188-96.
[12] YUE T F. Purification and determination ofShewanellaalgafermentated producing tetrodotoxin [D]. Qing dao: Ocean University of China,2008:1-4.岳田芳.海藻希瓦氏菌发酵产生河豚毒素的提取与检测[D]. 青岛:中国海洋大学,2008:1-4.
[13] YANG J C, GUO H, XU J J, et al. Studay on biological characteristics ofShewanella[J].Chinese Journal of Zoonoses, 2009,25(7):699-700. 杨晋川,郭惠,许静静,等. 希瓦菌生物学特性的实验研究[J]. 中国人兽共患病学报,2009,25(7):699-700.

