穿琥宁抗炎作用的血红素加氧酶-1的信号转导机制
张 波,龙 隆,王莉莉,刘克良,宫泽辉
(军事医学科学院毒物药物研究所1.新药评定研究室,2.药物化学研究室,北京 100850)
穿琥宁系穿心莲提取物穿心莲内酯经结构改造后所得化合物,是以穿心莲内酯为母核在其侧链的羟基位点进行了酯化、脱水、成盐而成。穿琥宁具有消炎退肿、解热镇痛、抗菌和抗病毒的作用,在临床上常用于治疗外感高热和急性感染性疾病等[1-2]。以往研究主要集中在探讨原型药物穿心莲内酯的抗炎作用机制,提示其抗炎机制主要与阻断NF-κB寡核苷酸与核酸蛋白的链接,进而降低诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧化酶 2(cyclooxygenase 2,COX-2)表达有关[3]。以往研究认为,穿心莲内酯通过抑制NF-κB活性,降低炎性蛋白iNOS和COX-2的表达及NO和PGE2的产生是穿心莲抗炎机制之一[4]。NF-κB是与炎症反应相关的基因表达调节分子[5-6],在单核巨噬细胞膜上能激动NF-κB通路的受体主要有白细胞介素1β(interleukin-1β,IL-1β),肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)和脂多糖(lipopolysaccharide,LPS),抑制其中任何一种受体都可以抑制NF-κB的活性。目前尚无研究表明穿心莲内酯是通过膜受体产生效应,还是直接进入细胞内起作用,有关穿琥宁的研究更少。本研究采用高灵敏度的IN Cell Analyzer 2000活细胞成像系统,在特异性表达IL-1β或TNF受体的组成性表达增强绿色荧光蛋白偶联 NK-κBP65(enhanced green fluorescent protein-NF-κBP65)融合蛋白的CHO细胞模型上,评价穿琥宁对IL-1β和 TNF-α诱导的NF-κBP65核转位的抑制作用;在特异性表达LPS受体的组成性表达EGFP偶联促分裂原活化蛋白激酶 APk2(EGFP-mitogen activated protein kinase APk2,EGFP-MAPK-APk2)融合蛋白的BHK细胞模型上,评价穿琥宁对 LPS诱导的P38MAPK下游分子 MAPK-APk2核转位的抑制活性。
1 材料与方法
1.1 药品、试剂和仪器
穿琥宁(粉末),成都一平科技发展公司。组成性表达EGFP-NF-κBP65融合蛋白的CHO细胞购自美国Thermo公司;组成性表达 EGFP-MAPKAPk2融合蛋白的BHK细胞购自美国GE公司;RAW264.7细胞(单核巨噬细胞)购自协和细胞资源库;小鼠抗血红素加氧酶-1(heme oxygenase-1,HO-1)抗体、兔抗iNOS抗体和兔抗COX-2抗体均购自香港Abcam公司;小鼠抗β肌动蛋白抗体购自Santa Cruz公司;辣根过氧化物酶标记山羊抗兔IgG和辣根过氧化物酶标记山羊抗鼠IgG抗体(二抗)均购自北京中杉金桥公司;杀稻瘟素(blasticidin)购自上海希美生物公司;IL-1β和TNF-α购自美国 PEPROTECH公司,kBα抑制剂(kBα inhibitor,IκBα)特异性抑制剂 Ro106-9920购自美国Merck公司;LPS和锌原卟啉(zinc protoporphyrian,ZnPP)(HO-1 活性抑制剂)购自美国Sigma公司;WST-8细胞计数试剂盒购自北京钮因华信科技发展有限公司;一氧化氮(nitric oxide,NO)检测试剂盒购自南京建成生物有限公司;前列腺素E2(prostaglandine E2,PGE2)ELISA试剂盒购自泰泽瑞达(北京)科技有限公司;胎牛血清、G418、F12培养液和 DMEM培养液购自美国Gibco公司;染色液购自美国Invitrogen公司。IN Cell Analyzer 2000活细胞成像系统,美国GE公司;GENios pro酶标仪,瑞士TECAN公司;垂直电泳槽,美国 Bio-Rad公司;DYY-8C 型电泳仪,北京六一仪器厂;Thermo Froma 311型水套式CO2培养箱,美国Thermo公司;凝胶成像仪,美国Kodak公司。
1.2 激动剂和化合物的配制
激动剂IL-1β用含0.1%胎牛血清的PBS配成10 mg·L-1母液,用分析培养液配成20 μg·L-1(4 ×,终浓度 5 μg·L-1)工作液;IκBα 抑制剂 Ro106-9920 用 DMSO 配成 25 mmol·L-1母液,分析培养液配成200 μmo·lL-1(4×,终浓度50 μmol·L-1);激动剂 TNF-α用含0.1%胎牛血清的 PBS配成100 mg·L-1母液,用分析培养液配成 40 μg·L-1(4 ×,终浓度10 μg·L-1);激动剂LPS 用PBS 配成1 g·L-1母液,用分析培养液配制成4 mg·L-1(4 ×,终浓度1 mg·L-1)工作液;穿琥宁用1%NaHCO2水溶液配成40 mmo·lL-1母液,用分析培养液配成4×工作液,选用3,10,30 和100 μmol·L-1连续4 个浓度。工作液临用前配制,20 min内使用。
1.3 细胞培养
组成性表达 EGFP-NF-κBP65 融合蛋白的CHO 细胞培养于含 G4180.5 g·L-1、杀稻瘟素5 mg·L-1和10% 胎牛血清的F12培养液中;组成性表达EGFP-MAPK-APk2融合蛋白 BHK 细胞,培养于含G4180.5 g·L-1和10%胎牛血清的F12培养液中;RAW264.7细胞,培养于含10%胎牛血清的DMEM培养液中。上述细胞培养条件均为37℃,5%CO2培养。
1.4 细胞存活率测定
按照WST-8细胞计数试剂盒说明书测定细胞存活率。RAW264.7细胞悬液(1×108L-1)按每孔100 μl加入96孔板中(边缘孔用无菌水填充),培养过夜。每孔加入含穿琥宁终浓度分别为3,10,30和100 μmol·L-1的培养液10 μl,细胞对照和空白对照(不加细胞)组加等体积培养液,每组设7复孔,在培养箱培养24 h后每孔加入WST-8试剂10 μl,在培养箱孵育2 h后,用酶标仪测定450 nm波长的吸光度(A)值。细胞存活率(%)=(A药物-A空白对照)/(A细胞对照-A空白对照)× 100%
1.5 抑制IL-1β 和TNF-α 诱导NF-κBP65 核转位分析
将组成性表达 EGFP-NF-κBP65融合蛋白的CHO 细胞按每孔100 μl(含1.5×104细胞)接种于预铺细胞黏附剂的96孔黑色孔底透光的细胞培养板中,在37℃,5%CO2培养18~24 h。每孔细胞用100 μl分析培养液洗 3 次,换 100 μl分析培养液,分细胞对照组、IL-1β 5 μg·L-1激动剂组、Ro106-9920(阳 性 对 照)50 μmol·L-1+IL-1β 5 μg·L-1组及穿琥宁 3,10,30 和 100 μmol·L-1+IL-1β 5 μg·L-1组,每组设3 复孔。阳性对照和穿琥宁组CHO细胞先与 Ro106-9920或穿琥宁作用60 min,再加入 IL-1β 作用 40 min,测定穿琥宁对IL-1β诱导的NF-κBP65核转位的影响。CHO 细胞分细胞对照组、TNF-α 10 μg·L-1激动剂组及穿琥宁 3,10,30 和 100 μmol·L-1+TNF-α 10 μg·L-1组,每组设3复孔。穿琥宁组CHO细胞先与穿琥宁作用60 min,再加入 TNF-α作用60 min,测定穿琥宁对 TNF-α诱导的 NF-κBP65核转位的影响。每孔细胞用染色液 200 μl洗 3 次,并留在200 μl染色液中室温染色1 h。细胞在 IN Cell Analyzer 2000活细胞成像系统上检测细胞质和细胞核荧光强度,每孔5个视野连续拍照。使用GE公司IN Cell Analyzer 1000 Nuclear Trafficking Analysis Module软件分析细胞核与细胞质荧光强度比值,表示报告基因核转位,并计算穿琥宁抑制核转位的活性。穿琥宁抑制率(%)=(激动剂处理细胞核转位-穿琥宁处理细胞核转位)/(激动剂处理细胞核转位-对照组细胞核转位)×100%。
1.6 抑制LPS诱导MAPK-APk2核转位分析
将组成性表达EGFP-MAPK-APk2融合蛋白的BHK 细胞按每孔100 μl(含1.5 ×104个细胞)接种于预铺细胞黏附剂的96孔黑色孔底透光的细胞培养板中,37℃,5%CO2培养18~24 h。每孔细胞用100 μl分析培养液洗3 次,换100 μl分析培养液,分细胞对照组、LPS 1 mg·L-1激动剂组和穿琥宁 3,10,30 和 100 μmol·L-1+LPS 1 mg·L-1组,每组设3复孔。穿琥宁组BHK细胞先与穿琥宁作用60 min,再加入LPS作用30 min,测定穿琥宁对LPS诱导的MAPK-APk2核转位的影响。每孔细胞用染色液200 μl洗 3 次,并留在200 μl染色液中室温染色1 h。同1.5测定并计算穿琥宁抑制核转位的活性。穿琥宁抑制率(%)=(穿琥宁处理细胞核转位-激动剂处理细胞核转位)/(对照组细胞核转位-激动剂处理细胞核转位)×100%。
1.7 Western 印迹法测定 HO-1,iNOS 和 COX-2蛋白表达
RAW264.7细胞培养于60 mm细胞培养皿中,用含穿琥宁终浓度分别为3,10,30 和100 μmol·L-1培养液培养4 h后,弃培养液,用冷PBS清洗3次,加入细胞裂解液,裂解细胞提取细胞全蛋白,考马斯亮蓝法测蛋白质浓度,所提取的蛋白质用于检测HO-1的表达。同样将 RAW264.7细胞培养于60 mm细胞培养皿中,分细胞对照组、IL-1β 5 μg·L-1组、IL-1β 5 μg·L-1+ 穿琥宁 100 μmol·L-1组和 IL-1β 5 μg·L-1+ 穿琥宁 100 μmol·L-1+ZnPP 5 μg·L-1组,分别处理细胞 6 h,提取总蛋白质用于检测COX-2蛋白表达;分别处理12 h,提取总蛋白质用于检测iNOS蛋白表达。取蛋白质40 μg上样,10%聚丙烯酰胺凝胶垂直电泳,随后电转移至硝酸纤维素膜,分别用抗 HO-1抗体(1∶2000),COX-2 抗体 (1 ∶1000),iNOS 抗 体(1∶1000)或β肌动蛋白抗体(1∶5000)一抗孵育过夜,洗膜,加入二抗孵育1 h,洗膜,发光液孵育,凝胶成像系统通过Quantity one软件分析各条带的积分吸光度(integrated absorbance,IA)。目的蛋白的相对表达水平用 IA目的蛋白/IAβ肌动蛋白比值表示。
1.8 细胞培养液中PGE2和NO含量测定
RAW264.7细胞培养于60 mm细胞培养皿中,分细胞对照组、IL-1β 5 μg·L-1组、IL-1β 5 μg·L-1+穿琥宁 100 μmol·L-1组,IL-1β 5 μg·L-1+ 穿琥宁100 μmol·L-1+ZnPP 5 μg·L-1组,分别处理细胞6 h,取培养液,按试剂盒说明书测定PGE2含量;分别处理12 h,取培养液,按试剂盒说明书测定NO含量。
1.9 统计学分析
2 结果
2.1 穿琥宁的细胞毒性作用
穿琥 宁 3,10,30 和 100 μmol·L-1处 理RAW264.7细胞24 h,与细胞对照组比较,A450nm均未发生明显变化,细胞存活率均在100%以上,表明穿琥宁小于100 μmol·L-1无明显细胞毒性(表1)。
Tab.1 Effect of Chuanhuning on viability of RAW264.7 cells
2.2 穿琥宁对IL-1β 诱导NF-κBP65核转位的影响
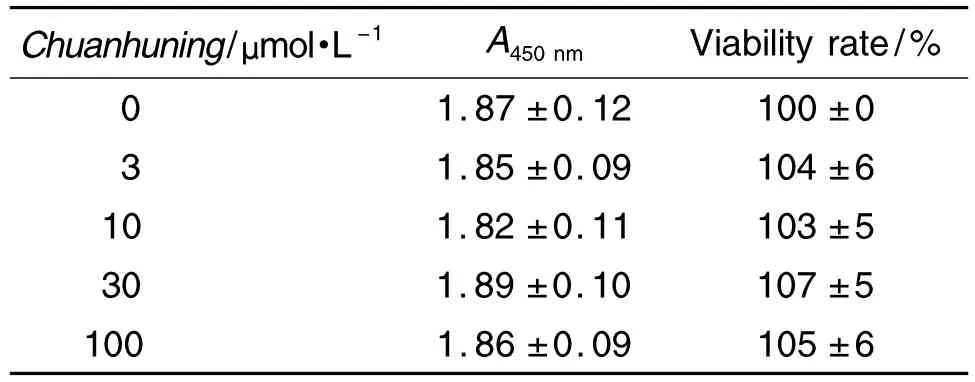
IL-1β 受体激动剂 IL-1β 能诱导 NF-κBP65 荧光蛋白从胞浆向核内转位,IκBα特异性抑制剂Ro106-9920能完全阻断其核转位效应,其抑制率为100%(图 1)。经计算,穿琥宁 3,10,30 和100 μmol·L-1对 IL-1β 诱导 NF-κBP65 核转位无抑制作用,抑制 率 分 别 为 (9.3±7.8)%,(7.1±8.3)%,(4.7±8.3)%和(-4.5±8.6)%(n=3),提示穿琥宁的抗炎镇痛作用可能不是IL-1β受体所介导的。
2.3 穿琥宁对TNF-α诱导NF-κBP65核转位的影响
TNF-α 受体激动剂 TNF-α 能诱导 NF-κBP65荧光蛋白从胞浆向核内转位(图2)。穿琥宁3,10,30 和 100 μmol·L-1对 TNF-α 诱导 NF-κBP65核转位有较弱的抑制作用,经计算其抑制率分别为(19.9±7.2)%,(18.1±8.5)%,(15.9±7.6)%和(16.2±8.8)%(n=3),提示穿琥宁的主要抗炎镇痛作用可能不是由TNF-α受体介导的。
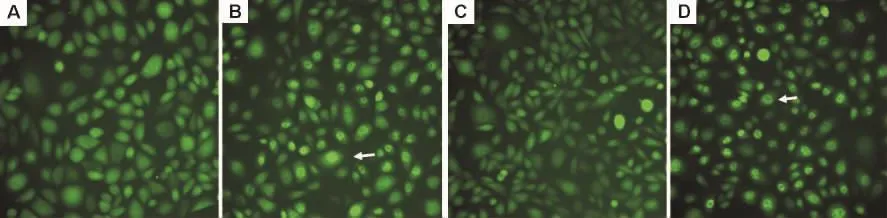
Fig.1 Effect of Chuanhuning on nuclear transfer of NF-κBP65 induced by interlukin-1β(IL-1β)in CHO cells with enhanced green fluorescent protein(EGFP)-NF-κBP65(×20).The green fluorescence was detected by IN Cell Analyzer 2000 live cell imaging system.A:control group,CHO cells were incubated in medium for 100 min,GFP was distributed in cytoplasm;B:IL-1β 5 μg·L -1group,CHO cells were incubated in medium for 60 min,then with IL-1β for 40 min,NF-κBP65 with GFP was transferred to the nucleus as shown by arrow;C:Ro106-992050 μmol·L-1+IL-1β 5 μg·L-1group,CHO cells were incubated with Ro106-9920 for 60 min,then coincubated with IL-1β for 40 min,nuclear transfer effect of GFP was blocked;D:Chuanhuning 100 μmol·L-1+IL-1β 5 μg·L-1group,CHO cells were incubated with Chuanhuning for 60 min,then coincubated with IL-1β for 40 min,nuclear transfer effect of NF-κBP65 could not be inhibited and GFP could still be observed in the nucleus as shown by arrow.
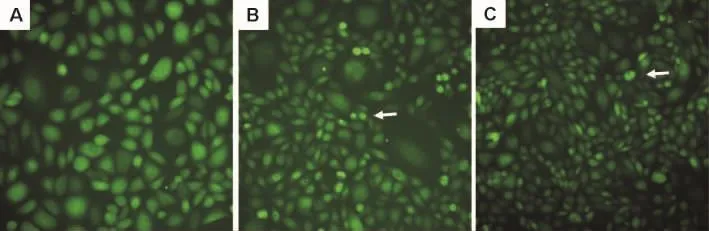
Fig.2 Effect of Chuanhuning on nuclear transfer of NF-κBP65 induced by tumor necrosis factor-α (TNF-α)in CHO cells with EGFP-NF-κBP65(×20).The green fluorescence was detected by IN Cell Analyzer 2000 live cell imaging system.A:control group,CHO cells were incubated in medium for 120 min,GFP was distributed in the cytoplasm and almost invisible in nucleus;B:TNF-α 10 μg·L-1group,CHO cells were incubated in medium for 60 min,then with TNF-α for 60 min,NF-κBP65 with GFP was transferred to the nucleus as shown by arrow;C:Chuanhuning 100 μmol·L -1+TNF-α 10 μg·L -1group,CHO cells were incubated with Chuanhuning for 60 min,then coincubated with TNF-α for 60 min,nuclear transfer effect of NF-κBP65 could not be inhibited and GFP could still be observed in the nucleus as shown by arrow.
2.4 穿琥宁对LPS诱导MAPK-APk2核转位的影响
LPS受体激动剂LPS能诱导MAPK-APk2荧光蛋白从细胞核向细胞浆转位(图3)。穿琥宁3,10,30 和 100 μmol·L-1对 LPS 诱导 MAPK-APk2核转位无抑制作用,经计算其抑制率分别为(-6.1±4.8)%,(-5.7±4.7)%,(- 5.0±4.8)% 和(-4.8±5.8)%(n=3),提示穿琥宁的抗炎镇痛作用可能不是由LPS受体介导的。
Fig.3 Effect of Chuanhuning on nuclear transfer of mitogen activated protein kinase APk2(MAPK-APk2)induced by lipopolysaccharides(LPS)in BHK cells with EGFP-MAPK-APk2(×20).The green fluorescence was detected by IN Cell Analyzer 2000 live cell imaging system.A:control group,BHK cells were incubated in medium for 90 min,GFP gathered in the nucleus without agonist;B:LPS 1 mg·L -1group,BHK cells were incubated in medium for 60 min,then with LPS for 30 min,MAPK-APk2 with GFP was transferred to the cytoplasm under stimulating with LPS as shown by arrow;C:Chuanhuning 100 μmol·L -1+LPS 1 mg·L -1group,CHO cells were incubated with Chuanuning for 60 min,then coincubated with LPS for 30 min,nuclear transfer effect of MAPK-APk2 could not be inhibited as shown by arrow.
2.5 穿琥宁对RAW264.7细胞HO-1蛋白表达的影响
如图4 所示,穿琥宁10,30 和100 μmol·L-1分别处理RAW264.7细胞4 h,能够诱导HO-1蛋白的表达(P<0.01);穿琥宁3 μmol·L-1作用不明显。
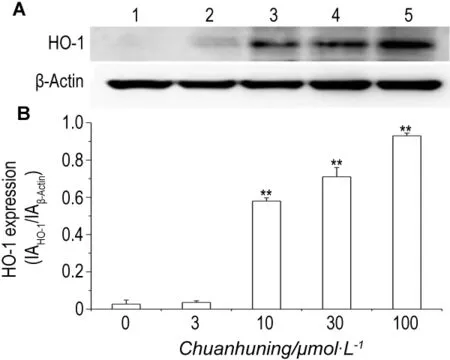
Fig.4 Effect of Chuanhuning on heme oxygenase-1(HO-1)expression in RAW264.7 cells.RAW264.7 cells were incubated with Chuanhuning for 4 h.The expression of HO-1 was determined with Western blotting(A)and expressed as IAHO-1/IAβ-Actin(B).IA:integrated absorbance.Lane 1:cell control;lane 2-5:Chuanhuning 3,10,30 and 100 μmol·L -1,respectively.±s,n=3.**P<0.01,compared with cell control group.
2.6 穿琥宁对 RAW264.7细胞 COX-2表达和PGE2产生的影响

Fig.5 Effect of Chuanhuning on cyclooxygenase 2(COX-2)expression stimulated by IL-1β in RAW264.7 cells.RAW264.7 cells were incubated with IL-1β,Chuanhuning+IL-1β or Chuanhuning+IL-1β +zinc protoporphyria(ZnPP)for 6 h,respectively.The expression of COX-2 was determined with Western blotting(A)and expressed as IACOX-2/IAβ-Actin(B).1:cell control;2:IL-1β 5 μg·L -1;3:Chuanhuning 100 μmol·L -1+IL-1β 5 μg·L -1;4:Chuanhuning 100 μmol·L -1+IL-1β 5 μg·L -1+ZnPP 5 μmol·L -1 .±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with IL-1β 5 μg·L -1group;△△P<0.01,compared with Chuanhuning+IL-1β group.
如图5 所示,在 IL-1β 刺激下,RAW264.7 细胞COX-2表达明显增高(P<0.01),穿琥宁能明显抑制IL-1β的刺激作用(P<0.01),HO-1特异性拮抗剂ZnPP能部分逆转穿琥宁对IL-1β诱导COX-2表达的抑制作用(P<0.01)。同样,如图6所示,穿琥宁抑制 IL-1β 诱导 PGE2的产生(P<0.01),ZnPP也部分逆转穿琥宁对IL-1β诱导产生的抑制作用(P<0.05)。
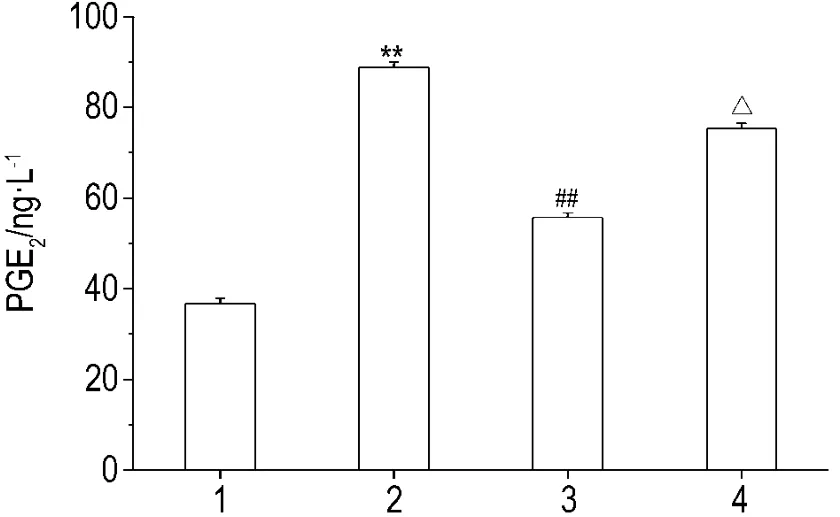
Fig.6 Effect of Chuanhuning on production of prostaglanddins E2(PGE2)stimulated by IL-1β in RAW264.7 cells.RAW264.7 cells were incubated with IL-1β,Chuanhuning+IL-1β or Chuanhuning+IL-1β +ZnPP,respectively,for 6 h.The PGE2concentration was determined with PGE2kit.1:cell control;2:IL-1β 5 μg·L -1;3:Chuanhuning 100 μmol·L -1+IL-1β 5 μg·L -1;4:Chuanhuning 100 μmol·L -1+IL-1β 5 μg·L -1+ZnPP 5 μmo·lL-1.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with IL-1β group;△P<0.05,compared with Chuanhuning+IL-1β group.
2.7 穿琥宁对RAW264.7细胞iNOS表达和NO产生的作用
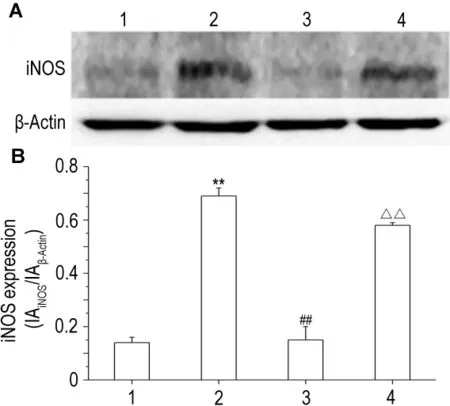
Fig.7 Effect of Chuanhuning on inducible nitric oxide synthase(iNOS)expression stimulated by IL-1β in RAW264.7 cells.RAW264.7 cells were incubated with IL-1β,Chuanhuning+IL-1β or Chuanhuning+IL-1β +ZnPP,respectively,for 12 h.The expression of iNOS was determined with Western blotting(A)and expressed as IAiNOS/IAβ-Actin(B).1:cell control;2:IL-1β 5 μg·L-1;3:Chuanhuning 100 μmo·lL-1+IL-1β 5 μg·L-1;4:Chuanhuning 100 μmo·lL-1+IL-1β 5 μg·L-1+ZnPP 5 μmol·L-1.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with IL-1β group;△△P<0.01,compared with Chuanhuning+IL-1β group.
如图7 所示,在 IL-1β 刺激下,RAW264.7 细胞iNOS表达明显高于细胞对照组(P<0.01),穿琥宁作用后其表达下降(P<0.01),HO-1特异性拮抗剂ZnPP部分逆转穿琥宁对IL-1β iNOS表达的抑制作用(P<0.01)。同样,如图8所示,穿琥宁抑制IL-1β诱导NO的产生(P<0.01),ZnPP也部分逆转穿琥宁对IL-1β诱导NO产生的抑制作用(P<0.01)。

Fig.8 Effect of Chuanhuning on production of nitric oxide(NO)stimulated by IL-1β in RAW264.7 cells.RAW264.7 cells were incubated with IL-1β,Chuanhuning+IL-1β or Chuanhuning+IL-1β +ZnPP,respectively,for 12 h.The NO concentration was determined with kit.1:cell control;2:IL-1β 5 μg·L -1;3:Chuanhuning 100 μmol·L -1+IL-1β 5 μg·L -1;4:Chuanhuning 100 μmol·L-1+IL-1β 5 μg·L-1+ZnPP 5 μmo·lL-1.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with IL-1β group;△△P<0.01,compared with Chuanhuning+IL-1β group.
3 讨论
本研究结果显示,穿琥宁对CHO细胞IL-1β受体和BHK细胞LPS受体无抑制作用,对CHO细胞TNF-α受体仅具有较弱的抑制活性(抑制强度20%),且无明显的浓度效应关系。但是,在RAW264.7细胞模型上,穿琥宁能显著抑制 IL-1β刺激产生的炎性蛋白iNOS和COX-2的表达及NO和PGE2生成,提示NF-κB通路可能不是穿琥宁抗炎作用的主要机制。
炎症是组织对损伤因子产生的复杂防御反应。刺激单核巨噬细胞释放大量炎症因子的信号通路,除了NF-κB这条经典的抗炎通路外,还存在其他的抗炎通路。目前研究较多的是HO-1,HO-1是血红素代谢的限速酶和起始酶,能将血红素代谢成一氧化碳、胆绿素和游离的铁离子[7],这些代谢产物都是重要的生物效应分子,在抗氧化、抗炎和抗增殖中发挥着重要的作用[8-10]。据报道,穿心莲内酯能够诱导 HO-1 的高表达[11]。本研究在 RAW264.7 细胞模型上,发现穿琥宁也能够诱导HO-1表达增加,抑制由IL-1β刺激产生的iNOS和COX-2高表达及NO和PGE2生成;HO-1特异性拮抗剂ZnPP能显著阻断穿琥宁的作用,部分逆转穿琥宁对炎性物质释放的抑制作用,提示穿琥宁能促进HO-1蛋白表达,其抗炎作用可能主要是通过促进HO-1蛋白表达,继而抑制 iNOS,COX-2,NO 和 PGE2等炎性物质的生成和释放,最终发挥抗炎作用。综上所述,NF-κB信号通路可能不是穿琥宁发挥抗炎作用的主要通路,其抗炎作用可能是通过HO-1信号通路发挥作用。HO-1信号通路与NF-κB信号通路之间相互调节机制尚不清楚。本研究为阐明穿琥宁的抗炎作用机制奠定了基础,也为 HO-1信号系统与NF-κB通路可能存在相互调节的研究提供了实验依据。
[1]Long P,Fang WM,Xiang L.Clinical application of the Chuanhuning injection[J].Acta Chin Med Pharmacol(中医药学报),2001,29:52-54.
[2]Na ZL,Qing SH,Qin Z,Qiong PS.The ADR analysis of Chuanhuning for 45 cases[J].China Pharmacy(中国药房),2004,15:300-301.
[3]Xia YF, Ye BQ, Li YD, Wang JG,He XJ,Lin X,et al.Andrographolide attenuates inflammation by inhibition of NF-kappaB activation through covalent modification of reduced cysteine 62 of p50[J].J Immunol,2004,173(6):4207-4217.
[4]Hidalgo MA,Romero A,Figueroa J,Cortés P,Concha II,Hancke JL,et al.Andrographolide interferes with binding of nuclear factor-kappaB to DNA in HL-60-derived neutrophilic cells[J].Br J Pharmacol,2005,144(5):680-686.
[5]García-Mediavilla V,Crespo I,Collado PS,Esteller A,Sánchez-Campos S,Tuñón MJ,et al.The anti-inflammatory flavones quercetin and kaempferol cause inhibition of inducible nitric oxide synthase,cyclooxygenase-2 and reactive C-protein,and down-regulation of the nuclear factor kappaB pathway in Chang Liver cells[J].Eur J Pharmacol,2007,557(2-3):221-229.
[6]Konson A,Mahajna JA,Danon A,Rimon G,Agbaria R.The involvement of nuclear factor-kappa B in cyclooxygenase-2 overexpression in murine colon cancer cells transduced with herpes simplex virus thymidine kinase gene[J].Cancer Gene Ther,2006,13(12):1093-1104.
[7]Chung HT,Pae HO,Cha YN.Role of heme oxygenase-1 in vascular disease[J].Curr Pharm Des,2008,14(5):422-428.
[8]Kikuchi G, Yoshida T, Noguchi M. Heme oxygenase and heme degradation[J].Biochem Biophys Res Commun,2005,338(1):558-567.
[9]Gueler F, Park JK, Rong S, Kirsch T,Lindschau C,Zheng W,et al.Statins attenuate ischemia-reperfusion injury by inducing heme oxygenase-1 in infiltrating macrophages[J].Am J Pathol,2007,170(4):1192-1199.
[10]Abraham NG,Kappas A.Pharmacological and clinical aspects of heme oxygenase[J].Pharmacol Rev,2008,60(1):79-127.
[11]Yu AL,Lu CY,Wang TS,Tsai CW,Liu KL,Cheng YP,et al.Induction of heme oxygenase 1 and inhibition of tumor necrosis factor alpha-induced intercellular adhesion molecule expression by andrographolide in EA.hy926 cells[J].J Agric Food Chem,2010,58(13):7641-7648.

