不同频率给予地塞米松对大鼠胫骨皮质骨和松质骨的影响
杨国柱,李青南,陈嘉仪,林晓静,陈 珺,卢 丽,
贾欢欢2,黄 韧2,陆幸妍1
(1.广东药学院新药功能研究中心 广东省生物技术候选药物研究重点实验室,广东 广州 510006;2.广东省实验动物监测所 广东省实验动物重点实验室,广东 广州 510633)
临床上有许多患者需要短期、长期甚至终生使用糖皮质激素(gl ucocorticoid,GC),然而GC治疗往往会导致骨量丢失,继而引起骨质疏松[1],骨量丢失程度随着GC治疗剂量和时间的变化而变化,其机制很复杂,至今尚不清楚。探讨GC性骨质疏松(gl ucocorticoid-induced osteopor osis, GIOP)疾病的发生机制的动物模型多为大鼠[2],但由于制备方法很不规范[2-4],如所采取的造模方法、动物类型及观察时间和部位各异,给研究造成许多不便。
目前普遍认为GC引起骨量丢失的程度与其累积剂量和应用时间等有关[5-6]。本小组曾对雌性大鼠间断性肌注地塞米松(dexamet hasone,Dex),每次2.5 mg·kg-1[7-8],每周2次,发现42和90 d时,Dex可造成皮质骨骨量的丢失,但对松质骨没有影响。因此,本研究调整Dex剂量为1 mg·kg-1、频率分别为每周2次、4次和6次,持续30 d,采用骨形态计量学方法[7]观察3月龄SD大鼠胫骨皮质骨和松质骨的改变,以期为GIOP模型标准化及为其预防和未来临床干预提供实验依据。
1 材料与方法
1.1 药品、试剂及主要仪器
Dex磷酸钠注射液(广州白云山天心制药股份有限公司,规格1 ml∶2 mg;批号110303)。戊巴比妥钠AR(中国医药集团上海化学试剂),EDTA(Bioshar p公司产品),多聚甲醛(天津市福盆化学试剂厂),乙醇(天津市百世化工有限公司)。Leica EG1160型包埋机,Leica RM2500型切片机(德国Lecia公司),Oly mpic IX51生物显微镜,骨形态计量学测量系统(美国Osteo Metrics公司)。
1.2 动物与分组
3月龄SPF级雌性SD大鼠32只,体质量(200±20)g,由广州中医药大学实验动物中心提供〔质量合格证编号:SCXK(粤)20100020〕。分笼饲养于室温24~28℃,相对湿度50%~70%的清洁环境中,隔日更换垫料,自由摄食和摄水。适应性喂养1周后,随机分为4组,每组8只:正常对照组仅肌内注射生理盐水,Dex组肌内注射 Dex 1.0 mg·kg-1,按照给药次数,分为2次,4次和6次;每周称体质量1次,并按体质量调整给药剂量,共计给药30 d。
1.3 骨组织切片制作
给药30 d后戊巴比妥钠麻醉大鼠,心脏抽血处死,取右侧胫骨锯出上段(pr oxi mal tibia metaphyses,PTM)和中段(middle part of tibia shaft,TX),经10%EDTA脱钙处理后行石蜡包埋,切4μm薄片,HE染色。
1.4 骨组织形态计量学检测
本实验采用BIOQUANT OSTEO骨组织形态图像分析系统(BIOQUANT Image Anal ysis Corporation)用以测量骨形态计量学参数[7]。骨组织形态计量学参数分为静态参数和动态参数,通过静态参数可以分析骨量和骨的结构,动态参数为反映骨形成和骨吸收的指标。
松质骨静态参数包括反映骨量的骨小梁面积百分数(trabecular area,%Tb.Ar)、反映骨小梁形态结构的骨小梁宽度(trabecular width,Tb.Wi,μm)、骨小梁数量(trabecular nu mber,Tb.N)和骨小梁分离度(trabecular separation,Tb.Sp,μm)。皮质骨静态参数包括反映骨外膜骨形成的骨组织总面积(total tissue area,T.Ar)、反映内外骨面变化的皮质骨总面积(cortical area,Ct.Ar)、反映骨内膜面骨吸收与骨形成情况的骨髓腔面积(marr ow area,Ma.Ar)、皮质骨厚度 (cortical bone thickness,Ct.Th)、骨外膜面周长(periosteal peri meter,P-Pm)和骨内膜面周长(endocortical peri meter,EPm)。
1.5 统计学处理
2 结果
2.1 不同频率给予地塞米松对大鼠骨组织的影响
胫骨上段松质骨HE染色结果显示,正常对照组骨小梁排列密集,小梁宽、间距小,骨小梁之间的连接较多(图1 A1);每周2次组与正常对照组相比无明显变化(图1 A2),4次组和6次组骨小梁宽度变窄,其他指标无明显肉眼可见的变化(图1 A3,图1A4)。
胫骨中段皮质骨的HE染色结果显示,正常对照组的皮质骨切片呈现淡红色、中空环状结构(图1B1);每周2次和4次组未见明显差异(图1B2,1B3);6次组 Ct.Th和 Ct.Ar相对减少(图1B4)。

Fig.1 Effect of dexamethasone(Dex)at different frequency on proxi mal tibia metaphyses(A)and middle part of tibia shafts(B)of rats(HE×2).Dex 1 mg·kg-1 was given,i m,for t wice,four and six ti mes a week,respectively,and lasting 30 d.1:nor mal contr ol gr oup;2:t wice a week gr oup;3:f our ti mes a week group;4:six ti mes a week group.Arrows show the trabeculae.
2.2 不同频率给予地塞米松对大鼠胫骨上段松质骨形态计量参数的影响
如表1所示,每周2次 Dex,%Tb.Ar和Tb.Wi有所下降,但与正常对照相比差异无统计学意义;而4次和6次组胫骨上段,%Tb.Ar和Tb.Wi明显减少(P<0.05),说明Dex给药30 d后,4次和6次组大鼠松骨量出现了骨量和骨结构的破坏,而2次组没有改变。上述3组给予Dex 1 mg·kg-1,对Tb.N和Tb.Sp无显著影响,说明短时间30 d Dex主要表现为影响松质骨骨小梁的宽度。
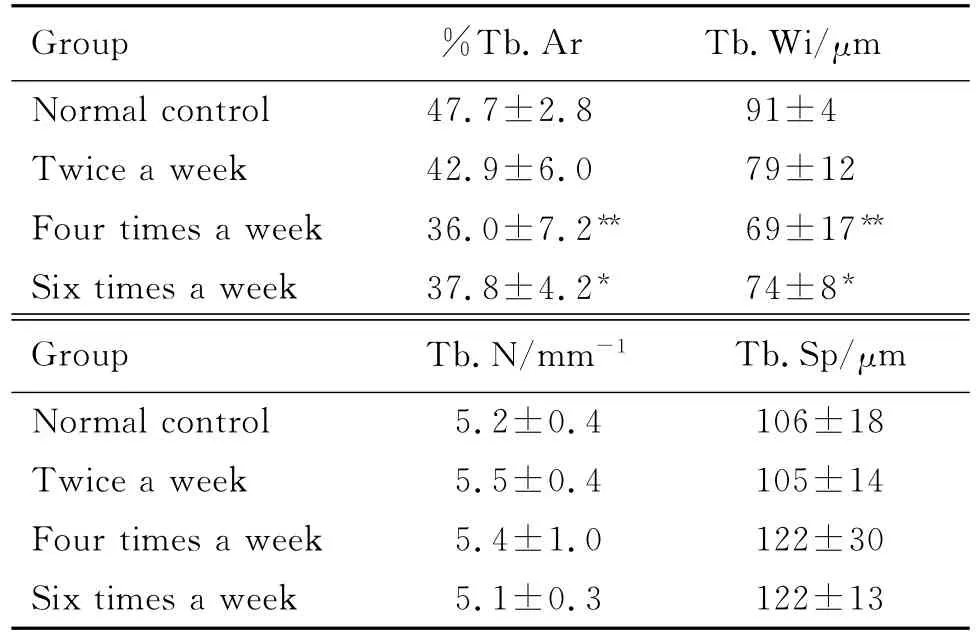
Tab.1 Effect of Dex 1 mg·kg-1 on histomor phometric parameters of the pr oxi mal tibia metaphyses of rats
2.3 不同频率给予地塞米松对大鼠胫骨中段皮质骨形态计量参数的影响
如表2所示,与正常对照组相比,每周2次、4次和6次组T.Ar和P-Pm均显著降低(P<0.05),但对Ma.Ar和E-Pm无影响。6次组还可显著降低Ct.Th和%Ct.Ar(P<0.05),而其他两组对此无影响。说明短时间内皮质骨对GC较为敏感,2次组已出现骨量的减少。而4次组Ct.Th与正常对照组比较无显著差异,而2次和6次组的Ct.Th均减少,这可能与Dex的用药频率有关。
3 讨论
本实验结果显示,30 d不同频率GC给药后,每周2次组大鼠松质骨各项指标无明显变化;4次和6次组大鼠的%Tb.Ar,Tb.Wi明显减少,但Tb.N,Tb.Sp未见变化,说明4次和6次组大鼠松质骨的骨微细结构已经发生退化,骨量和骨结构均出现了改变。提示在模型制作过程中,可以考虑在保持原有剂量的基础上,加大GC给药的频率,这样可以缩短模型制作时间,节约制作成本,从而降低动物的损耗。鉴于大鼠骨骼的长度、质量和骨密度在1~3月龄呈急速生长,3个月后骨生长速率变得平缓,直到6月龄后骨骼可保持很长一段时间稳定[9],推测每周2次组的松质骨造模结果不理想,可能是大鼠处于骨平缓的生长塑造期,为保持骨密度和生物学作用,骨量发生了从皮质骨向松质骨的转移[8-9],观察时间短和用药频率较低进一步掩盖了松质骨应有的改变。
不同频率给予Dex对大鼠皮质骨作用也不尽相同。上述组T.Ar均明显减少;尤以6次组表现明显,T.Ar,Ct.Th,Ct.Ar均明显减少。在每周2次组皮质骨已经出现骨量减少,随频率的增加骨丢失越发明显,说明在调整频率和剂量、时间后,短时间内即可观察到GC对皮质骨的影响。目前研究一致认为,GC通过破骨细胞介导的骨吸收及抑制成骨细胞介导的骨形成引起骨质疏松,其中GC对皮质骨的影响主要是使骨内外膜的骨形成减少,同时骨内膜面的骨吸收增加,从而出现皮质骨变薄,骨髓腔增大的情况[10]。本实验给Dex 3个频率组骨外膜周长均减少,骨内膜周长与正常对照组无差异,骨外膜周长与内膜周长变化不一致,可能是由于成骨细胞在骨外膜面分布比骨内膜面的多,成骨细胞作为最主要的骨形成细胞,也是GC作用于骨骼的主要靶点,对GC有着高敏感性;GC不仅降低成骨细胞的分化和成骨能力,而且还促进了成骨细胞和骨细胞的凋亡[8,11-12]。因本实验观察时间较以往稍短,更加凸显了成骨细胞较破骨细胞对Dex应激的敏感和迅速,骨外膜的骨形成明显受抑制,尤其每周2次组表现更为明显,这也与Tsa mpalier os等[13]和Yang等[14]的观点一致,可能与GC作用后,导致皮质骨应激性地缩小,骨骼纵向生长变缓,从而维持骨密度不变或者增加,进而维持骨骼原有的生物力学功能有关。
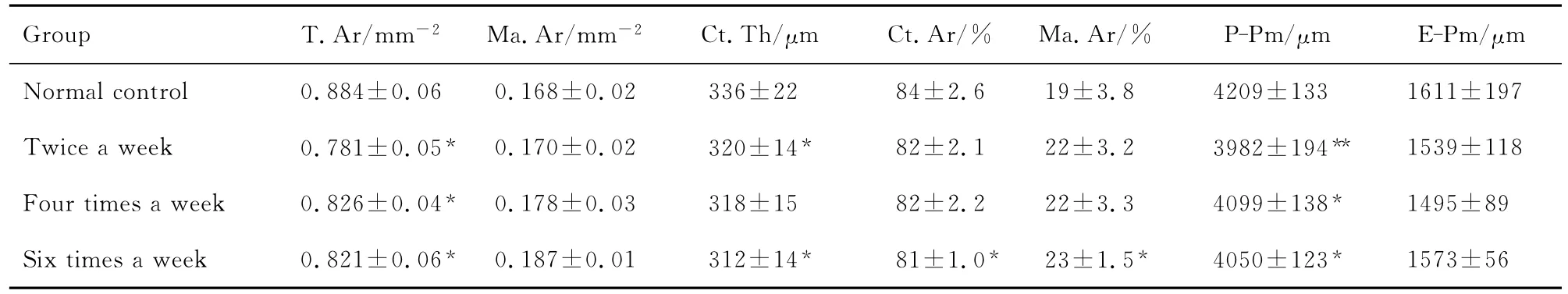
Tab.2 Effect of Dex 1 mg·kg-1 on histomor phometric parameters of middle part of tibia shaft cortical bone of rats
值得注意的是,每周4次组Ct.Th与正常对照组比较没差异,而2次和6次组Ct.Th均减少,这可能与Dex的用药频率有关[6]。一方面,4次组可能降低了大鼠成骨细胞对Dex的敏感性,从而减弱了Dex引起的骨量丢失,皮质骨的骨形成和骨吸收达到一个稳态,皮质骨厚度得以维持。另一方面,也可能与GC对成骨的双向作用有关[14]。2次组皮质骨的骨形成减慢,得以维持松质骨骨结构和骨量没有损失,而6次组,则皮质骨和松质骨的骨形成均减缓,即使GC引起骨从皮质骨到松质骨转移,仍不足以维持松质骨的骨结构和骨量,同时皮质骨的骨量大大减少,GC对破骨细胞的作用得以凸显。因此,2次和6次组分别凸显了外膜骨形成的抑制和内膜骨吸收的促进两个作用。
综上所述,经调整Dex的剂量、频率和时间后,30 d给药即可观察到大鼠胫骨的松质骨和皮质骨出现相应骨量减少的改变,随着频率的增加,不同频率组的松质骨和皮质骨的表现各异。本研究也是首次报道频率对GIOP建模的影响,以及皮质骨和松质骨同时对GC产生的不同应激反应,提示建立GIOP模型时,应充分考虑不同类型骨骼的变化情况,合理设计用药剂量和频率,也为临床上GIOP的预防和干预、GC的用药方式提供一定的实验基础。
[1]Prani'c-Kragi'c A,Radi'c M,Martinovi'c-Kaliterna D,Radi'c J.Glucocorticoid induced osteoporosis[J].Acta Clin Croat,2011,50(4):563-566.
[2]Wu QY,Ma W,Yu ZH,Lei YY,Li QZ.The control study of comparing with t wo modeling methods in osteoporosis[J].Chin J Trad Med Trau m Orthop(中国中医骨伤科杂志),2007,15(8):17-19.
[3]Li QN,Liang NC,Huang LF,Liao JM,Wu T.Skeletal effects of prednisone acetate on trabecular and cortical bone in Sprague-Dawley rats[J].Acta Phar m Sin(药学学报),1999,34(7):495-497.
[4]Sun P,Cai DH,Li QN,Chen H,Deng WM,He L,et al.Effects of alendronate and str ontiu m ranelate on cancellous and cortical bone mass in glucocorticoid-treated adult rats[J].Calcif Tissue Int,2010,86(6):495-501.
[5]Mc Laughlin F, Mackintosh J, Hayes BP, Mc Laren A,Uings IJ,Sal mon P,et al.Glucocorticoid-induced osteopenia in t he mouse as assessed by histo mor pho metr y,micr oco mputed t o mography,and biochemical mar kers[J].Bone,2002,30(6):924-930.
[6]Ogoshi T,Hagino H,Fukata S,Tanishi ma S,Okano T,Teshi ma R.Infl uence of gl ucocorticoid on bone in 3-,6-,and 12-mont h-old rats as deter mined by bone mass and histo morpho metry[J].Mod Rheu matol,2008,18(6):552-561.
[7]Li QN.Laboratory Ani mal-Research on Osteoporosis Bone Histo mor pho metry(骨质疏松实验动物研究——骨组织形态计量学)[M].Chengdu:Sichuang University Press,2001:38-43.
[8]Yang XP,Chen J,Lu L,Yang GZ,Cheng Q,Gao JL,et al.The different effects of short-ter m application of gl ucocorticoids in cancellous and cortical bone in SD rat[J].Chin J Osteopor osis(中国骨质疏松杂志),2010,16(4):265-269.
[9]Wang HF. Osteopor osis Dr ug Research Met hods and Techniques(骨质疏松症药效研究方法与技术)[M].Beijing:People′s Medical Publishing House,2009:(1):53.
[10]Lu L, Wang XL, Cai HN,Chen J,Yang GZ,Cheng Q,et al.Effects of long-ter m and inter mittent use of the dexamethasone on rat bone[J].China Med Her(中国医药导报),2011,8(23):5-6.
[11]Society of Osteoporosis and Bone Mineral Diseases of Chinese Medical Association.Gl ucocortioid-induced osteoporosis guidelines(Draft)[J].Chin J Gen Pract(中华全科医师杂志),2006,5(8):460-461.
[12]O′Brien CA,Jia D,Plotkin LI,Bellido T,Powers CC,Stewart SA,et al.Glucocorticoids act directly on osteoblasts and osteocytes to induce their apoptosis and reduce bone formation and strength[J].Endocrinology,2004,145(4):1835-1841.
[13]Tsampalieros A,Gupta P,Denburg MR,Shults J,Zemel BS,Mostoufi-Moab S,et al.Glucocorticoid effects on changes in bone mineral density and cortical structure in childhood nephrotic syndrome[J].J Bone Miner Res,2013,28(3):480-488.
[14]Yang XP,Li QN.Research progress of the t wo-way role on osteogenesis by gl ucocorticoids and its relationship with osteoporosis[J].Chin J Osteoporosis(中 国骨质疏松 杂 志),2010,(6):454-458.

