细胞色素P450的性别依赖性表达及生长激素对其调控和机制的研究进展
杨 树,李 燕
(中国医学科学院北京协和医学院药物研究所药物代谢研究室,北京 100050)
细胞色素P450(cytochrome P450,CYP)又称肝微粒体混合功能氧化酶,主要分布于肝细胞的滑面内质网,是参与药物代谢的关键酶,其活性和表达水平具有明显的个体差异并受遗传、环境和年龄等因素影响。不同性别的个体肝中CYP的表达总量不同,特定CYP亚型在体内的分布表达及其酶的活性也存在性别差异性,如雌性大鼠CYP水平较雄性大鼠低10% ~30%。雄性大鼠体内CYP主要亚型为CYP2A2,CYP2C13和CYP2D1,而CYP2C11和CYP3A2仅在雄性体内分布;雌性大鼠体内CYP的主要亚型为CYP2A1,CYP2C7和CYP2E1,而CYP2C12仅在雌性体内分布[1]。在人体中主要的 CYP亚型为 CYP1A2,CYP2C9,CYP2C19,CYP2D6,CYP2E1和CYP3A4,女性体内CYP3A4的活性要高于男性,而CYP2D6,CYP1A2及CYP2C19的活性则低于男性[2]。不同性别大鼠肝微粒体主要CYP酶的相互比较如表1所示。人肝CYP的主要亚型为CYP3A,但其在大鼠肝中浓度很低,CYP2C11和CYP2C12是大鼠肝主要的CYP亚型,但在人肝中根本不存在。
生长激素是由垂体分泌的一种肽类激素,其释放模式受性别影响。雌大鼠的生长激素呈持续性释放,整体水平及达峰浓度均较低;雄大鼠生长激素呈脉冲式释放,仅在每3.5~4 h达释放高峰时才能检测到。人体中生长激素的释放方式同大鼠一样,表现为性别依赖性的释放。上述体内生长激素因性别差异而释放方式的不同可导致CYP表达不同,从而引起药物代谢的性别差异。本文综述了CYP的性别依赖性表达及生长激素在CYP性别依赖性表达中的作用及其分子机制。
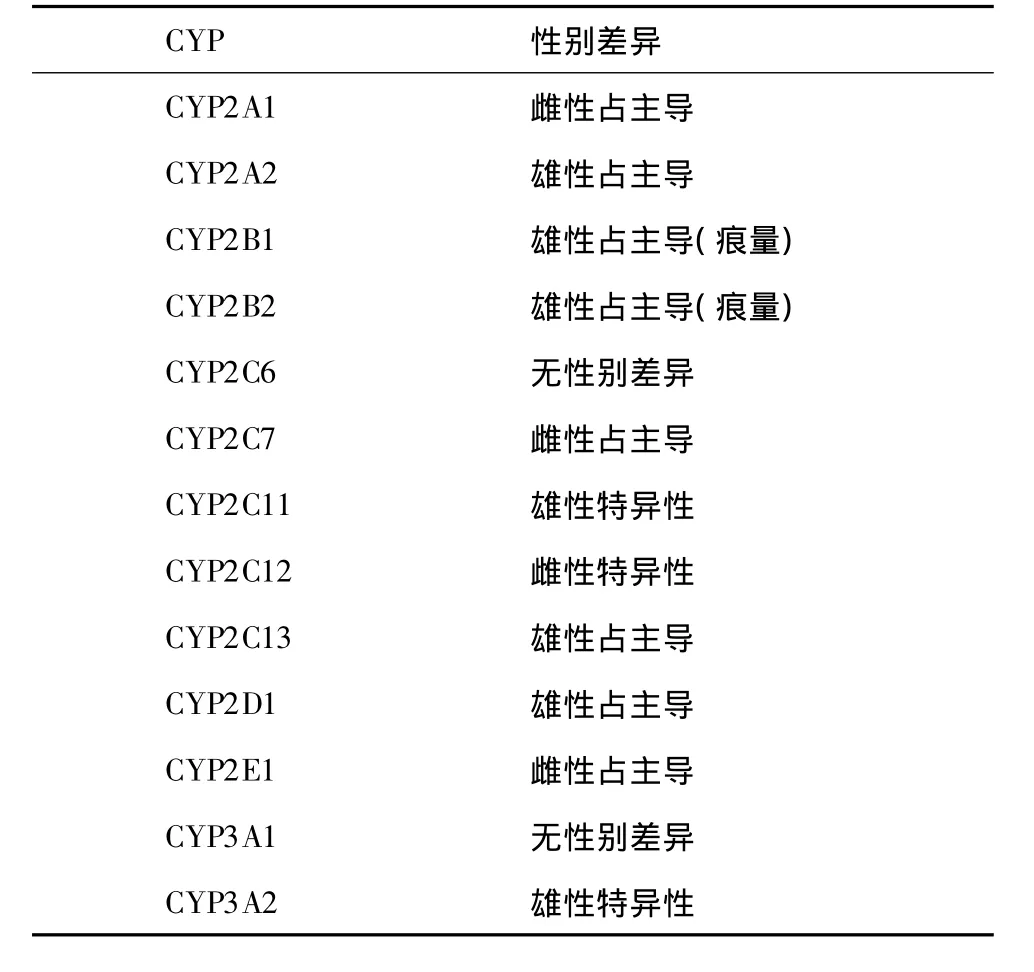
表1 不同性别大鼠肝微粒体内所含细胞色素P450(CYP)酶亚型差异[1]
1 肝药物代谢的性别差异与CYP性别依赖性表达
Nicholas等[3]研究发现,雌性大鼠ig给予巴比妥类后睡眠时间较雄性大鼠明显延长,主要是由于雌鼠体内参与代谢的CYP含量较低,使药物在雌鼠体内的代谢明显慢于雄鼠,导致血药浓度高而持久。
人体内CYP表达的差异可导致药物代谢的性别差异。男性体内比女性清除率高的药物有甲苯巴比妥、氯氮平、普萘洛尔、氯唑沙宗和右美沙芬等;男性体内比女性清除率低的药物有红霉素、维拉帕米、甲泼尼龙、泼尼松龙和茶碱等。Watkins等[4]研究表明,红霉素在女性体内的代谢速率比男性快25%,其原因不是蛋白结合率差异,而是女性体内CYP3A4活性较高所致。由于女性肝主要参与药物代谢的CYP3A4表达量高于男性,因此,抗肿瘤药物异环磷酰胺在女性体内的N-去氯乙基反应更加明显,产生神经毒性的风险也更大[5]。男性体内 CYP1A2的含量高于女性,鉴于CYP1A2是奥氮平和氨氯平等安定类药物的主要代谢酶,因此,女性患者服用此药后体内药物代谢清除较慢、药效持续时间长,其精神症状改善较男性患者更为明显,但同时由于清除率低引起的药物在体内蓄积从而产生的不良反应率也较高[6]。
2 生长激素对CYP的性别依赖性表达的调控
雌雄体内CYP表达不同是药物代谢性别差异的重要原因,已知性激素对CYP表达有重要调节作用。雄性大鼠体内CYP含量高于雌性大鼠,去势或给予雌激素可以明显降低CYP含量和相对活性,而给予睾酮激素可恢复CYP水平和活性[7]。新生雄大鼠雄激素的水平预示了其成熟后体内CYP特异亚型的表达,也决定了该鼠体内是否能表达全套雄性CYP[8]。科学家曾经认为,性激素可直接影响CYP的表达,后来发现去势雄性大鼠垂体切除后给予睾酮不能恢复CYP的雄性表达特征,由此才逐步认识完整的垂体系统在性激素对CYP表达的调控中必不可少。进一步研究表明,垂体前叶分泌的生长激素介导了性激素对CYP表达的调控,引起该酶表达的性别依赖性[9]。
生长激素是由193个氨基酸组成的蛋白质激素,其释放受性激素调控并存在明显的性别差异。雄大鼠生长激素以每隔3.5 h的脉冲方式释放入血,峰值约为200μg·L-1,脉冲间隔期内(约2 h)检测不到生长激素。而雌大鼠血中生长激素释放较为频繁,尽管达峰水平低于雄鼠,但生长激素20~30μg·L-1在血中持续存在。生长激素在雌雄体内不同的释放方式引起CYP表达的性别差异。大鼠垂体切除后CYP表达的性别差异性消失,脉冲式给予生长激素可增加体内CYP含量,提高药物代谢能力,而持续性给予生长激素则使CYP含量减少,使药物代谢呈现雌性化特征。生长激素不同的释放方式可影响特定CYP亚型的表达。Jarukamjorn等[10]研究发现,CYP2A4,CYP2B9,CYP2B10和CYP3A41在雌小鼠中的表达明显高于雄小鼠,而雄小鼠中CYP2D9表达较高。雌小鼠脉冲式给予生长激素可以抑制CYP2A4等同工酶的表达,增加CYP2D9表达。与此相反,雄小鼠持续性给予生长激素可促进CYP2A4等表达,同时抑制CYP2D9表达。此外,Löfgren等[11]发现,在 CYP2C18 和 CYP2C19 转基因大鼠中两酶的基因表达具有雄性依赖性并可被持续给予生长激素所抑制。
人体内生长激素的释放方式也由性激素调控,不同的释放方式对肝中CYP表达的影响不一。生长激素缺乏的男性和女性患者通过脉冲式给予生长激素比持续性给予对CYP1A2活性的下调作用更加显著,而持续性给予生长激素能明显提高肝CYP3A4的活性[12]。持续给予生长激素可诱导原代肝细胞CYP3A4 mRNA和蛋白的表达,而脉冲式给予生长激素则产生抑制作用。
生长激素对CYP表达的影响呈现出生后的发育调控模式,即CYP的表达在未成熟期并不表现出性别差异,而是随着年龄增长逐渐显现。Waxman等[13]在CYP3A4转基因大鼠的研究发现,雌鼠体内持续性生长激素释放可诱导CYP3A4 mRNA和蛋白的表达;未成熟期雄大鼠肝可表达CYP3A4,但出生6周后表达水平明显下降并低于检测限,而转基因雌大鼠在未成熟期和成年期均有CYP3A4表达;雄大鼠CYP3A4表达在成年期检测不到,而雌鼠CYP3A4在成年期仍有表达。肝CYP3A4的表达在转基因大鼠的成年期出现性别差异而不是未成熟期,是因为生长激素性别依赖性的释放方式源于新生儿期性激素对下丘脑的作用,青春期开始明显并一直持续至成年期,特定CYP亚型的表达是由性激素和下丘脑-垂体轴所调控的[14]。
3 生长激素调控的CYP性别依赖性基因的分类
性别依赖性CYP基因根据生长激素的不同调控方式可分为Ⅰ类和Ⅱ类基因。Ⅰ类基因受生长激素的正调控,其表达需要生长激素的参与,垂体切除后其表达下降。Ⅱ类基因受生长激素的负调控,生长激素存在时抑制其表达,垂体切除后其表达增加。CYP2C11是Ⅰ类雄性依赖性基因,其表达需要生长激素的刺激,每隔100~140 min脉冲式给予雄性大鼠生长激素可促进CYP2C11表达,停止给予生长激素后,其表达下降到正常水平的25%~30%。而持续性的生长激素释放则为Ⅰ类雌性依赖性基因CYP2C12表达所必需,大鼠垂体切除后,其表达需要持续性给予生长激素,雄大鼠CYP2C12的表达可被持续性地给予生长激素诱导至正常雌鼠水平。CYP2A2,CYP2C13和CYP3A2属于Ⅱ类雄性依赖性基因,垂体切除后,其表达水平达到最高,持续性生长激素释放则完全抑制其表达。Ⅱ类雄性依赖性基因同时也受到脉冲式释放的生长激素抑制,因此,其表达是在生长激素脉冲式释放的间隔期内,呈间断性表达。Ⅱ类基因CYP2A1和CYP2B9表达呈现雌性依赖性是因为持续性生长激素释放对其的抑制要弱于脉冲式生长激素释放[15]。
4 生长激素对CYP性别依赖性表达调控的机制
4.1 信号转导子和转录激活子(signal transducer and activator of transcription,STAT)5b在生长激素对CYP表达调控中的作用
生长激素与细胞表面的生长激素受体结合,引起非受体酪氨酸激酶JAK2构象变化从而激活该酶,活化的JAK2可以使生长激素受体上的酪氨酸残基磷酸化,为一系列信号转导蛋白提供结合位点,从而激活下游的信号转导通路。STAT家族是生长激素对胰岛素样生长因子-1(insulin growth factor,IGF-1)和某些转录因子和药物代谢酶表达调控过程中的重要信号转导蛋白。生长激素激活的JAK2至少使4种STAT家族蛋白(STAT1,STAT3,STAT5a和 STAT5b)磷酸化,STAT被磷酸化后可以形成二聚体从而进入细胞核内,同相应的DNA反应元件结合引起基因转录,其中STAT5a和STAT5b在生长激素影响肝CYP表达中发挥重要作用[16]。
STAT5a和STAT5b的结构具有90%的相似性,均含有保守的SH2结合区和位于羧基端以及可被磷酸化的酪氨酸位点。其中SH2结合域介导STAT与磷酸化的生长激素受体结合,结合后的STAT可被JAK2磷酸化后形成STAT二聚体,使得STAT被活化。STAT5a除在乳腺发育中发挥重要的生理作用,还同某些CYP表达有关。STAT5a缺失的雌小鼠肝中CYP2A12,CYP2D22,CYP3A16和 CYP8B1的表达下降[17]。STAT5b的活性与生长激素的释放相关并具有性别差异性。雄大鼠STAT5b可被脉冲式释放的生长激素激活,在生长激素的脉冲间隔期内活性也随之下降,而雌大鼠持续性生长激素释放使STAT5b的活性维持在较低水平。Holloway等[18]研究发现,在STAT5b缺失雄小鼠中,雄性依赖性CYP2D9,CYP7B1,CYP4A12表达下降至雌小鼠水平,而CYP2B9,CYP2B10,CYP2B13,CYP2A16,CYP3A41 和CYP3A44等6种雌性依赖性CYP基因的表达则明显上升,提示STAT5b促进雄小鼠体内雄性依赖性CY450的表达,而对雌性依赖性CYP表达产生抑制作用。野生型雄小鼠垂体切除后,脉冲式给予生长激素可恢复雄性依赖性CYP的表达,说明STAT5b在生长激素影响雄小鼠CYP的表达中有不可或缺的作用[19]。
已知生长激素的分泌可受某些神经内分泌激素控制,通过调节这些激素可导致雄小鼠CYP表达的雌性化。众所周知,垂体分泌生长激素受两种下丘脑激素调控,即生长抑素和促生长激素释放素,前者抑制生长激素释放,后者促进生长激素释放。Bennet等[20]发现,STAT5b缺陷小鼠生长抑素的mRNA转录降低,提示STAT5b可促进生长抑素的表达,在生长激素引起的生长抑素反馈调节中具有重要作用。STAT5b缺失将导致生长抑素表达减少,生长激素释放抑制的减弱,血中生长激素持续性释放,CYP表达呈雌性化特征。生长激素结合生长激素受体后激活STAT5b引起IGF-1表达,而IGF-1可抑制生长激素释放。STAT5b缺失可降低IGF-1的表达,反馈性地减弱对生长激素释放的抑制作用,血中生长激素含量升高,导致CYP表达呈雌性化[21]。
Laz等[22]通过染色质免疫沉淀反应的方法发现,STAT5b直接与DNA相应的结合区结合影响基因转录,其结合的频率同脉冲式生长激素释放的频率相吻合。但也有两项研究表明,STAT5b可能并不是介导生长激素对CYP表达调控的唯一因子。首先,垂体切除大鼠给予一次脉冲式释放的生长激素可在5~10 min内激活STAT5b,但相应的基因转录却没有同步发生。其次,雄大鼠持续给予生长激素引起STAT5b活性下降但引起其基因表达呈现雌性化特征的过程却较慢[23]。因此,除了STAT5b外,可能还有其他的转录因子参与。Gardmo等[24]研究表明,雌大鼠生长激素对雌性依赖性CYP2C12表达的调控需要HNF6,HNF3α和HNF3β等转录激活因子的参与。肝细胞核因子(hepatic nuclear factor,HNF)6是一种主要在雌大鼠中表达的转录因子,受生长激素调控并参与CYP2C12表达。雄大鼠持续给予生长激素或STAT5b缺乏均可增加转录抑制蛋白表达,从而导致雄性依赖性CYP2C11表达的下降[25]。Bcl-6是主要在雄小鼠表达并受生长激素调控的转录抑制蛋白,竞争性地结合STAT5的靶点从而抑制CYP2C12的表达[26]。
4.2 肝细胞核因子4α在生长激素对CYP表达调控中的作用
在介导生长激素对CYP表达影响的转录因子中,除了STAT5b,最为重要的还有HNF4α。HNF4α是位于肝的转录因子,参与肝的正常生长和基本功能的调节,包括脂代谢平衡、脂蛋白及胆酸的合成。Holloway等[27]研究表明,HNF4α或STAT5b缺失后对雄小鼠肝中性别依赖性基因表达的影响存在相似性。与STAT5b一样,HNF4α可促进雄小鼠体内雄性依赖性CYP的表达而对部分雌性依赖性CYP表达存在抑制作用。Nakayama等[28]研究发现,雄小鼠 CYP2A4,CYP3A16和CYP2C12基因的启动子域中有HNF4α的功能结合位点,提示这些基因的完全表达需要HNF4α的参与。人体CYP2B6基因的HNF4α结合位点如出现单个核苷酸的多态性可引起该基因表达的多态性[29]。Jover等[30]研究表明,人原代肝细胞中CYP3A4,CYP3A5和CYP2A6的表达需要HNF4α的参与。因此,HNF4α是通过结合CYP基因上的特定区域从而激活该基因的表达,影响CYP在不同性别体内的表达含量。
Odom等[31]通过染色质免疫沉淀法发现了HNF4α调控基因上的HNF4α功能结合域,证实HNF4α通过与DNA结合域直接结合发挥作用。雄性大鼠肝HNF4α蛋白含量和DNA结合域的活性是雌性大鼠的5倍,因此,受HNF4α调控的CYP表达存在雌雄差异。
HNF4α可通过与CYP3A41启动序列上的-99/-87区域结合从而增加其表达活性。组蛋白H3第4赖氨酸甲基化可使染色质结构开放,而组蛋白H3第27赖氨酸甲基化则抑制基因转录,保持异染色质状态。相比雄小鼠,雌小鼠CYP3A41基因启动子内组蛋白H3第4赖氨酸甲基化和低组蛋白H3第27赖氨酸甲基化水平高使染色质的结构更易于HNF4α与其结合位点的结合,从而增加CYP3A41基因表达[32]。
STAT5b与HNF4α可协同参与对CYP表达的调控,Wiwi等[33]研究发现,STAT5b 可增强 HNF4α 对 CYP2D9 和CYP8B1表达的激活作用。HNF4α和STAT5b可协同激活转录因子HNF6,从而改变CYP2C12的表达[34]。
4.3 表观遗传在生长激素对CYP表达的调控中的作用
表观遗传修饰即不改变基因序列,通过基因修饰,蛋白与蛋白、DNA和其他分子相互作用而影响基因功能和特性。某些修饰表观遗传的方式,如DNA胞嘧啶一磷酸鸟嘌呤甲基化、组蛋白翻译后的修饰以及与非编码RNA的相互作用,可以导致常染色质转变为异染色质从而抑制基因表达[35]。染色质易接触性改变一直是基因转录调控中的重要环节[36]。研究表明,CYP2C11和CYP2C12基因的启动域存有DNA酶Ⅰ高度敏感的结合位点并具有性别和生长激素依赖性。这些超敏位点含有特异的DNA序列,为特异性DNA结合蛋白识别从而参与基因转录。生长激素通过STAT5b与HNF4α调控引起的染色质易接触性变化可能导致CYP表达的性别差异[37]。
常染色质处于伸展状态,易于转录。而异染色质处于固缩凝集状态,不易于转录。持续给予生长激素使得常染色质转变为异染色质从而引起雄性依赖性CYP表达的抑制,而在STAT5b和HNF4α缺失大鼠中出现的雌性特异性CYP表达激活则可能是异染色质转变为常染色质[38]。
此外,持续给予生长激素可诱导雄性成年大鼠CYP3A16,CYP3A41和 CYP3A44表达,即使在 STAT5b缺失情况下也会出现,说明生长激素可激活不依赖于STAT5b的信号转导通路,如丝裂原激活蛋白激酶通路。以上CYP3A16,CYP3A41和CYP3A44基因均在未成熟期雄性和雌性大鼠表达,进入青春期后雄性大鼠的蛋白表达下调,可能源自持久性紧缩异染色质结构的形成[39]。
5 展望
生长激素可通过STAT5b和HNF4α等转录因子调控CYP的性别特异性表达,从而影响药物代谢的性别差异。生长激素调控的信号转导通路涉及到多个转录因子的参与,这些转录因子的表达受到生长激素不同释放方式的影响,明确转录因子同生长激素的相互作用以及对CYP表达的影响将有助于加深理解生长激素的分子调控机制。CYP家族种类繁多,确定更多的受生长激素影响的特定CYP亚型将是进一步的研究目标。生长激素可促进一些激素蛋白的表达,如胰岛素样生长因子等,这些激素在生长激素对CYP调控中所起的作用也是值得关注的方向。生长激素除影响CYP表达外,对肝其他蛋白的表达也有一定作用,如受体、信号分子和参与脂类及外源物代谢的酶类,涉及机体的脂代谢平衡、免疫炎症和疾病状态等多个生理病理反应,研究生长激素对上述蛋白表达的调控还有利于认识和解释某些疾病的性别差异。
[1]Zhao Y,Liu XQ,Qian ZY,Wang GJ.Sex-dependent metabolism of drugs[J].Prog Pharm Sci(药学进展),2001,25(5):289-293.
[2]Deng M,Liu HC.Effect of gender on pharmacokinetics[J].Chin J Clin Phar macol(中国临床药理学杂志),2004,20(1):68-71.
[3]Nicholas JS,Barron DH.The use of sodium amytal in the production of anesthesia in the rat[J].J Pharmacol Exp Ther,1932,46(1):125-129.
[4]Watkins PB,Turgeon DK,Saenger P,Lown KS,Kolars JC,Hamilton T,et al.Comparison of urinary 6-beta-cortisol and the erythromycin breath test as measures of hepatic P450ⅢA(CYP3A)activity[J].Clin Pharmacol Ther,1992,52(3):265-273.
[5]Inagaki K,Inagaki M,Kataoka T,Sekido I,Gill MA,Nishida M.A wide interindividual variability of urinary 6beta-hydroxycortisol to free cortisol in 487 healthy Japanese subjects in near basal condition[J].Ther Drug Monit,2002,24(6):722-727.
[6]Wang J,Huang Y.Pharmacogenomics of sex difference in chemotherapeutic toxicity[J].Curr Dr ug Discov Technol,2007 ,4(1):59-68.
[7]Kramer RE,Greiner JW,Rumbaugh RC,Sweeney TD,Colby HD.Relation of the gonadal hormones to growth hormone actions on hepatic drug metabolism in rats[J].J Pharmacol Exp Ther,1978,204(2):247-254.
[8]Dannan GA,Guengerich FP,Waxman DJ.Hormonal regulation of rat liver microsomal enzymes.Role of gonadal steroids in programming,maintenance,and suppression of delta 4-steroid 5 alpha-reductase,flavin-containing monooxygenase, and sex-specific cytochromes P-450[J].J Biol Chem,1986,261(23):10728-10735.
[9]Mode A,Gustafsson JA,Jansson JO,Edén S,Isaksson O.Association between plasma level of growth hormone and sex differentiation of hepatic steroid metabolism in the rat[J]. Endocrinology,1982,111(5):1692-1697.
[10]Jarukamjorn K,Sakuma T,Jaruchotikamol A,Ishino Y,Oguro M,Nemoto N.Modified expression of cytochrome P450 mRNAs by growth hormone in mouse liver[J].Toxicology,2006,219(1-3):97-105.
[11]Löfgren S,Baldwin RM,Hiratsuka M,Lindqvist A,Carlberg A,Sim SC,et al.Generation of mice transgenic for human CYP2C18 and CYP2C19:characterization of the sexually dimorphic gene and enzyme expression[J].Drug Metab Dispos,2008,36(5):955-962.
[12]Veldhuis JD, Bowers CY. Human GH pulsatility:an ensemble property regulated by age and gender[J].J Endocrinol Invest,2003,26(9):799-813.
[13]Waxman DJ,O'Connor C.Growth hormone regulation of sex-dependent liver gene expression[J].Mol Endocrinol,2006,20(11):2613-2629.
[14]Jansson JO,Edén S,Isaksson O.Sexual dimorphism in the control of growth hormone secretion[J].Endocr Rev,1985,6(2):128-150.
[15]Wauthier V,Waxman DJ.Sex-specific early growth hormone response genes in rat liver[J].Mol Endocrinol,2008,22(8):1962-1974.
[16]Herrington J, Carter-Su C. Signaling pathways activated by the growth hormone receptor[J].Trends Endocrinol Metab,2001,12(6):252-257.
[17]Clodfelter KH, Miles GD, Wauthier V, Holloway MG,Zhang X,Hodor P,et al.Role of STAT5a in regulation of sex-specific gene expression in female but not male mouse liver revealed by microarray analysis[J].Physiol Genomics,2007,31(1):63-74.
[18]Holloway MG,Laz EV,Waxman DJ.Codependence of growth hormone-responsive,sexually dimorphic hepatic gene expression on signal transducer and activator of transcription 5b and hepatic nuclear factor 4alpha[J].Mol Endocrinol,2006,20(3):647-660.
[19]Clodfelter KH,Holloway MG,Hodor P,Park SH,Ray WJ,Waxman DJ.Sex-dependent liver gene expression is extensive and largely dependent upon signal transducer and activator of transcription 5b(STAT5b):STAT5b-dependent activation of male genes and repression of female genes revealed by microarray analysis[J].Mol Endocrinol,2006,20(6):1333-1351.
[20]Bennett E,McGuinness L,Gevers EF,Thomas GB,Robinson IC,Davey HW,et al.Hypothalamic STAT proteins:regulation of somatostatin neurones by growth hormone via STAT5b[J].J Neuroendocrinol,2005,17(3):186-194.
[21]Davey HW,Xie T,McLachlan MJ,Wilkins RJ,Waxman DJ,Grattan DR.STAT5b is required for GH-induced liver IGF-1 gene expression[J].Endocrinology,2001,142(9):3836-3841.
[22]Laz EV,Sugathan A,Waxman DJ.Dynamic in vivo binding of STAT5 to growth hormone-regulated genes in intact rat liver.Sex-specific binding at low-but not high-affinity STAT5 sites[J].Mol Endocrinol,2009,23(8):1242-1254.
[23]Gebert CA,Park SH,Waxman DJ.Down-regulation of liver JAK2-STAT5b signaling by the female plasma pattern of continuous growth hormone stimulation[J].Mol Endocrinol,1999,13(2):213-227.
[24]Gardmo C,Mode A.In vivo transfection of rat liver discloses binding sites conveying GH-dependent and female-specific gene expression[J].J Mol Endocrinol,2006,37(3):433-441.
[25]Laz EV,Holloway MG,Chen CS,Waxman DJ.Characterization of three growth hormone-responsive transcription factors preferentially expressed in adult female liver[J].Endocrinology,2007,148(7):3327-3337.
[26]Zhang Y,Laz EV,Waxman DJ.Dynamic,sex-differential STAT5 and BCL6 binding to sex-biased,growth hormone-regulated genes in adult mouse liver[J].Mol Cell Biol,2012,32(4):880-896.
[27]Holloway MG,Miles GD,Dombkowski AA,Waxman DJ.Liver-specific hepatocyte nuclear factor-4alpha deficiency:greater impact on gene expression in male than in female mouse liver[J].Mol Endocrinol,2008,22(5):1274-1286.
[28]Nakayama K,Sudo Y,Sasaki Y,Iwata H,Takahashi M,Kamataki T.Studies on transcriptional regulation of Cyp3a16 gene in mouse livers by application of direct DNA injection method[J].Biochem Biophys Res Commun,2001,287(4):820-824.
[29]Lamba V,Lamba J,Yasuda K,Strom S,Davila J,Hancock ML,et al.Hepatic CYP2B6 expression:gender and ethnic differences and relationship to CYP2B6 genotype and CAR(constitutive androstane receptor)expression[J].J Pharmacol Exp Ther,2003,307(3):906-922.
[30]Jover R, Bort R, Gómez-Lechón MJ, Castell JV.Cytochrome P450 regulation by hepatocyte nuclear factor 4 in human hepatocytes:a study using adenovirus-mediated antisense targeting[J]. Hepatology,2001,33(3):668-675.
[31]Odom DT,Dowell RD,Jacobsen ES,Gordon W,Danford TW,MacIsaac KD,et al.Tissue-specific transcriptional regulation has diverged significantly between human and mouse[J].Nat Genet,2007,39(6):730-732.
[32]Bhadhprasit W, Sakuma T, Kawasaki Y, Nemoto N.Hepatocyte nuclear factor 4αregulates expression of the mouse female-specific Cyp3a41 gene in the liver[J].Drug Metab Dispos,2011,39(3):490-497.
[33]Wiwi CA,Waxman DJ.Role of hepatocyte nuclear factors in transcriptional regulation of male-specific CYP2A2[J].J Biol Chem,2005,280(5):3259-3268.
[34]Gonzalez FJ. Regulation of hepatocyte nuclear factor 4 alpha-mediated transcription[J].Drug Metab Pharmacokinet,2008,23(1):2-7.
[35]Delcuve GP,Rastegar M,Davie JR.Epigenetic control[J].J Cell Physiol,2009,219(2):243-250.
[36]Kwon SH, Workman JL. The heterochromatin protein 1(HP1)family:put away a bias toward HP1[J].Mol Cells,2008,26(3):217-227.
[37]Endo M,Takahashi Y,Sasaki Y,Saito T,Kamataki T.Novel genderrelated regulation of CYP2C12 gene expression in rats[J].Mol Endocrinol,2005,19(5):1181-1190.
[38]Wiwi CA,Gupte M,Waxman DJ.Sexually dimorphic P450 gene expression in liver-specific hepatocyte nuclear factor 4alpha-deficient mice[J].Mol Endocrinol,2004,18(8):1975-1987.
[39]Sakuma T,Kitajima K,Nishiyama M,Endo Y,Miyauchi K,Jarukamjorn K, et al. Collaborated regulation of female-specific murine Cyp3a41 gene expression by growth and glucocorticoid hormones[J].Biochem Biophys Res Commun,2004,314(2):495-500.

