OVCAR细胞转染miR-130b下调多梳基因-1蛋白表达增加对卡铂敏感性
林 琳,程晓东,傅真富
(1.浙江大学校医院妇科,浙江杭州 310058;2.浙江大学医学院附属妇产科医院,浙江杭州 310006;3.浙江省肿瘤医院,浙江杭州 310022)
卵巢癌是严重威胁妇女健康的恶性肿瘤之一,其早期诊断比较困难,大约75%的患者诊断时已处于中晚期,所以化学治疗是卵巢癌的主要手段,虽然近年来化疗方案的不断改进,但其5年生存率却一直徘徊在25%~30%,原发性或继发性耐药是其化疗成功的主要阻碍[1-2]。微小 RNA(microRNA,miRNA)是近年来发现的一类长17~25个核苷酸的内源性非编码小RNA,其与靶点mRNA的非翻译区域 (untranslated regions,3'UTR)区结合,诱导靶mRNA的降解或抑制翻译[3]。miRNA是目前已知的最大一类调节基因,其在细胞的生长、增殖、分化、凋亡和个体的发育中发挥着重要作用,最近的研究表明,miRNA参与了许多癌症的发生发展[4],例如miR-21,miR-155,miR-373等发挥着癌基因的作用,而 miR-148a,let-7,miR-15a,miR-143,miR-34,miR-16等发挥着抑癌基因作用,并且最近已有 miRNA 用 于 治 疗 恶 性 肿 瘤 的 报 道[5-6]。miR-130b是一个新发现的miRNA,已有研究显示其通过调节抑癌基因RUNX3的活性抑制胃癌的发生[7],并且在卵巢癌细胞中干扰miR-130b表达可以诱导细胞的耐药[8]。
多梳基因-1(Bmi-1)为多梳组基因(polycomb group genes,PcG)家族成员之一,是近年来新发现的一个癌基因,参与鼻咽癌、乳腺癌、肺癌和膀胱癌等多种人类肿瘤的发生和发展,Bmi-1主要是下调细胞周期的抑制基因p16和p19表达,加速细胞G1/S期的过渡,从而导致细胞恶性克隆性增生[9-10]。
本研究观察了卵巢癌OVCAR细胞转染miR-130b基因片段后卡铂对其敏感性的改变,并探讨了转染miR-130b基因片段对Bmi-1蛋白表达的影响。
1 材料与方法
1.1 试剂及主要仪器
卵巢癌OVCAR细胞购于美国ATCC细胞库。青霉素、链霉素、四甲基偶氮唑蓝(MTT)和卡铂为美国Sigma公司产品,胎牛血清购于杭州四季青生物工程材料有限公司,Lipofectiamine 2000购自广州英韦创津公司,Trizol购自分子探针公司,逆转录试剂盒购自大连宝生物公司,miRNA荧光定量PCR检测试剂盒购自北京普博辛生物科技有限公司,miR-130b和内参U6引物、miR-130b模拟物以及阴性对照由上海吉玛制药技术有限公司合成,Bmi-1、GAPDH抗体和HRP标记的兔抗鼠二抗购自美国Santa Cruz公司。7100荧光定量PCR仪为美国ABI公司产品。
1.2 细胞培养
人卵巢癌上皮OVCAR细胞培养于含10%胎牛血清、青霉素 100 kU·L-1及链霉素 100 kU·L-1的RPMI 1640培养液中,培养条件为37℃,5%CO2。
1.3 细胞RNA转染实验
OVCAR细胞接种于6孔板,细胞达到70%~80% 融合时,按照Lipofectiamine 2000转染试剂盒说明书进行基因转染实验。化学合成的miR-130b模拟物:5'-UCAAUUUGCAUUUCGAAGUUU-3',阴性对照为:5'-UUCGUCAUACGGCCUUAUACU-3';48 h后收集细胞提取总RNA,进行干扰效果的鉴定和相应的实验。
1.4 细胞总RNA的提取及RT-PCR
收集细胞,每5×105~1×106个细胞加入1 ml Trizol,按照Trizol说明书操作,提取细胞总 RNA,按照逆转录试剂盒说明书逆转录出cDNA第一链,用于后续的荧光定量PCR检测。
1.5 荧光定量PCR扩增检测miR-130b的表达
按照试剂盒说明书加入Q-PCR混合物、引物,置入7100荧光定量PCR仪反应。miR-130b正义引物:5'-CTCGGCAGTCAGGCGT-3',反义引物:5'-GTCTCCGTCGCTTTCAGACGAT-3';内参照U6正义引物:5'-CTCGTTCGGCAGCACA-3',反义引物:5'-AACGCTTCACAATGTGCGT-3'。扩增反应条件:94℃预变性15 s,95℃ 30 s,60℃ 15 s扩增40个循环,最后72℃延伸30 s。待测miRNA的表达量用2-△Ct表示,△Ct值=目的基因Ct值-内参基因 Ct值[5]。
1.6 MTT检测细胞存活
将处于对数生长期的正常对照组、miR-130b模拟物转染组和阴性对照组OVCAR细胞分别接种到96孔板,12 h后加入对倍系列稀释的卡铂(100,50,25,12.5,6.25,3.12,1.56 和 0.78 μmol·L-1)作用68 h。不同处理的 OVCAR细胞,加入 20 μl MTT 0.5 g·L-1孵育 4 h,100 μl DMSO 溶解结晶,酶标仪570 nm波长处测定吸光度(A)值,计算细胞存活抑制率(%)=(1-A用药组/A对照组)×100%。每个浓度设3个复孔,实验重复3次。参照肖建初等[11]的方法使用 Bliss法计算半数抑制浓度(IC50值)。
1.7 Western印迹法检测多梳基因-1蛋白的表达
收集正常对照组、miR-130b模拟物转染组和阴性对照组OVCAR细胞,PBS洗涤2次,1×SDS上样缓冲液裂解细胞,95℃ 10 min,12000×g离心10 min,取上清,8%~12%SDS-PAGE 胶电泳2 h,电转移蛋白至PVDF膜,将PVDF膜浸润在含5%脱脂奶粉的TBST中1 h,加入特异性一抗4℃过夜,加入HRP标记的二抗室温孵育1 h,最后加入发光底物X线曝光显示目的蛋白条带。蛋白条带使用美国Bio-Rad公司生产的QuantityOne软件进行积分吸光度(IA)值分析,以目标蛋白与内标的IA比值表示蛋白的相对表达量。
1.8 统计学分析
2 结果
2.1 OVCAR细胞转染miR-130b模拟物鉴定
荧光定量 PCR结果显示,正常对照组、miR-130b模拟物转染组和阴性对照组miR-130b表达的相对值分别为 0.22±0.08,0.46±0.12和0.23±0.10,miR-130b 模拟物转染组miR-130b表达显著高于正常对照组和阴性组(P<0.01),正常对照组和阴性组之间无统计学差异。说明转染miR-130b模拟物的OVCAR细胞中miR-130b表达显著增加,转染成功。
2.2 转染miR-130b模拟物对OVCAR细胞存活的影响
MTT实验结果显示(图 1),正常对照组、miR-130b模拟物转染组和阴性对照组卡铂对卵巢癌 OVCAR 细胞的 IC50值分别为 32.4±4.6,14.7±2.1和(31.4±4.2)μmo·lL-1,miR-130b模拟物转染组显著低于正常对照组和阴性对照组(P<0.01),说明上调miR-130b后可以显著增加卡铂对OVCAR细胞的敏感性,其敏感性约增加了2.21 倍。
2.3 转染miR-130b模拟物对OVCAR细胞Bmi-1蛋白表达的影响
图2结果显示,正常对照组、miR-130b模拟物转染组和阴性对照组Bmi-1蛋白条带的IA值分别为0.75±0.16,0.21±0.12 和 0.77±0.18;与正常对照组相比,miR-130b模拟物转染组Bmi-1蛋白的表达出现显著降低(P<0.01),而阴性对照组 Bmi-1蛋白的表达则无显著性改变。
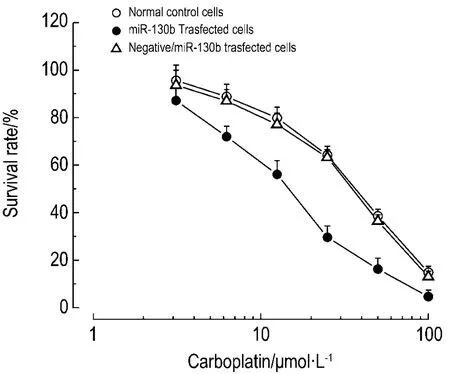
Fig.1 Effectofmimic/miR-130b tranfection on OVCAR cell survival treated with carboplatin 0.78 -100 μ mol·L -1for 68 h by MTT assay.
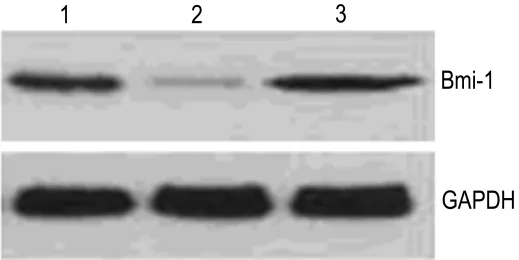
Fig.2 Effect of miR-130b tranfection on expression of Bmi-1 by Western blotting.Lane 1:normal control cells;lane 2:mimic/miR-130b trasfected cells;lane 3:negative/miR-130b trasfected cells.
3 讨论
miRNA模拟物是新近研发的一种可以刺激相应靶miRNA过表达的化学合成物,目前已广泛用于miRNA的过表达研究,给miRNA的功能研究带来了极大的方便[12]。本研究中荧光定量PCR结果显示,所使用的miR-130b模拟物可以成功上调miR-130b的表达,在miR-130b高表达的状态下,检测了卡铂对卵巢癌OVCAR细胞的敏感性,结果显示,miR-130b高表达可以显著增加卡铂对OVCAR细胞的毒性。化疗是卵巢癌的主要治疗方法之一,但是化疗药物的细胞毒性和耐药性则是成功化疗的主要障碍。上述结果提示,化疗时联用miR-130b有可能减少卡铂的用量或者克服卡铂的耐药。
进一步的研究显示,miR-130b模拟物转染组OVCAR细胞的Bmi-1蛋白出现了显著的降低。已有研究显示,Bmi-1在卵巢上皮性肿瘤中高表达,并且与淋巴结转移及预后密切相关,是卵巢癌患者独立的预后指标,并且细胞学实验结果也显示了基因沉默 Bmi-1后,可以显著抑制卵巢癌细胞的生长[13-14]。由此推测,高表达的 miR-130b 可能是通过下调Bmi-1的表达增加了卡铂对卵巢癌OVCAR细胞的敏感性,具体miR-130b调控Bmi-1的机制还有待进一步的研究来阐明。另外,本研究仅仅是在细胞水平完成的实验,在体内能否可以达到相似的效果,还有待进一步的裸鼠移植瘤实验来证实。
综上所述,高表达miR-130b可以增加卡铂对卵巢癌细胞的敏感性,下调Bmi-1蛋白表达可能是其增敏作用的主要机制,提示miR-130b有望成为克服卵巢癌铂类耐药的新靶点。
[1]Clarke-Pearson DL. Clinicalpractice. Screening for ovarian cancer[J].N Engl J Med,2009,361(2):170-177.
[2]Pliarchopoulou K,Pectasides D.Epithelial ovarian cancer:focus on targeted therapy[J].Crit Rev Oncol Hematol,2011,79(1):17-23.
[3]Morozova N,Zinovyev A,Nonne N,Pritchard LL,Gorban AN,Harel-BellanA. KineticsignaturesofmicroRNA modes of action[J].RNA,2012,18(9):1635-1655.
[4]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[5]Farazi TA,Spitzer JI,Morozov P,Tuschl T.miRNAs in human cancer[J].J Pathol,2011,223(2):102-115.
[6]Sorrentino A,Liu CG,Addario A,Peschle C,Scambia G,Ferlini C.Role of microRNAs in drug-resistant ovarian cancer cells[J].Gynecol Oncol,2008,111(3):478-486.
[7]Lai KW,Koh KX,Loh M,Tada K,Subramaniam MM,Lim XY,et al.MicroRNA-130b regulates the tumour suppressor RUNX3 in gastric cancer[J].Eur J Cancer,2010,46(8):1456-1463.
[8]Yang C,Cai J,Wang Q,Tang H,Cao J,Wu L,et al.Epigenetic silencing of miR-130b in ovarian cancer promotes the development of multidrug resistance by targeting colony-stimulating factor 1[J].Gynecol Oncol,2012,124(2):325-334.
[9]Park IK, Morrison SJ, Clarke MF. Bmi1,stem cells,and senescence regulation[J].J Clin Invest,2004,113(2):175-179.
[10]Hu ZH, Hu YD. Study condition of the relationship between BMI-1 gene and tumor[J].Chin J Cancer Prev Treat(中华肿瘤防治杂志),2006,13(23):1824-1827.
[11]Xiao JC.A BASIC Program computing LD50with figure by bliss method[J].J Sun Yat-sen Univ(中山医科大学学报),1988,9(8):80-81.
[12]Zhou XC,Qiu LH.The effects of miRNA-7 on the invasion and proliferation of human ovarian cancer cell line HO-8910 and HO-8910pm cells[J].Prog Obstet Gynecol(现代妇产科进展),2012,21(5):332-336.
[13]Huang XX,Chen JW,Li M,Cao Y,Hou JH,Wu QL,et al.Expression of Bmi-1 in ovarian carcinoma and its clinicopathological significance[J].J Sun Yat-Sen Univ(Med Sci)〔中山大学学报(医学科学版)〕,2010,31(6):852-866.
[14]Xin T,Zhang FB,Sui GJ,Jin XM.Bmi-1 siRNA inhibited ovarian cancer cell line growth and decreased telomerase activity[J].Br J Biomed Sci,2012,69(2):62-66.

