HPLC法测定益母草中的黄酮类化合物
翁爱彬 郑荔莉 方剑英
益母草为唇形科植物益母草的干燥地上全草,全国大部分地区均有分布,为一年或两年生草本,在花未全开时采摘,是常用的中药材,其的干燥成熟果实也可作为中药材。益母草性微寒、味辛和微苦,功效具有活血、调经、消水、清热解毒等[1]。临床上主要用于心血管疾病、产后瘀痛、血液病、月经不调等[2],近年来进一步扩展了益母草的药用及美容保健价值[3]。益母草化学成分比较复杂,主要为生物碱、黄酮类化合物、二萜类、挥发油类、有机酸类和糖类等[4]。黄酮类化合物具有防癌抗癌作用、抗肿瘤作用、抗心血管疾病、消除自由基和抗氧化作用等生理活性[5],目前对益母草中黄酮类化合物的测定分析方法有紫外可见分光光度法、毛细管电泳-电化学检测(CE-ED)法和细管电泳-紫外检测法。紫外可见分光光度法设备简单,但是成分复杂多样时容易受到杂质的影响。造成一定的误差,甚至带来错误的结果。因此不适合益母草中黄酮类成分的含量测定。毛细管电泳-电化学检测(CE-ED)法毛灵敏度高,准确性好,是一种可靠的定性定量分析传统中药益母草及其制剂中生物活性成分的重要方法,但实验条件要求高,操作比价繁琐。细管电泳-紫外检测法重现性好、简便、快速,准确率高,但是实验室条件要求高,仪器昂贵,在一般的实验室测定准确不高的,故不予推广。其中高效液相色谱法具有高速、高效、高灵敏度等优点,是常用的一种定性定量的分析手段。而采用HPLC法同时测定益母草中芦丁和槲皮素的方法,目前文献中报道尚少。因此为了更好的控制益母草的质量,本论文采用HPLC同时测定益母草中芦丁和槲皮素的含量,摸索合适的色谱条件,准确测量益母草有效成分芦丁和槲皮素的含量。
1 实验仪器与试剂
LC-2010AHT高效液相色谱仪(日本岛津);KQ3200DB型数控超声波清洗器(功率100 W,频率40 kHz);六两装高速中药粉碎机(武义县屹立工具有限公司);BT25S电子分析天平(北京赛多利斯仪器系统有限公司)。
对照品芦丁(批号:100080-200707,纯度:99.9%),槲皮素(批号:100081-200907,纯度:99.9%),(中国药品生物制品检定所);益母草药材[安徽(凯利),批号:20100705]。甲醇为纯色谱;其他试剂均为分析纯;实验用水为超纯水。
2 方法与结果
2.1 溶液的制备
2.1.1 供试品溶液的制备:精密称取用六两装高速中药粉碎机粉碎的益母草粉末2 g(过20目筛),置于称量瓶(30×60)中,加75%乙醇20 ml,用KQ3200DB型数控超声波清洗器(功率100 W,频率40 kHz)超声30 min后取出,冷却后过滤,滤渣再用同方法提取1次,合并两次的提取液,经减压浓缩得乙醇浸膏;加适量的甲醇溶解所得的乙醇浸膏并转移到5 ml量瓶中,加甲醇稀释至刻度,摇匀后用0.45 μm微孔滤膜滤过,取续滤液,取得的续滤液即为本实验的供试品溶液。
2.1.2 混合对照品溶液的制备:精密称取对照品芦丁3 mg和槲皮素2 mg,分别放置到标记1和2的5 ml棕色量瓶中,加适量的甲醇溶解后继续加甲醇稀释至刻度即可,摇匀,然后再分别用移液枪准确移取芦丁和槲皮素的对照品储备液各4 ml,放置到10 ml容量瓶中,然后加甲醇至刻度,摇匀,即得混合对照品溶液(芦丁:0.24 mg/ml,槲皮素:0.16 mg/ml)。
2.2 色谱条件 色谱柱:ODS-C18柱 5 μm(150×4.6 mm),流动相:甲醇-1%乙酸水溶液(55∶45,V/V)溶液系统梯度洗脱,柱温:30℃,流速:1.0 ml/min,检测波长:260 nm,进样量:20 μl。混合对照品色谱图见图1,益母草供试品色谱图见图2。

图1 混合对照品色谱图(1-芦丁;2-槲皮素)

图2 益母草供试品色谱图(1-芦丁;2-槲皮素)
2.3 方法学的考察
2.3.1 线性关系考察:分别精密量取“2.1.2”项下已制备的混合对照品溶液 0.125,0.25,0.5,1.0,1.5,2.0,3.0 ml至5 ml容量瓶中,加甲醇至刻度,摇匀,制成分别含芦丁 6、12、24、48、72、96、144 μg/ml和含槲皮素 4、8、16、32、48、64、96 μg/ml的溶液,每份溶液都用0.45 μm微孔滤膜滤过,取续滤液各进样20 μl,在上述的色谱条件进行RP-HPLC分析,以对照品峰面积为纵坐标Y,以对照品浓度(μg/ml)为横坐标X,绘制标准曲线并进行回归运算,计算得到芦丁的回归方程为:y=38906.11x+144016.2,r=0.9984(n=7),槲皮素的回归方程为:y=70738.89x+24655.54,r=0.9995(n=7),结果表明:芦丁的进样浓度在6.0~144.0 μg/ml范围内,进样量和峰面积的线性关系良好,而槲皮素的进样溶度在4.0 ~96.0 μg/ml范围内,进样量和峰面积有良好的线性关系。用稀释法进行HPLC测定确定本方法的芦丁和槲皮素的最低检测限分别为0.1875 μg/ml和 0.25 μg/ml。
2.3.2 精密度实验:精密吸取由“2.1.2”项下制备的混合对照品溶液(芦丁:96.0 μg/ml,槲皮素:64.0 μg/ml),在“2.2”项下的色谱条件进样20 μl,重复进样测定6次,芦丁的6次峰面积平均值为3954153,日内RSD为0.24%;槲皮素的6次峰面积平均值为4461044,日内 RSD为1.51%。精密吸取由“2.1.2”下制备的混合对照品溶液(芦丁:96.0 μg/ml,槲皮素:64.0 μg/ml),连续6 d 在上述的色谱条件下,1 次/d 进样20 μl测定,芦丁的6次峰面积平均值为 3917046,日间 RSD为1.49%;槲皮素的6次峰面积平均值为4452686,日间RSD为1.66%。结果显示表明这个实验的精密度良好。
2.3.3 稳定性实验:吸取分别放置了 0、2、4、8、12、24 h 的供试品溶液,在上述的色谱条件下进样20 μl进行测定,芦丁的峰面积平均值为857625,RSD为1.38%;槲皮素的峰面积平均值为575531,RSD为1.53%。结果显示说明益母草供试品溶液在24h之内是比较稳定的。
2.3.4 加样回收率实验:取已知槲皮素和芦丁含量的益母草药材样品,共3份,精密称取适量,每份分别准确加入低、中、高三个水平的槲皮素和芦丁对照品溶液适量。按“2.1.1”项下的方法制备成待测的供试品溶液,在上述色谱条件下,进样20μL,依法测定并计算槲皮素和芦丁的平均回收率。见表1。
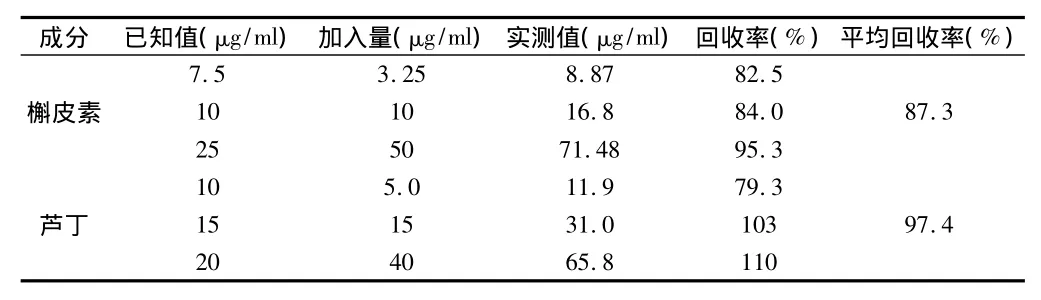
表1 槲皮素和芦丁的加样回收率实验结果
2.4 样品测定 精密称取益母草粉末2 g,按“2.1.1”项下的步骤操作,制备成供试品溶液。在上述色谱条件下进样20 μl测定,采用校准曲线法计算样品中芦丁和槲皮素的含量,结果为益母草药材中芦丁和槲皮素的含量分别为0.892 mg/g和0.405 mg/g。
3 讨论
3.1 流动相的选择 分别用甲醇-水(55∶45)、甲醇-1%乙酸水(45∶55)、甲醇-1%乙酸水(55∶45)、甲醇-1%乙酸水(58∶42)溶液系统,对混合对照品进行洗脱。结果显示甲醇-水(55∶45)溶液洗脱时槲皮素的峰形有明显的拖峰,甲醇-1%乙酸水(45∶55)溶液洗脱时芦丁的峰与溶剂峰很接近,甲醇-1%乙酸水(58∶42)溶液洗脱时槲皮素保留时间延长,甲醇-1%乙酸水(55∶45)洗脱时芦丁和槲皮素的色谱分离度和色谱峰的峰形均好,芦丁和槲皮素在20 min内出峰完毕。所以流动相采用甲醇-1%乙酸水(55∶45)溶液系统。
3.2 流动相流速的选择 在流动相为甲醇-1%乙酸水(55∶45),柱温为30℃的条件下,在0~1.0 ml/min流速下测定混合对照品溶液,对芦丁和槲皮素的色谱分离进行比较。结果在流速为1.0 ml/min时,色谱峰的分离度和出峰时间均好,故确定流速为1.0 ml/min。
3.3 检测波长的选择 芦丁和槲皮素为黄酮醇苷类和黄酮醇类,在甲醇溶液中的紫外吸收光谱有两个吸收带组成,分别在328~385 nm和240~280 nm[6],在流动相为甲醇-1%乙酸水(55∶45)溶液系统,流速为1.0 ml/min,柱温为30℃的条件下,实验比较了360 nm和260 nm这两个波长的测定效果,结果表明槲皮素和芦丁的混合对照品溶液会在260 nm处得到最大吸收和较好峰形,故确定260 nm为本实验的测定波长。
3.4 供试品溶液制备的选择 通过文献的查阅,提取黄酮类化合物的方法有微波法[7]、超声波提取法[8]、酶提取法[9]、乙醇为溶剂索氏提取器提取[10]等,由于实验条件的有限,本实验采用超声波提取法,杂质比较多使得槲皮素和芦丁的峰和杂质峰没有实现基线分离,对实验结果有一定的影响。考察了甲醇、75%乙醇和无水乙醇三种提取溶剂的提取效果,发现75%乙醇作为提取溶剂是提取效果较好,同时也考察了超声提取时间,最后确定75%乙醇为样品的提取溶剂,提取时间为30 min。
RP-HPLC法测定益母草中的芦丁和槲皮素的含量分别为0.892 mg/g和0.405 mg/g,该方法简便、准确度高、重现性好,是一种较好的含量测定方法,可为益母草中药材的质量控制提供实验依据。
1 蔡少青主编.生药学.第5版.北京:人民卫生出版社,2010.277.
2 魏丽春,李庆军.益母草的药理与临床研究进展.西北药学杂志,2009,24:333-335.
3 申利红,王胜利.益母草的研究进展.安徽农业科学,2010,38:4414-4416.
4 阮金兰,曾庆忠.益母草的化学、药理和临床研究进展.中草药,2003,34:附15-附 18.
5 延玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展.有机化学,2008,28:1534-1544.
6 吴立军主编.天然药物化学.第4版.北京:人民卫生出版社,2007.188.
7 韩秋菊,鲍亚丽.微波法提取木立芦荟黄酮类化合物的工艺研究.安徽农业科学,2011,39:9565-9567.
8 王斌,徐守霞.超声波辅助法提取凤尾草中黄酮类化合物的影响因素研究.湖北农业科学,2011,50:1878-1879.
9 王悦,肖旭萍.桔皮中提取黄酮类化合物方法的比较分析.食品研究与开发,2007,38:73-76.
10 郑敏燕,魏永生.油菜蜂花粉黄酮含量的HPLC测定.分析测试学报,2004,23:95-97.

