赫赛汀联合顺铂对人卵巢癌SKOV3裸小鼠移植瘤的抑制作用研究
刘静芳,汤在祥,胡建铭 (.苏州大学附属第一医院妇产科,江苏 苏州 5000;.苏州大学公共卫生学院遗传流行病与基因组学研究中心,江苏 苏州 5000)
卵巢癌(Ovarian Cancer)是发生于女性生殖器官的三大恶性肿瘤之一,其死亡率居妇科恶性肿瘤之首。传统的卵巢癌治疗由于肿瘤细胞基因的不稳定性导致对各种化疗药物的耐药性逐渐增强,因此晚期卵巢癌的5年生存率一直徘徊在20%~30%。因此寻找新型治疗方法具有非常重要的临床意义。
赫赛汀是针对HER-2/neu蛋白设计的人源化鼠嵌合型抗体,是一种新型、高效、低毒、选择性强的靶向治疗药物,1998年被美国FDA批准上市,已通过Ⅲ期临床试验,取得了令人鼓舞的疗效[1]。在细胞水平上,王家菁等人的研究显示[2],赫赛汀能有效抑制肾癌细胞的生长,对瘤细胞的耐药性也有一定的抑制作用。胡志全等人将赫赛汀与干扰能联合应用[3],发现联合用药能有效抑制肾癌细胞生长,对瘤细胞的耐药性具有一定逆转作用。司马玲等人的研究表明[4],赫赛汀联合姜黄素能够抑制卵巢癌细胞系SKOV3的增殖,这种抑制作用通过促进肿瘤细胞凋亡而实现。在动物模型上,张宇等人发现赫赛汀对HER2基因高表达胃癌细胞裸鼠移植瘤具有显著的抑制作用[5]。而柳建军等人在小鼠上的研究表明,赫赛汀对HER2阳性的实验性膀胱肿瘤具有抑制生长促进凋亡的作用[6]。在临床研究上,杜珂等人的研究表明[7],赫赛汀联合长春瑞滨治疗晚期乳腺癌是有效且安全的治疗方案,不良反应可耐受,可作为晚期乳腺癌一线方案应用。王永凤等人的临床研究显示[8],与赫赛汀单独应用和常规化疗相比,赫赛汀联合紫杉醇能显著提高HER22过表达的转移性乳腺癌的疗效,且不增加不良反应。也有研究发现该药对过表达HER-2/neu蛋白的晚期乳腺癌患者有较好的疗效,可明显延长生存期,与多种化疗药物有良好的协同效应。卵巢癌与乳腺癌相似,HER-2/neu蛋白的过度表达率为10% ~30%[9]。本研究拟将赫赛汀和顺铂联合应用,以探讨联合用药对高表达HER-2的人卵巢癌SKOV3裸鼠移植瘤的肿瘤抑制作用效果。
1 材料与方法
1.1 动物和试剂:人卵巢癌SKOV3细胞株(苏州大学免疫实验室提供);BALB/cA裸小鼠,雌性,5~6周龄,体重(18±2.0)g,由上海斯莱克实验动物有限公司所提供,合格证编号:SCXK(沪)2007-0005;赫赛汀(Roche,USA);顺铂:山东齐鲁制药厂;RPMI 1640培养基:美国Gibco公司;小牛血清:杭州四季青公司;鼠抗人Ki-67单克隆抗体:美国Santa Cruz公司;鼠抗人NF-kB p65单克隆抗体:美国Santa Cruz公司;细胞凋亡原位检测(TUNEL)试剂盒:德国Roche公司。
1.2 细胞培养:细胞用RPMI 1640培养液加10%优质胎牛血清,于37℃、5%CO2的饱和湿度培养箱中培养,24~48 h换液1次,当细胞的覆盖率达到70% ~80%时传代。每天在高倍显微镜下观察细胞生长情况,最后取对数生长期的细胞用于细胞接种。
1.3 动物接种:将传代培养处于对数生长期的人卵巢癌SKOV3细胞制备成细胞悬液后在细胞记数板上作细胞记数,调整形成活细胞浓度为4×107/ml的细胞悬液;在无菌条件下,将该细胞悬液接种于裸小鼠右侧背部皮下。于接种14天左右,小鼠右侧背部可见长出大小较为一致的瘤体,即为动物肿瘤模型建造成功。
1.4 动物分组及给药方案:将成瘤裸鼠随机分成五组:①生理盐水组(阴性对照组);②赫赛汀低剂量组;③赫赛汀高剂量组;④顺铂组;⑤赫赛汀高剂量与顺铂联合组。每组为15只裸鼠,在普通无菌室的超净生物层流架中分笼饲养。给药剂量参考前人和本课题组前期的研究,分别确定为:赫赛汀低剂量组20 mg/kg,赫赛汀高剂量组40 mg/kg,顺铂剂量5 mg/kg,阴性对照组给予等体积量生理盐水。各组均为尾静脉注射给药,每周1次,连续给药6周。其后观察各组的抑瘤率、生存期。抑瘤率(%)=(对照组瘤体积―实验组瘤体积)/对照组瘤体积×100%。
1.5 免疫组化实验:取各组肿瘤组织给予病理学检查及免疫组化染色。Envision二步法:60℃烤片30分钟后二甲苯脱蜡10 min,2次,梯度浓度乙醇(100%,95%,80%,70%)各5 min,蒸馏水洗5 min,2次,放入抗原修复液内微波修复10 min,PBS液洗3次,将切片在0.3%过氧化氢-甲醇溶液中室温下孵育30 min,再用PBS液洗3次,将切片置于湿盒中,滴入一抗,置于37℃孵育箱孵育30 min,PBS液洗3次,滴入Envision溶液,置于37℃孵育箱孵育30 min,PBS液洗3次;DAB显色15 min;水洗,苏木精淡染,蓝化,脱水,透明,封固。
1.6 结果判断:Ki-67以细胞核出现棕黄色或棕褐色颗粒为阳性细胞;NF-kB p65以胞核和(或)胞质出现黄色、棕黄色或棕褐色颗粒为阳性细胞。Ki-67、NF-kBp65的染色结果均以标记指数(labeling index,LI)记录,方法是任意选取10个400倍视野,计数1000个肿瘤细胞中的阳性细胞数,计算LI=(阳性细胞数/1000)×100。
1.7 统计学处理:采用SPSS17.0统计软件对数据进行处理,数据采用均数±标准差()表示,组间差异采用方差分析方法进行分析。
2 结果
在开始用药当天,各组裸鼠移植瘤的体积无差异(P>0.05)。由表1内数据可见,阴性对照组裸鼠瘤体体积增大较快,在14 d后阴性对照组瘤体体积显著大于四个实验组瘤体体积(P<0.01);其次是赫赛汀低剂量组,在各个时间点的增长速度也较快。然而,赫赛汀高剂量组和顺铂组在后期均有不同程度的降低,赫赛汀高剂量联合顺铂组肿瘤体积降低最快,在各个时间点与其他组具有显著差异,表明赫赛汀高剂量联合顺铂可有效降低肿瘤体积。在抑瘤率方面,表2结果显示:各组的抑瘤率均有不同程度上升,但在28 d后,赫赛汀高剂量联合顺铂组抑瘤率显著高于其他各组。值得一提的是,28 d后,赫赛汀高剂量组和顺铂组的抑瘤率差异没有统计学意义(P>0.05)。赫赛汀低剂量组的抑瘤率在各个时间点均最低,表明赫赛汀高剂量联合顺铂能有效抑制肿瘤发展。
表1 各组用药后不同时间肿瘤体积变化(,mm3)
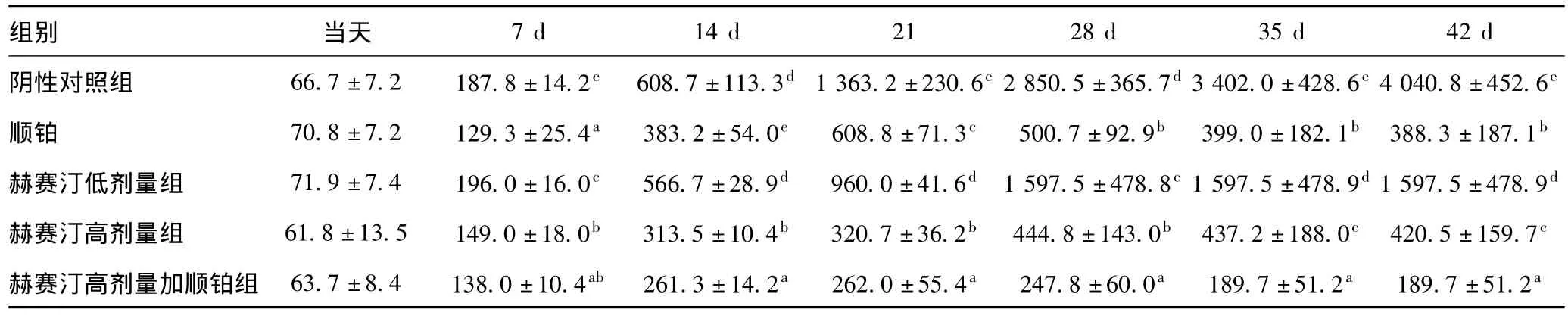
表1 各组用药后不同时间肿瘤体积变化(,mm3)
组别 当天7 d 14 d 21 28 d 35 d 42 d阴性对照组 66.7±7.2 187.8±14.2c 608.7±113.3d1363.2±230.6e2850.5±365.7d3402.0±428.6e4040.8±452.6e顺铂 70.8±7.2 129.3±25.4a 383.2±54.0e 608.8±71.3c 500.7±92.9b 399.0±182.1b 388.3±187.1b赫赛汀低剂量组 71.9±7.4 196.0±16.0c 566.7±28.9d 960.0±41.6d 1597.5±478.8c1597.5±478.9d1597.5±478.9d赫赛汀高剂量组 61.8±13.5 149.0±18.0b 313.5±10.4b 320.7±36.2b 444.8±143.0b 437.2±188.0c 420.5±159.7c赫赛汀高剂量加顺铂组 63.7±8.4 138.0±10.4ab 261.3±14.2a 262.0±55.4a 247.8±60.0a 189.7±51.2a 189.7±51.2a
表2 各治疗组肿瘤抑制率的比较(,%)
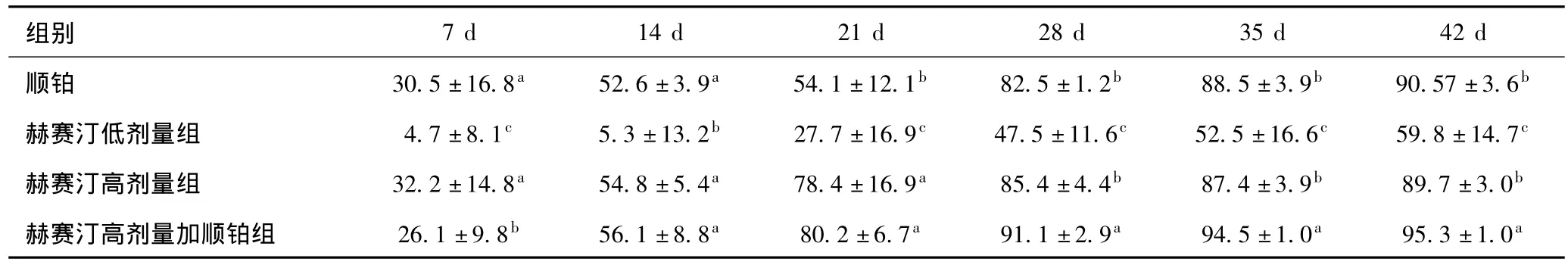
表2 各治疗组肿瘤抑制率的比较(,%)
组别7 d 14 d 21 d 28 d 35 d 42 d顺铂 30.5±16.8a 52.6±3.9a 54.1±12.1b 82.5±1.2b 88.5±3.9b 90.57±3.6b赫赛汀低剂量组 4.7±8.1c 5.3±13.2b 27.7±16.9c 47.5±11.6c 52.5±16.6c 59.8±14.7c赫赛汀高剂量组 32.2±14.8a 54.8±5.4a 78.4±16.9a 85.4±4.4b 87.4±3.9b 89.7±3.0b赫赛汀高剂量加顺铂组 26.1±9.8b 56.1±8.8a 80.2±6.7a 91.1±2.9a 94.5±1.0a 95.3±1.0a
3 讨论
原癌基因HER-2/neu又称c-erbB-2癌基因,最先是由Shih等在鼠的神经母细胞瘤中发现。人类的HER-2/neu癌基因定位于第17号染色体长臂q11~q22,编码分子量为185KD的跨膜糖蛋白,即HER-2/neu受体或称P185,包括一个富含半胱氨酸的细胞外区,一个疏水的跨膜区和一个细胞内酪氨酸激酶区[10]。目前,通过限制过度表达的HER-2的异常功能来改善HER-2阳性乳腺癌患者的病程成为一种新的治疗策略,人源化抗HER-2单抗赫赛汀是第一个针对HER-2阳性转移性乳腺癌的以癌基因为靶的治疗手段。目前三期临床结果证实,赫赛汀对HER-2/neu过表达的肿瘤具有良好疗效[11-12]。有文献报道,对过表达HER-2/neu的转移性乳腺癌,赫赛汀单药治疗的有效率达15% ~20%,与化疗药物(阿霉素、泰素、环磷酰胺等)联合应用时,可以明显提高疗效[13]。由于赫赛汀在乳腺癌治疗中取得的成功,因此在卵巢癌中针对HER-2的抗体靶向治疗也已经逐渐引起国内外学者的重视。关于赫赛汀体外抗增殖活性的研究发现[14-15],赫赛汀可使HER-2过度表达的乳腺癌细胞系SK-SB3Q生长受到有效抑制,对过度表达HER-2的卵巢癌和乳腺癌细胞系以及转染HER-2癌基因小鼠细胞也有生长抑制作用。
肿瘤细胞的最基本特征之一是细胞的失控性生长。而失控性增生的重要原因之一就是细胞周期调控机制的破坏[16]。细胞增殖过程由细胞周期来完成,受细胞周期调控机制严格控制,并决定细胞的分裂、分化和凋亡等过程。故而,抑制或降低肿瘤细胞的增殖活性,是肿瘤治疗的基本策略之一。Ki-67是反映细胞增殖的核抗原,在细胞周期的G1后期和M期细胞核表达,其免疫组化染色能检测肿瘤的增殖特征,与肿瘤恶性程度、浸润性、转移、复发密切相关,能准确反映出肿瘤的性质,其表达水平反映细胞的实际增殖程度[17]。细胞核因子 -kB(nuc1ear factor of kappa B,NF-KB)是癌基因 Rel家族中2个亚基形成的二聚体,最常见的形式有p65和p50形成的二聚体。它是一种重要的转录调节因子,参与多种细胞增殖、凋亡,具有抗凋亡的作用[18]。近年有研究发现肿瘤细胞耐药现象的产生也与NF-kB的活化有关[19]。
在本实验中,对瘤体组织的Ki-67和NF-kB表达检测结果显示:实验组中,除赫赛汀低剂量组外,其余各组肿瘤组织Ki-67和NF-kB的LI均低于阴性对照组组LI,两两比较发现:赫赛汀高剂量组肿瘤组织Ki-67和NF-kB的LI与顺铂组肿瘤组织的LI无统计学差异;而两者联合组的肿瘤组织Ki-67和NF-kB的LI则明显低于前两者单药组的LI。由此提示,赫赛汀能够明显抑制肿瘤的增殖活性,其机制可能是通过下调Ki-67、NF-kB的表达水平,从而抑制肿瘤细胞的增殖;且其与顺铂联合使用时可进一步抑制肿瘤的增殖活性,两者之间具有协同作用。
综上所述,抗HER-2人源化单克隆抗体赫赛汀能够抑制人卵巢癌SKOV3裸小鼠移植瘤的生长,明显延长荷瘤鼠生存时间,同时其与常规化疗药顺铂具有协同作用。赫赛汀是有望成为高表达HER-2卵巢癌的靶向性治疗药物;且在临床作为手术、化疗和放疗的辅佐治疗上有着广阔的应用前景。
[1]Fornier M,Esteva FJ,Seidman AD,Trastuzumab in combination with chemotherapy for the treatment of metastatic breast cancer[J].Semin Oncol,2000,27(6 Suppl 11):38.
[2]王家菁,胡志全,叶章群.赫赛汀联合IFNa-2b对肾癌细胞耐药性的影响耐药性的影响[J].山东医药,2005,45(15):23.
[3]胡志全,王家菁,叶章群.赫赛汀联合干扰能对肾癌细胞的杀伤抑制作用[J].中华实验外科杂志,2005,22(8):960.
[4]司马玲,姜群英,刘彩霞,等.赫赛汀联合姜黄素对卵巢癌细胞系SKOV3的抑制作用[J].现代生物医学进展,2011,11(16):3080.
[5]张 宇,郭建昇.赫赛汀对HER2高表达胃癌细胞裸鼠移植瘤效应的研究[J].中国医疗前言,2011,6(6):43.
[6]柳建军,李建昌.赫赛汀对大鼠膀胱肿瘤靶向治疗的体内研究[J]. 第三军医大学学报,2010,32(6):558.
[7]杜 珂,龚志敏.赫赛汀联合长春瑞滨治疗晚期乳腺癌疗效观察[J]. 国际检验医学,2010,2(2):276.
[8]王永凤,韩建军,刘月梅.赫赛汀联合紫杉醇治疗HER22过表达转移性乳腺癌[J].山东医药,2009,49(46):74.
[9]Verri E.HER2/neu oncoprotein overexpression in epithelial ovarian cancer:evaluation of its prevalence and prognostic significance.Clinical study[J].Oncology,2005,68(2 - 3):154.
[10]Padhy LC.Identification of a phosphoprotein specifically induced by the transforming DNA of rat neuroblastomas[J].Cell,1982,28(4):865.
[11]Vogel CL.Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer[J].J Clin Oncol,2002,20(3):719.
[12]Riemer AB.Generation of Peptide mimics of the epitope recognized by trastuzumab on the oncogenic protein Her-2/neu[J].J Immunol,2004,173(1):394.
[13]Shak S.Overview of the trastuzumab(Herceptin)anti-HER2 monoclonal antibody clinical program in HER2-overexpressing metastatic breast cancer[J].Herceptin Multinational Investigator Study GrouSemin Oncol,1999,26(4 Suppl 12):71.
[14]Petit AM.Neutralizing antibodies against epidermal growth factor and ErbB-2/neu receptor tyrosine kinases down-regulate vascular endothelial growth factor production by tumor cells in vitro and in vivo:angiogenic implications for signal transduction therapy of solid tumors[J].Am J Pathol,1997,151(6):1523.
[15]Pegram MD.Phase II study of receptor-enhanced chemosensitivity using recombinant humanized anti-p185HER2/neu monoclonal antibody plus cisplatin in patients with HER2/neuoverexpressing metastatic breast cancer refractory to chemotherapy treatment[J].J Clin Oncol,1998,16(8):2659.
[16]Clurman BE,Roberts JM.Cell cycle and cancer[J].J Natl Cancer Inst,1995,87(20):1499.
[17]Verdolini R.Cutaneous carcinomas and preinvasive neoplastic lesions.Role of MMP-2 and MMP-9 metalloproteinases in neoplastic invasion and their relationship with proliferative activity and p53 expression[J].J Cutan Pathol,2001,28(3):120.
[18]Xiao CW.Resistance of human ovarian cancer cells to tumor necrosis factor alpha is a consequence of nuclear factor kappaB-mediated induction of Fas-associated death domain-like interleukin-1beta-converting enzyme-like inhibitory protein[J].Endocrinology,2003,144(2):623.
[19]Bharti,A.C.and B.B.Aggarwal,Nuclear factor- kappa B and cancer:its role in prevention and therapy[J].Biochem Pharmacol,2002,64(5 -6):883.

