福尔可定原料药中有关物质测定方法的建立
赵学刚,冯雅慧,康海霞,滑千里,王乃浩(河北奥星集团药业有限公司,石家庄 050700)
福尔可定与磷酸可待因作用相似,具有中枢性镇咳作用,也有镇静和镇痛作用,但成瘾性较磷酸可待因弱,主要用于剧烈咳嗽和中度疼痛。新生儿和儿童易耐受此药,不致引起便秘和消化紊乱[1]。临床上已有的制剂有福尔可定片、复方福尔可定糖浆、复方福尔可定口服溶液。福尔可定已被2010年版《中国药典》(二部)、《欧洲药典》7.0版收载。《中国药典》[2]中本品采用薄层色谱(TLC)方法进行有关物质检查,采用化学比色法进行吗啡的检查,专属性较差。《欧洲药典》7.0版[3]采用高效液相色谱(HPLC)法的主成分自身对照法进行有关物质检查,但该方法不能检出工艺杂质N-(β-氯乙基)吗啉盐酸盐(CMH,因其无紫外吸收);同时吗啡和可待因的校正因子均不在0.95~1.05范围内,因此,用主成分自身对照法测定结果不够准确。为了严格控制产品质量,笔者在此基础上,对福尔可定的有关物质检查进行了系统研究,确定采用HPLC外标法测定已知杂质吗啡、可待因,主成分自身对照法测定未知杂质和总杂质;采用气相色谱(GC)外标法测定工艺杂质CMH;同时参考2010年版《中国药典》(二部)、《欧洲药典》7.0版、ICH(人用药品注册技术规范的国际协调会)指导原则[4]制定了本品有关物质的检查限度。
1 材料
e2695型HPLC仪,配置2998二极管阵列检测器(DAD)(美国Waters公司);6890N型GC仪(美国Agilent科技仪器有限公司);CPA225D电子天平(德国Sartorius公司)。
样品:福尔可定原料药(河北奥星集团药业有限公司,批号:050901、050902、050903、061101、061102、061103,纯度:99.86%、99.85%、99.86%、99.87%、99.88%、99.87%);福尔可定对照品(批号:171205-200504,纯度:99.8%)、吗啡对照品(批号:171201-200521,纯度:99.2%)、磷酸可待因对照品(批号:171203-200504,纯度:99.5%)均来源于中国食品药品检定研究院;CMH对照品(美国Sigma-Aldrich公司,批号:15803DH,纯度:99.9%);甲醇、乙腈均为色谱纯,磷酸二氢钾、氢氧化钠均为分析纯,水为去离子水。
2 方法与结果
2.1 HPLC检查有关物质
2.1.1 色谱条件。色谱柱:Phenomenex苯基己基柱(75 mm×4.6 mm,3 μm);流动相:乙腈-四氢呋喃-0.02 mol/L的磷酸盐缓冲溶液[量取80.0 ml氢氧化钠溶液(0.02 mol/L)和100.0 ml的磷酸二氢钾溶液(0.02 mol/L),置于1 000 ml量瓶中,用水稀释至刻度,摇匀](75∶50∶875,V/V/V),用氢氧化钠溶液(0.2 mol/L)调整pH值至7.9±0.05,流速:1.0 ml/min;检测波长:238 nm;进样量:20 μl;柱温:35 ℃。
2.1.2 供试品溶液的制备。精密称取样品约50 mg,置于50 ml量瓶中,用混合溶剂(量取80 ml乙腈,置于1 000 ml量瓶中,用0.02 mol/L的磷酸盐缓冲溶液稀释至刻度,摇匀)溶解并稀释至刻度,摇匀,滤过,即得。
2.1.3 对照溶液的制备。精密量取“2.1.2”项供试品溶液1 ml置于100 ml量瓶中,加混合溶剂稀释至刻度,摇匀,滤过,即得。
2.1.4 对照品溶液的制备。精密称取吗啡对照品、磷酸可待因对照品适量,加混合溶剂溶解并定量稀释制成每1 ml中约含吗啡10 μg、磷酸可待因26.5 μg(约相当于可待因20 μg)的溶液,作为对照品溶液。
2.1.5 专属性试验。精密称取样品约50 mg,共5份,分别进行强酸(盐酸1 mol/L)、强碱(氢氧化钠1 mol/L)、氧化(30%双氧水)、光照、高温(105℃,2 h)破坏处理后,用混合溶剂溶解并稀释制成1 mg/ml的溶液,分别精密量取续滤液20 μl注入色谱仪,同时进行DAD扫描,扫描范围为200~400 nm波长。结果表明,福尔可定与已知杂质分离较好,在各破坏条件下,主成分与降解产物能够得到良好分离,故本品中有关物质的检测方法专属性良好。
2.1.6 供试品溶液的稳定性。按“2.1.2”项下方法配制供试品溶液,分别于0、2、4、8、12 h量取20 μl,注入色谱仪,记录福尔可定峰面积。结果RSD=0.12%,表明供试品溶液在12 h内稳定。
2.1.7 回收率试验。分别精密称取样品9份,置于50 ml量瓶中,分别加入含吗啡10.12 μg/ml、磷酸可待因20.30 μg/ml的对照品溶液4、4、4、5、5、5、6、6、6 ml,溶液稀释至刻度,滤过,进样,测定其含量,计算回收率。回收率试验结果见表1。
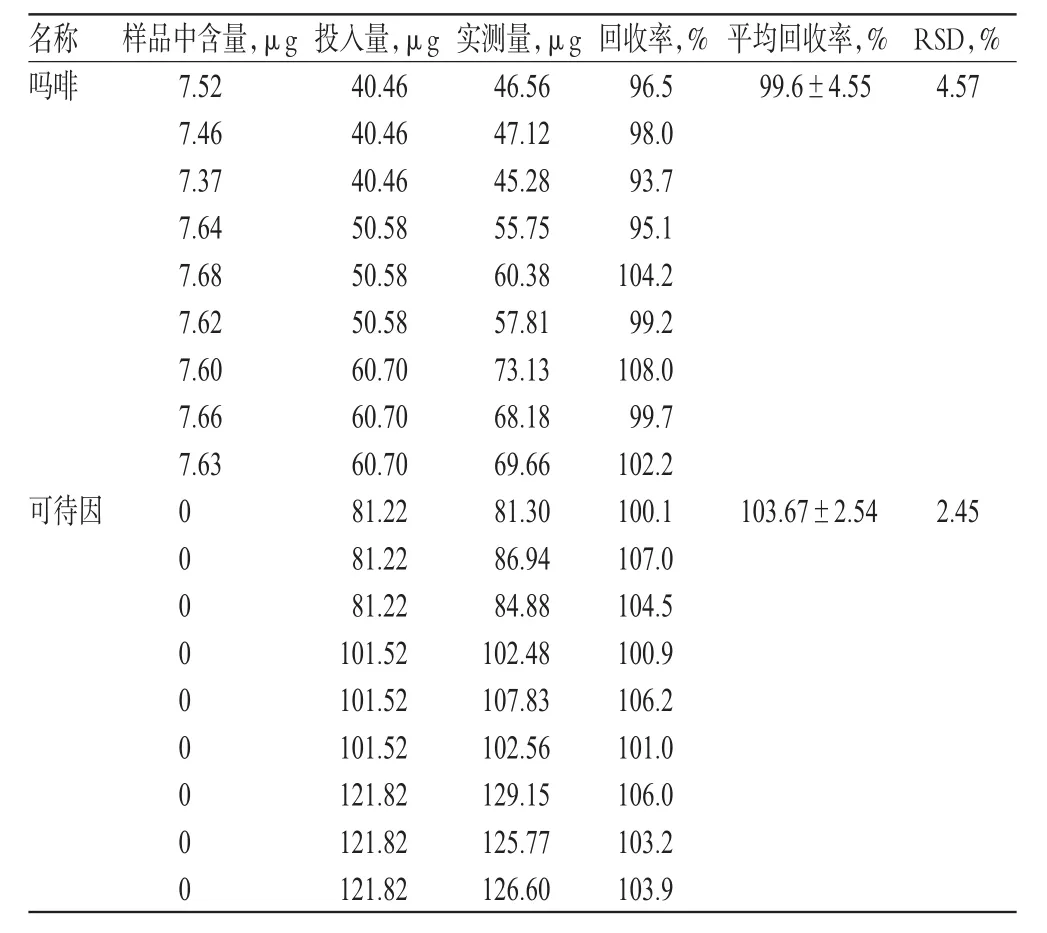
表1 吗啡、可待因回收率试验结果(n=9)Tab1 Results of recovery tests of morphine and codeine(n=9)
2.1.8 线性范围的确定。分别精密量取含吗啡10 μg/ml、磷酸可待因20 μg/ml的对照品溶液2、4、5、6、7、10 ml,置于50 ml量瓶中,用混合溶剂溶解并稀释至刻度,摇匀,滤过。进样测定,分别记录吗啡、可待因的色谱峰面积。将峰面积(y)与各自的质量浓度(x)作线性回归,计算吗啡、可待因的线性方程。结果分别为吗啡:y=17 598x-183.12(r=0.999 4),可待因:y=18 585x-1 020.3(r=0.999 1)。表明吗啡和磷酸可待因检测质量浓度线性范围分别为0.404 6~2.023 2、0.812 2~4.060 8 μg/ml。
2.1.9 定量限、检测限。取“2.1.4”项下对照品溶液,逐步进行稀释,然后进样,扫峰高为基线噪声的10倍计算定量限。结果,吗啡、可待因的定量限分别为0.2、0.4 μg/ml。
配制福尔可定对照品溶液,逐步进行稀释,然后进样,扫峰高为基线噪声的3倍计算,福尔可定的检测限为2.03 ng。
2.1.10 方法精密度试验。精密量取含吗啡1 μg/ml、磷酸可待因 2 μg/ml的对照品溶液 20 μl,连续测定 6 次。结果吗啡的RSD=1.23%,可待因的RSD=1.46%,表明本法精密度较好。
2.1.11 有关物质的测定结果。取6批样品测定,结果见表2,其中061101批样品色谱图见图1。
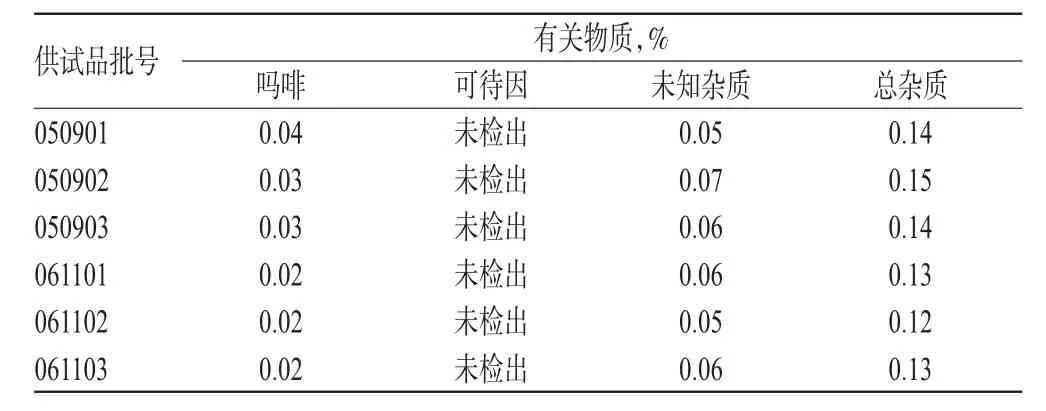
表2 6批样品中有关物质测定结果Tab2 Results of content determination of related substances in 6 batches of samples
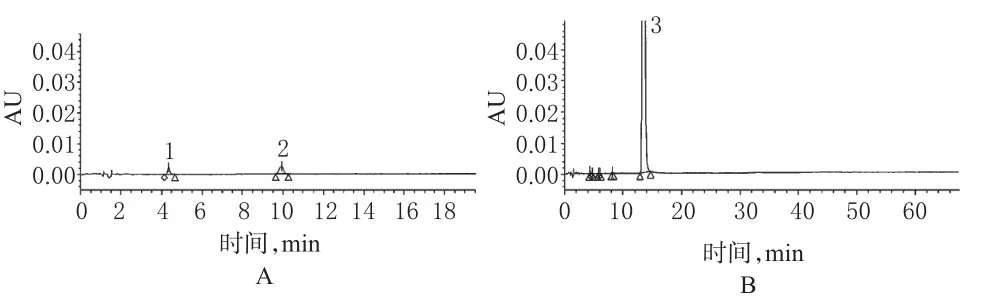
图1 高效液相色谱图A.对照品;B.样品;1.吗啡;2.可待因;3.福尔可定Fig1 HPLC chromatogramsA.substance control;B.sample;1.morphine;2.codeine;3.pholcodine
2.2GC法检查CMH
2.2.1 色谱条件。色谱柱:6%氰丙基苯基-94%二甲基聚硅氧烷为固定液的毛细管柱(30 m×530 μm,3 μm),型号:J&W DB-624;柱温:160 ℃;运行时间:10 min;检测器:氢火焰离子化检测器(FID);检测器温度:280℃;检测器气源组成比例:氮气-氢气-空气(30∶30∶400);进样口温度:250 ℃;分流比:10∶1;载气:氮气;流量:4.0 ml/min;进样量:1.0 μl。
2.2.2 供试品溶液的制备。精密称取样品适量,用甲醇溶解并定量稀释制成每1 ml中约含50 mg的溶液。
2.2.3 CMH对照品贮备液的制备。精密称取CMH约50 mg,置于100 ml量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得。
2.2.4 CMH对照品溶液的制备。精密量取对照品贮备液5 ml,置于50 ml量瓶中,用甲醇稀释至刻度,摇匀,即得。
2.2.5 专属性试验。取样品约0.50 g,精密称定,共5份,分别进行氧化(30%双氧水)、光照、高温(105℃,2 h)破坏处理,然后转移至10 ml量瓶中,用甲醇溶解并稀释至刻度,摇匀。精密量取1.0 μl,直接进样注入气相色谱仪。结果表明本品在氧化、光照、高温破坏条件下,CMH与降解产物能够得到良好分离。
甲醇、乙醇、苯、丁醇和甲苯是福尔可定合成工艺中用到的有机溶剂,因此还需要在本次试验色谱条件下考察5种残留溶剂对CMH测定的专属性:分别精密量取甲醇、乙醇、苯、丁醇和甲苯、CMH对照品适量,分别按“2.2.1”项下色谱条件直接进样,记录色谱图,详见图2。
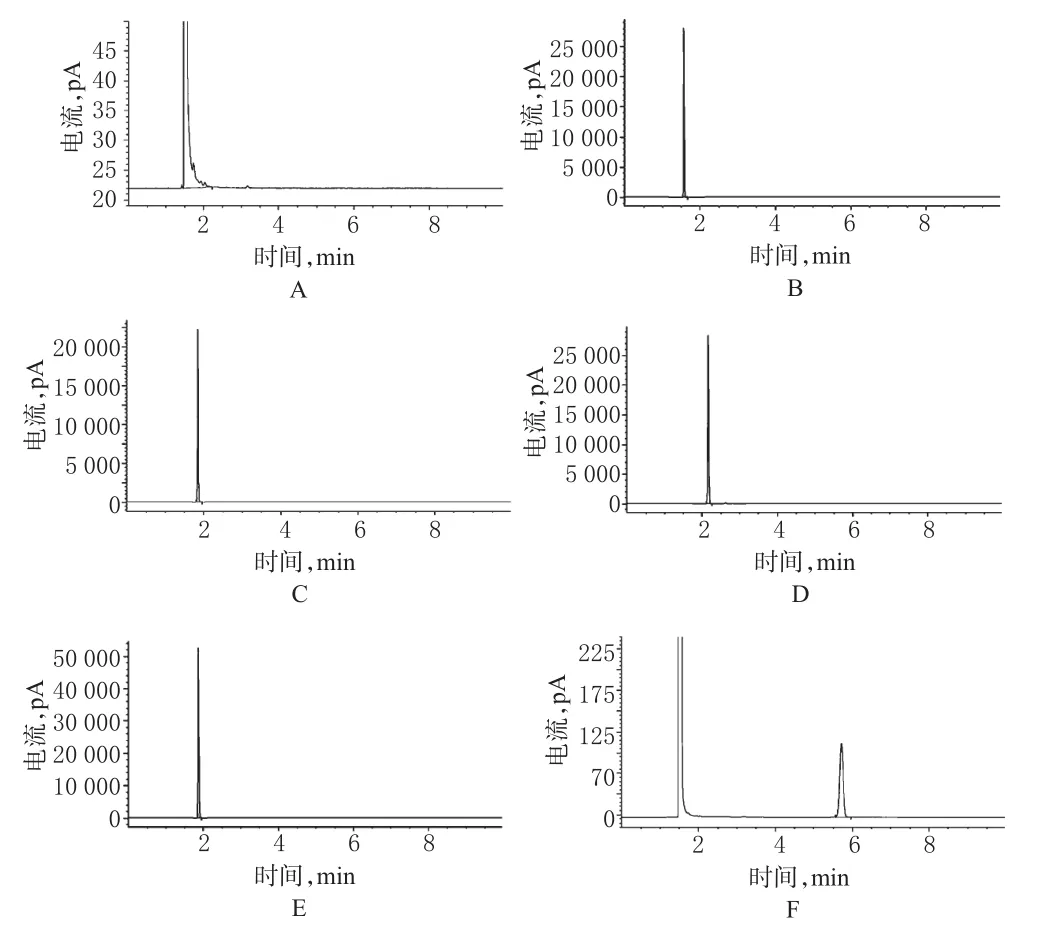
图2 残留溶剂检测气相色谱图A.甲醇;B.乙醇;C.丁醇;D.甲苯;E.苯;F.CMHFig2 GC chromatograms of residual solventsA.methanol;B.ethanol;C.butanol;D.toluene;E.benzene;F.N-(βchloroethyl)morpholine hydrochloride
以上试验表明,福尔可定、吗啡、可待因以及5种残留溶剂均不会干扰CMH的测定。在氧化、高温、光照破坏条件下,CMH与降解产物能够得到良好分离,故此有关物质检测方法专属性良好。
2.2.6 供试品溶液的稳定性。按“2.2.2”项下方法配制供试品溶液,分别于 0、2、4、6、8 h精密量取1.0 μl,直接进样,记录CMH的峰面积。结果,RSD=2.57%,表明供试品溶液在8 h内稳定。
2.2.7 线性范围的确定。分别精密量取CMH对照品贮备液1、2、4、5、7、10 ml置于50 ml量瓶中,用甲醇溶解并稀释至刻度,摇匀。分别按照“2.2.1”项下色谱条件进样测定,记录CMH的峰面积。将峰面积(y)与各自的质量浓度(x)作线性回归,并计算标准曲线方程,结果为y=645.37x+0.137 4(r=0.999 7),表明CMH检测质量浓度线性范围为0.010 1~0.100 9 mg/ml。
2.2.8 精密度试验。精密量取CMH对照品溶液1.0 μl,直接进样,连续测定6次。结果RSD=1.69%,表明本方法精密度较好。
2.2.9 重复性试验。按“2.2.2”项下方法配制6份供试品溶液,分别精密量取1.0 μl,直接进样。结果RSD=2.08%,表明本法重复性较好。
2.2.10 方法回收率试验。称取已知杂质含量的样品约0.5 g,精密称定,置于10 ml量瓶中,共9份,分别加甲醇使溶解,再分别精密加入CMH贮备液0.8、1.0、1.2 ml,各3份,再用甲醇稀释至刻度,摇匀。分别精密量取1.0 μl,直接进样,记录色谱图。按外标法计算回收率,结果见表3。
2.2.11 CMH定量限的测定。制备CMH对照品溶液,逐步进行稀释,然后进样,扫峰高为基线噪声的10倍计算,结果其定量限为 5.0 μg/ml。
表3 CMH回收率试验结果(n=9)Tab3 Results of recovery tests of CMH(n=9)
2.2.12 有关物质的测定结果。取6批样品,分别按照“2.2.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定,结果CMH含量分别为0.039%、0.040%、0.036%、0.028%、0.026%、0.029%,其中061101批样品色谱见图3。
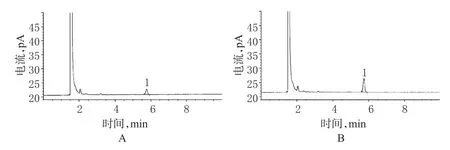
图3 有关物质CMH测定气相色谱图A.供试品;B.对照品;1.CMHFig3 GC chromatograms of related substance CMHA.test sample;B.control;1.CMH
3 讨论
(1)因没有市售的可待因对照品,笔者用磷酸可待因对照品代替可待因对照品,在计算可待因含量时应乘以换算系数0.753 4(299.36/397.36)。
(2)根据供试品实测结果及欧洲药典7.0版福尔可定原料药质量标准(吗啡≤0.2%,可待因≤0.2%,未知杂质≤0.1%,总杂质≤0.7%),同时根据2010年版《中国药典》福尔可定检查项下吗啡的杂质限度(吗啡≤0.1%)以及ICH指导原则相关内容,本着严格控制药品质量的目的,暂定本品的有关物质限度为吗啡不得过0.1%,可待因不得过0.2%,未知杂质不得过0.1%,总杂质不得过0.7%。
(3)根据供试品实测结果及ICH指导原则相关内容,福尔可定的最大日用量小于2 g,检定限度为0.10%,为了严格控制药品质量,暂定本品中的CMH限度为不得过0.10%。
[1]陈新谦,金有豫,汤光.新编药物学[M].16版.北京:人民卫生出版社,2007:427.
[2]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:1 092.
[3]欧洲药品质量委员会.欧洲药典7.0[S].法国:斯特拉斯堡,2010:2 724-2 725.
[4]周海钧.药品注册的国际技术要求:质量部分[M].北京:人民卫生出版社,2007:99-110.

