白藜芦醇对不同受体亚型MCF-7 细胞增殖的影响
王毅铮,高雅婷,胡 杰,高宏生,陈 虹
植物雌激素(phytoestrogen,PE)是指一类非甾族植物来源的具有雌激素活性的化合物,其通过与甾体雌激素受体以低亲和度结合而发挥弱的雌激素样效应[1]。体外实验证实,植物雌激素是一类生物活性较弱的雌激素[2],具有雌激素激动剂和阻断剂效应,对于与雌激素相关的疾病有较好的防治效果[3-6]。
白藜芦醇(resveratrol,RES)又名3,5,4'-三羟基二苯乙烯,是一种结构类似雌激素已烯雌酚(Diethy1-stilbestrol,DES)的天然多酚类化合物,其雌激素样作用目前倍受关注。Madsen[6]研究表明,植物雌激素与雌二醇(E2)竞争结合雌激素受体(ER)。E2的信号传导是由ER 介导的,而植物雌激素与ER 的作用方式是否与雌激素一致,尚无确切参考依据。本研究以白藜芦醇为对象,通过研究它对ER 及其所介导的细胞信号传导通路的影响,以讨论植物雌激素的作用机制,为防治更年期综合征等一系列激素缺乏性疾病提供理论依据。
1 材料与方法
1.1 实验细胞与试剂 人乳腺癌细胞MCF-7(ERα+/ERβ+)由武警后勤学院免疫教研室提供。白藜芦醇(纯度>95%)购于中国药品生物制品检定所,MTT、DMSO为美国Sigma 公司产品,RMPI1640、无酚红RMPI1640、胰蛋白酶为美国Gibco公司产品,活性碳-葡聚糖处理的胎牛血清(CDTFBS)为美国Hyclone 公司产品,抗体及二抗试剂盒购于北京中杉生物技术有限公司。
1.2 实验方法和步骤
1.2.1 细胞培养 细胞接种于含10%胎牛血清,100 U/ml 青霉素、100 μg/ml 链霉素的RPMI1640 培养液中,将培养瓶置于37℃、5%CO2饱和湿度培养箱培养,每1~2 d 换培养液1次。当细胞生长到足以覆盖瓶底壁的大部分表面时,用0.25%胰蛋白酶消化,传代。细胞于加药前2 d 换用无酚红RPMI1640 培养液(内含5%CDT-FBS)继续培养,以耗尽细胞内储存的雌激素。
1.2.2 MTT 实验 设溶剂对照组、正常MCF-7细胞组、ERα+ERβ--MCF-7(ERα+组)和ERα-ERβ+-MCF-7(ERβ+组)细胞组。取各组对数生长期细胞培养于96 孔培养板内,每孔100 μl(约含1000个细胞),置37℃,5% CO2温箱中培养。次日,MCF-7、ERα+和ERβ+各组细胞中加入终浓度为0.1 μmol/L 的白藜芦醇(依据前期实验测得0.1 μmol/L 白藜芦醇对MCF-7 细胞有较强的增殖活性[7]),每组至少设3个平行孔。溶剂对照组加入与给药组等体积的溶剂,继续培养。分别于加药后0~6 d 每天取一个96 孔板,弃培养液,每孔加50 μl浓度为1 mg/ml 的MTT 溶液(未加血清的无酚红RPMI1640 培养液配制)。37℃孵育4 h,弃上清,每孔加入DMSO 150 μl 溶解甲簪颗粒,轻度振荡使之溶解。用酶标仪,在检测波长490 nm 条件下测定光密度值(OD),以溶剂对照处理的细胞为对照组,用下面公式计算药物对细胞的增殖率:增殖率(%)=(给药组平均OD值-对照组平均OD值)/(对照组平均OD值)×100%。每一实验重复3次。
1.2.3 流式细胞术检测 取各组细胞1 ×106个,离心后去上清,PBS 洗涤一次。将细胞悬起,每管加70%冷乙醇约2 ml 固定,4°C 过夜。次日1000 r/min 离心5 min,去乙醇,PBS 洗涤2次,1000 r/min离心5 min,重复离心洗涤两次;将处理好的细胞经尼龙网过滤,PI 染色后在流式细胞仪上测定细胞凋亡率及细胞周期。
1.2.4 Western-blot 实验 各组细胞提取蛋白后,经100 g/L SDS-聚丙烯酰胺凝胶电泳分离电转移至PVDF 滤膜上。滤膜经室温封闭1 h 后,加入一抗4℃孵育过夜,再与HRP 标记的二抗室温温育1 h,漂洗后BAD 试剂盒显色。结果使用Bio-rad公司Quantity One 软件进行分析。
1.3 统计学处理 采用SPSS 11.0 统计软件进行统计学分析,实验数据均用±s 表示,应用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 白藜芦醇对不同ER 亚型MCF-7 细胞增殖活性的影响 0.1 μmol/L 白藜芦醇作用的各组细胞增殖活性较溶剂对照组明显增高,第5 天达峰值;与MCF-7组相比,不同亚型细胞的增殖活性表现为ERβ+<MCF-7<ERα+(表1)。同时应用流式细胞术检测0.1 μmol/L 白藜芦醇对各亚型细胞作用24、48 h 后各周期分布变化的情况发现,作用24 h 后ERα+细胞S 期比例较溶剂对照组和MCF-7组明显增加(P<0.05);ERβ+细胞G0/G1期比例较溶剂对照组和MCF-7组增加,且增加程度随时间延长而显著(P<0.05,表2)。
表1 白藜芦醇对各受体亚型MCF-7 细胞作用不同时间的增殖影响 (n=3;)

表1 白藜芦醇对各受体亚型MCF-7 细胞作用不同时间的增殖影响 (n=3;)
表2 白藜芦醇对各受体亚型MCF-7 细胞周期分布的影响 (n=3;;%)
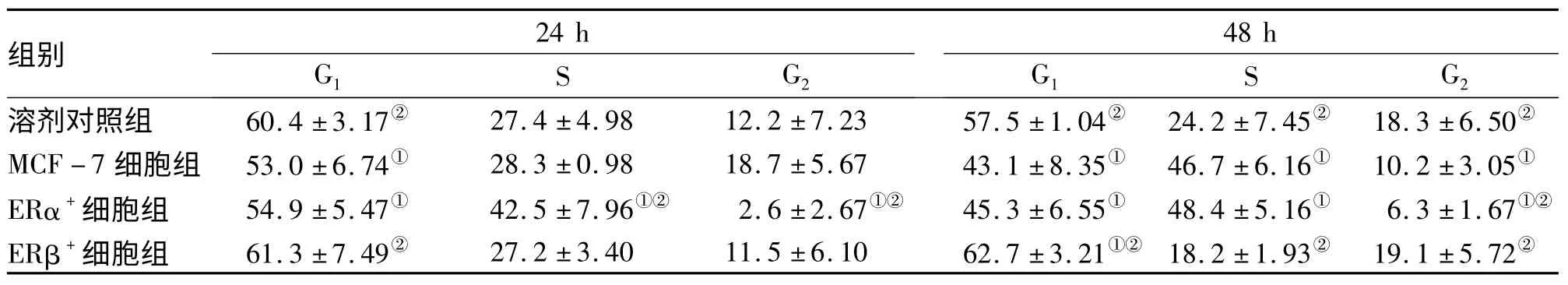
表2 白藜芦醇对各受体亚型MCF-7 细胞周期分布的影响 (n=3;;%)
注:与溶剂对照组比较,①P<0.05;与MCF-7 细胞组比较,②P<0.05
2.2 白藜芦醇对不同ER 亚型MCF-7 细胞信号通路相关蛋白表达的影响 0.1 μmol/L 白藜芦醇作用48 h 后,可明显提高ERα+细胞ERK 和AKT蛋白磷酸化程度,减少p38 磷酸化蛋白的表达(P<0.05);ERβ+细胞经白藜芦醇作用后其ERK 蛋白磷酸化明显减少,p38 蛋白磷酸化明显增加(P<0.05,表3),ERα+细胞组bcl-2 和caspase-3 蛋白表达较各组变化明显(P<0.05);ERβ+细胞中caspase-3蛋白表达较各组明显增高,差异有统计学意义(P<0.05,表3)。
表3 白藜芦醇对各受体亚型MCF-7 细胞相关蛋白表达的影响 (n=3;)

表3 白藜芦醇对各受体亚型MCF-7 细胞相关蛋白表达的影响 (n=3;)
注:与溶剂对照组比较,①P<0.05;与MCF-7 细胞组比较,②P<0.05
3 讨 论
ER 包括ERα、ERβ 两种亚型,含有6个功能区(A-F)。在体内ER 通常以异/同二聚体的形式发挥作用,两种亚型的氨基酸序列和基因序列有很高的同源性,但同时也有不同的转录激活功能[8,9]。ERα、ERβ 结构的不同决定了功能上的差异。
MTT 实验结果显示,经0.1 μmol/L 白藜芦醇作用后,各组细胞的增殖活性均高于溶剂对照组,说明白藜芦醇促细胞增殖作用明显;且ERα+细胞增殖活性高于MCF-7 细胞和ERβ+细胞,而ERβ+细胞增殖活性低于MCF-7 细胞,由此推测白藜芦醇可能通过作用于ERα 而发挥促增殖作用。由流式细胞术检测白藜芦醇对各组细胞周期分布情况的结果可见,白藜芦醇作用ERα+细胞后使其S 期比例明显增大;而与ERβ+细胞作用后G0/G1期比例明显增大,结合MTT 结果可推测,白藜芦醇促细胞增殖作用可能是与ERα 结合后增加了细胞DNA 合成;而其与ERβ 结合后,细胞周期阻滞于G0/G1期,降低了细胞的增殖活性。
以往研究认为,E2主要通过与细胞内受体结合,使受体发生变构后与相关基因结合,通过调节相关基因的表达而实现其功能,这就是传统上所谓的雌激素作用机制。雌激素还具有非基因组作用机制,该机制多与胞质内蛋白激酶系统的激活等有关。有研究发现,E2能够通过ERα 瞬时激活P38/MAPK、ERK/MAPK 和P13/AKT 通路。ERK/MAPK和P13/AKT 的磷酸化可以协同提高bcl-2 的表达水平,从而减少在P38/MAPK 激活过程中损失的Ca2+水平[10];而在ERβ 存在的情况下,E2则只能持续激活P38/MAPK,并促进caspase-3 的激活[11]。由western-blot 结果推测,白藜芦醇可通过MAPK 和P13/AKT 通路与ER 结合来调节细胞增殖活性,同时也能通过调节下游关键因子bcl-2 和caspase-3表达而影响细胞增殖。
笔者前期实验证实,低浓度白藜芦醇有促MCF-7细胞增殖的作用[7],由本研究结果推测可能是其与细胞内ERα 结合共同作用的结果。进而可推测低浓度白藜芦醇与ERα 亲和力较强,当与ERα结合后,可激活MAPK 和Akt,同时上调bcl-2 并下调caspase-3 蛋白表达水平,发挥其促增殖作用。白藜芦醇与ERβ 结合后对细胞作用则相反。由此可见,白藜芦醇对MCF-7 细胞的双相调节作用与ER 不同亚型亲和力有关。这也为今后开发针对激素依赖性疾病用药提供了一定的理论依据。
[1]孟庆书,何 平,朱晓燕,等.植物雌激素的作用机制[J].生命的化学,2007,27(2):141-143.
[2]Al-Azzawi F,Wahab M.Effectiveness of phytoestrogens in climacteric medicine[J].Ann N Y Acad Sci,2010,1205(9):262-267.
[3]关 铮,李亚里.雌激素受体亚型与子宫内膜异位症相关性研究进展[J].武警医学,2008,19(4):353-355.
[4]陈 怡,李 明,王庆山.白黎芦醇对中枢神经系统保护作用的研究进展[J].武警医学,2006,17(10):780-782.
[5]Sassarini J,Lumsden M A.Hot flushes:are there effective alternatives to estrogen?[J].Menopause Int,2010,16(2):81-88.
[6]Madsen S.Phytoestrogens and menopausal symptoms[J].Tidsskr Nor Laegeforen,2009,129(21):2238-2239.
[7]Wang Yizheng,Cao Bo,Li Shaoxiong,et al.Effect of proliferation,cell cycle,and Bcl-2s of MCF-7 cells by resveratrol [J].J Asian Nat Prod Res,2009,11(4):378-388.
[8]闫大晶,王宏宾,吴 倩,等.雌、孕激素受体蛋白在子宫肉瘤中的表达及其相关性研究[J].武警医学,2012,23(8):682-685.
[9]Huang G S,Arend R C,Li M,et al.Tissue microarray analysis of hormonal signaling pathways in uterine carcinosarcoma[J].Am J Obstet Gynecol,2009,200(4):457.
[10]Song Y S,Park H J,Kim S Y,et al.Protective role of Bcl-2 on β-amyloid-induced cell death of differentiated PC12 cells:Reduction of NF-kB and p38 MAP kinase activation[J].Neurosci Res,2004,49:69-80.
[11]Acconcia F,Totta P,Ogawa S,et al.Survival versus apoptotic 17β-estradiol effect:role of ERα and ERβ activated non-genomic signaling[J].J Cell Physiol,2005,203:193-201.
- 武警医学的其它文章
- 脑室-腹腔分流术后感染6例

