蛇床子素对体外培养大鼠股骨组织代谢活性的影响
周 建,葛宝丰,甄 平,马小妮,闫丽娟,郭晓宇,成 魁,高玉海,石文贵,陈克明
中国人民解放军兰州军区兰州总医院骨科研究所,兰州 730050
蛇床子是伞形科植物蛇床的果实,中医认为其具有温肾助阳、祛风燥湿、杀虫止痒之功效。明磊国等[1-3]研究显示蛇床子素能促进体外培养骨髓间充质干细胞成骨性分化,以及促进成骨细胞的矿化成熟和抑制破骨细胞吸收活性,因此推测蛇床子素具有促进骨代谢的活性作用,但是缺少体内和更接近体内药物代谢的实验依据,因为药物在体内对骨骼调节是一个针对成骨、破骨、骨髓间充质和骨细胞的复合体,本研究应用体外大鼠股骨组织培养模型,此模型具有实验简单和药物代谢过程更接近体内药物代谢的过程,因此本研究以雌二醇为阳性对照药物从组织水平探讨蛇床子素对体外培养股骨组织代谢活性的影响。
材料和方法
材料 实验动物SPF级SD大鼠[甘肃省中医学院动物实验中心,合格证号SCXK(甘)2010-0006-152]。胎牛血清 (兰州民海生物公司);DMEM培养基、Ⅱ型胶原酶 (Gibco公司,美国);总RNA提取裂解液 Reagent kit、Prime ScriptTM SYBR®Premix Ex TaqTMⅡPCR扩增试剂盒 (大连宝生物公司);青霉素、链霉素、胰蛋白酶 (Sigma公司,美国);2,2-联喹啉-4,4-二甲酸二钠,蛋白定量试剂盒 (武汉博士德生物工程有限公司);碱性磷酸酶测定试剂盒(南京建成生物工程研究所);钙含量测定试剂盒(BioVision,美国);蛇床子素雌二醇为中国药品生物制品检定所提供的对照品 (纯度>99%);其余试剂均为分析纯。
大鼠股骨组织的培养 实验大鼠购于甘肃省中医学院动物实验中心,取1月龄 (80±5)g SD雄性大鼠6只,处死后放入75%酒精浸泡10 min,取股骨,去除肌肉、血管及结缔组织,用无菌PBS冲洗骨髓腔,弃掉骨髓,然后将股骨剪成约1 mm3的骨片,PBS反复冲洗骨片,弃掉冲洗液后,然后0.25%的胰蛋白酶消化10 min,彻底去除软组织,弃掉消化液,然后用无菌PBS漂洗两次,用含有10%胎牛血清的DMEM(4.5 g/L葡萄糖)培养液37℃、5%CO2培养箱中培养,每3天换液1次,具体培养方法参考文献 [4]。
最佳药物浓度筛选 在股骨组织培养48 h后采用不同浓度 (1×10-4~1×10-8mol/L)雌二醇和蛇床子素分别处理体外培养的大鼠股骨组织,在药物处理后第9天PBS漂洗骨片,加入1.5 ml组织裂解液(50 mmol/L Tris-HCl,pH 7.2、150 mmol/L NaCl、100 mg/L苯甲基磺酰氟、1 mg/L抑蛋白酶肽、1%Tween-100、0.5%去氧胆酸钠),用匀浆器匀浆股骨组织成乳液状,然后超声处理15 s,低温静置30 min后1000 r/min离心5 min(转子半径6 cm),弃掉沉淀,Bradford法测定蛋白浓度,具体操作严格按照说明书进行,制作标准曲线,计算样品中蛋白浓度,然后取相同质量的总蛋白分别测定各组碱性磷酸酶 (alkaline phosphatase,ALP)活性,ALP活性测定按试剂盒说明书进行,每组分别按缓冲液∶基质液=1∶1加入充分摇匀;37℃水浴15 min,加入3倍于基质液显色液,充分混匀显色后,测定502 nm处吸光度值,经过计算换算ALP活性 (U/g蛋白)[5],每个浓度3次平行实验,每次6个重复。
分组处理 在骨组织培养48 h后,随机编号分为3组,分别为含终浓度为1×10-5mol/L蛇床子素组、含终浓度为1×10-8mol/L雌二醇组和对照组。
ALP活性测定 在加药后的第3、6、9、12、15和18天PBS漂洗骨片,方法同最佳药物浓度筛选和ALP活性的测定方法。
钙含量测定 体外培养的股骨组织加蛇床子素处理后的第3、6、9、12、15和18天,PBS漂洗骨片,然后将骨片放入烘箱中100℃烘烤48 h,烘烤后称量其干重。再向骨片中加入1 ml 1 mol/L的盐酸匀浆,用匀浆器匀浆股骨组织后振荡过夜,消化液1000 r/min离心5 min(转子半径6 cm)取上清液。测定钙盐含量,样本测定按照说明书操作步骤进行。每孔加入50 μl上清液,然后样本及标准孔加入90 μl的显色基质液,充分混匀后加入60 μl的钙含量分析缓冲液,室温下反应10 min,570 nm处测定吸光度值。制作标准曲线,依据标准曲线计算样本中钙含量,结果表示为:测定匀浆中钙的总质量/烘干后大鼠股骨组织的质量。
基因表达水平分析
总RNA提取:骨片在蛇床子素处理培养后的第3、6、9、12、15和18天后弃培养液,无酶PBS漂洗2次,加入1 ml总RNA提取裂解液,裂解匀浆骨片,收集匀浆液,1000 r/min离心5 min,取上清液加入200 μl氯仿4℃ 12 000 r/min离心15 min(转子半径1.5 cm),取上清液加入等体积的异丙醇静置15 min,4℃12 000 r/min离心15 min(转子半径1.5 cm)弃上清液,75%乙醇重悬浮沉淀4℃ 12 000 r/min离心5 min(转子半径1.5 cm),弃上清后-70℃保存,琼脂糖凝胶电泳检测RNA完整性,在230、260、280和320 nm处测定吸光度值,调整总RNA的浓度。
逆转录:使用Prime ScriptTMreagent Kit(TakaRa Code:DRR037A)反转录试剂盒合成反转录出第一条cDNA链。反应体系:5×逆转录缓冲液4 μl,逆转录酶1.0 μl,多聚 T 引物 (50 μmol/L)1.0 μl,随机引物(100 μmol/L)1.0 μl,总 RNA 10 μl(1000 ng)补无酶水至20 μl。37℃反应15 min,85℃ 5 s,-20℃保存。
引物设计:根据实验要求,在GenBank查询所需要基因的目的序列mRNA序列,引物均由宝生物 (大连)公司根据序列设计并合成。人类相关转录基因2:NM_053470.1上游引物5’-GCACCCAGCCCATAATAGA-3’,下游引物 5’-TTGGAGCAAGGAGAACCC-3’,产物长度165 bp;核因子κB受体活化因子配体:NM_053356上游引物 5’-TTCCCGGTGAATTCGGTCTC-3’,下游引物 5’-ACCTCGGATTCCAATAGGACCAG-3’,产物长度107 bp;骨保护素 (osteoprotegerin,OPG):NM_057149.1上游引物5’-GCAGCATCGCTCTGTTCCTGTA-3’,下游引物 5’-GCATGAGTCAGGTAGTGCTTCTGTG-3’,产物长度164 bp;GAPDH:NM_017 008.3上游引物5’-GGCACAGTCAAGGCTGAGAATG-3’,下游引物 5’-ATG GTGGTGAAGACGCCAGTA-3’,产物长度143 bp。
PCR反应体系:为20 μl,包括:SYBR Premix Ex Taq TMⅡ (2 × )10 μl; 上游引物(10 μmol/L)0.8 μl;下游引物 (10 μmol/L)0.8 μl;ROX参照荧光 (50×)0.4 μl;cDNA 模板 2 μl;dH2O 6 μl。反应条件:95 ℃预变性30 s;95℃变性5 s,60℃退火31 s,进行40个循环,每个循环收集荧光信号。随后缓慢升温,95℃15 s,60℃ 1 min,95℃ 15 s,温度变化速度为0.1℃/s,绘制PCR产物的溶解曲线,了解扩增的特异性。
实时荧光定量RT-PCR数据分析:采用△△Ct处理数据,2-△△Ct表示数据的结果,具体方法参考文献 [6]。
统计学处理 所有统计分析均采用SPSS 13.0统计软件完成,结果以均数±标准差表示。首先用方差分析检验各组间差异是否具有统计学意义,当差异具有统计学意义时,用多参数t-检验验证各均数间差异是否具有统计学意义。P<0.05为差异具有统计学意义。
结 果
最佳药物浓度 最佳的药物浓度为:蛇床子素1×10-5mol/L、雌二醇1×10-8mol/L(图1)。
蛇床子素对ALP活性的影响 蛇床子素组和雌二醇组ALP活性第3~9天呈升高趋势,第9~18天降低,第9天达到最高;与对照组相比,蛇床子素组和雌二醇组在第3、6和9天显著高于对照组 (P<0.01);但在第12、15和18天时,蛇床子素组和雌二醇组ALP活性与对照组相比差异无统计学意义(P>0.05)(图2)。
蛇床子素对钙盐沉积量的影响 第3、6、15、18天蛇床子素组和雌二醇组钙盐含量显著高于对照组(P<0.05,P<0.01),第12天显著低于对照组(P<0.01),第9天3组比较差异无统计学意义 (P>0.05)(图3)。
成骨性基因表达 蛇床子素组和雌二醇组第3~6天逐渐升高,第6~18天逐渐降低,第6天时达到最高。蛇床子素组和雌二醇组在处理股骨组织第3、6、9和15天时显著促进Runx-2 mRNA的表达 (P<0.05,P<0.01),处理第12天时显著抑制 Runx-2 mRNA的表达 (P<0.01)(图4)。

图1 用碱性磷酸酶活性筛选最佳的药物浓度Fig 1 The optimal doses of osthole and estradiol were screened based on alkaline phosphatase activity

图2 药物处理股骨组织3、6、9、12、15和18 d碱性磷酸酶活性测定Fig 2 The alkaline phosphatase activity was measured 3,6,9,12,15,and 18 day after drug treatment

图4 蛇床子素和雌二醇对股骨组织人类相关转录基因-2 mRNA的表达Fig 4 The Runx-related gene-2 mRNA expression in femur tissues after osthole and estradiol treatment
蛇床子素组和雌二醇组在处理股骨组织第3、9、15天时显著促进OPG mRNA的表达 (P<0.05,P<0.01),在第6和12天时能显著抑制OPG mRNA的表达 (P<0.05)(图5)。
蛇床子素组和雌二醇组在处理股骨组织第6和9天时能显著促进核因子κB受体活化因子配体 mRNA的表达 (P<0.01),第3、12、15和18天时能显著抑制核因子κB受体活化因子配体mRNA的表达 (P<0.05,P <0.01)(图6)。
蛇床子素组和雌二醇组在处理股骨组织第6和15天时能显著促进骨形态发生蛋白-2 mRNA的表达 (P<0.01),第9和12天时能显著抑制骨形态发生蛋白-2 mRNA的表达 (P<0.01)。蛇床子素组在第3和18天时与对照组比较差异无统计学意义 (P>0.05)。雌二醇组处理第18天时能显著抑制骨形态发生蛋白-2 mRNA的表达 (P<0.05),第3天时与对照组比较差异无统计学意义 (P>0.05)(图7)。

图5 蛇床子素和雌二醇对股骨组织骨保护素mRNA的表达Fig 5 The osteoprotegerin mRNA expression in femur tissues after osthole and estradiol treatment

图6 蛇床子素和雌二醇对股骨组织核因子κB受体活化因子配体mRNA的表达Fig 6 The receptor activator of nuclear factor-κB ligand mRNA expression in femur tissues after osthole and estradiol treatment
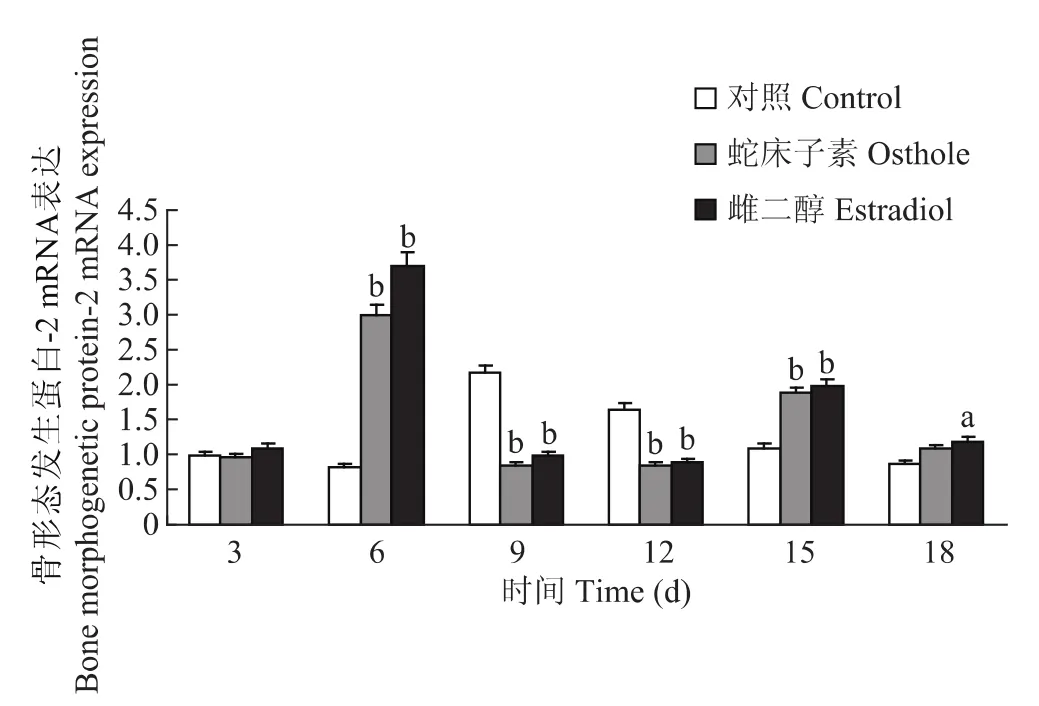
图7 蛇床子素和雌二醇对股骨组织骨形态发生蛋白-2 mRNA的表达Fig 7 The bone morphogenetic protein-2 mRNA expression in femur tissues after osthole and estradiol treatment
讨 论
有报道终浓度为1×10-5mol/L蛇床子素能促进骨髓间充质细胞成骨性分化[1],抑制破骨细胞的成熟[2-3]。本研究在已有的股骨组织体外培养模型的基础上[4],应用骨组织体外培养模型进行蛇床子素体外代谢活性研究,此模型快速、简便,实验结果接近体内试验结果。目前研究比较清楚的雌二醇具有抗骨质疏松作用,因此本研究以雌二醇为阳性对照药物,通过检测各项指标,确保股骨组织体外培养模型的可行性和恰当性。在体外培养的股骨组织水平筛选了最佳的药物浓度,蛇床子素和雌二醇的最佳浓度分别为1×10-5mol/L和1×10-8mol/L,本研究采用终浓度为1×10-5mol/L蛇床子素对体外培养大鼠股骨组织进行干预,以研究蛇床子素对体外培养的大鼠股骨组织骨形成活性的调节,检测蛇床子素处理后股骨组织中ALP的活性、钙含量以及骨形成活性的相关基因的表达。
ALP的活性是检测成骨细胞早期分化的标志性指标以及骨形成活性的标志性指标[7],有研究显示蛇床子素和雌二醇能显著促进体外培养成骨细胞ALP活性[1]。本研究显示蛇床子素组和雌二醇组的ALP活性从第3~9天显著高于对照组,第12天活性降低,这可能与ALP是一个骨形成的早期指标有关。钙盐是骨骼的主要成分,因此钙盐的沉积量也就成了衡量骨代谢活性的一个重要指标,本研究观察了蛇床子素和雌二醇对体外培养股骨组织钙含量的影响,在体外培养股骨组织第3天时钙的沉积达到最高,从第6~18天蛇床子素处理组钙含量基本保持在一个相对恒定的水平,但第9和12天之间钙盐是一个关键的时间点钙盐,蛇床子素先是促进Ca的沉积,到抑制钙盐沉积,再到第15天时促进钙盐沉积,因此笔者推测蛇床子素能维持骨骼的代谢活性处在一个相对稳定的水平,但促进Ca的沉积存在时效关系。
骨骼的代谢过程受到多种基因和蛋白的调控,因此本研究检测不同时间点体外培养股骨组织中Runx-2、RANKL、OPG、BMP-2 mRNA含量的水平,以期望从基因水平检测蛇床子素对体外培养股骨组织代谢活性的影响差异。其中,Runx-2是一个重要的成骨的转录因子,在骨代谢活性中发挥重要作用[8]。本研究显示蛇床子素和雌二醇能促进Runx-2的表达,但是先是升高之后降低;RANKL和OPG是一对骨形成与骨吸收的关键性基因,但OPG升高时骨形成大于骨吸收,当RANKL升高时骨吸收大于骨形成[9-12],本研究表明蛇床子素和雌二醇在体外培养股骨组织先是抑制、之后促进、然后又抑制RANKL mRNA表达水平的过程,蛇床子组对OPG mRNA表达水平先是促进、之后抑制、然后促进,表明蛇床子素和雌二醇对体外培养先是促进骨形成、然后促进骨吸收、然后促进骨形成的过程,因此可能是蛇床子素促进骨形成和骨吸收存在一个时效关系。BMP-2作为骨代谢活性的一个重要的活性因子[13],结果表明BMP-2的表达水平先升高、然后逐渐降低、又升高,进一步表明蛇床子素和雌二醇对骨形成调节存在一个时效关系。
本研究在组织水平上探讨蛇床子素对体外培养的股骨组织活性的影响,通过对不同时间点ALP活性、钙含量骨代谢相关基因表达水平检测,证明蛇床子素能调节体外培养的股骨组织的骨代谢活性,综合各项检测指标,蛇床子素能调节体外培养股骨组织的代谢活性,但是各项指标表明在药物处理后的第9和12天是蛇床子素调节骨形成和骨吸收的一个关键时间点,即蛇床子素调节骨代谢存在一个时效效应。有关蛇床子素对体外培养大鼠股骨组织代谢活性调节的研究报道较少,因此本研究在组织水平为蛇床子素调节骨代谢活性提供了一定的实验证据。
[1]明磊国,葛宝丰,陈克明,等.蛇床子素对体外培养骨髓基质干细胞增殖与成骨性分化的影响 [J].中国药理学通报,2010,28(6):1098-1103.
[2]明磊国,王鸣刚,陈克明,等.蛇床子素对体外培养破骨细胞骨吸收及细胞凋亡的影响[J].药学学报,2012,47(2):174-179.
[3]明磊国,王鸣刚,陈克明,等.蛇床子素对体外培养成骨细胞成骨相关因子表达的影响[J].中药药理与临床,2011,27(2):54-56.
[4]Masayoshi Y,Reiko H,Satoshi U,et al.Effects of flavonoid on calcium content in femoral tissue culture and parathyroid hormone-stimulated osteoclastogenesis in bone marrow culture in vitro[J].Mol Cell Biochem,2007,303(1-2):83-88.
[5]Ying LL,Masayoshi Y.Phytocomponent p-hydroxycinnamic acid stimulates bone formation and inhibits bone resorption in rat femoral tissues in vitro[J].Mol Cell Biochem,2006,292(1-2):45-52.
[6]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod [J].Methods,2001,25(4):402-408.
[7]Cane V,Botti P,Soana S.Pulsed magnetic fields improve osteoblast activity during the repair of an experimental osseous defect[J].J Orthop Res,1993,11(5):664-670.
[8]Sun DM,Liu ZhB,Zhao Y,et al.Runx2 is involved in regulating osterix promoter activity and gene expression [J].Prog Biochem Bioph,2006,33(10):957-964.
[9]Tanaka S,Nakamura I,Inoue J,et al.Signal transduction pathways regulating osteoclast differentiation and function[J].J Bone Miner Metab,2003,21(3):123-133.
[10]Yip KH,Zheng MH,Steer JH,et al.Thapsigargin modulates osteoclastogenesis through the regulation of RANKL-induced signaling pathways and reactive oxygen species production[J].J Bone Miner Res,2005,20(8):1462-1471.
[11]Mirosavljevic D,Quinn JM,Elliott J,et al.T-cells mediate an inhibitory effect of interleukin-4 on osteoclastogenesis[J].J Bone Miner Res,2003,18(6):984-993.
[12]Tsuda E,Goto M,Mochizuki S,et al.Isolation of a novel cytokine from human fibroblasts that specifically inhibits osteoclastogenesis [J].Biochem Biophys Res Commun,1997,234(1):137-142.
[13]林佳声,赵承斌.BMP/bFGF对关节软骨损伤修复的作用[J].中国伤残医学,2009,17(2):131-133.

