胸腺上皮性肿瘤WHO简化病理分型的MSCT表现
陈 凯 路 莉 徐 凯 王佳丽 鹿彩銮 韩曙光 荣玉涛
胸腺上皮性肿瘤(thym ic epithelial tumors,TET)包括胸腺瘤和胸腺癌,均起自胸腺上皮组织,存在多种组织学特性及生物学行为,是前纵隔最常见的肿瘤。因病理类型不同,TET的治疗与预后存在较大差异。Jeong等[1]根据2004年修订的WHO分类法,将TET组织学分型简化为低危型胸腺瘤、高危型胸腺瘤及胸腺癌。术前诊断对于治疗方法的选择及预后有重要意义。本文对本院收治的40例病理证实为TET的MSCT中多个影像征象进行回顾性分析,旨在探讨其与WHO简化病理分型的相关性。
方 法
1.临床资料
收集徐州医学院附属医院2009年5月至2012年4月经手术病理证实、资料完整的TET患者40例,男22例,女18例,年龄20~78岁,平均53±12.16岁,其中28例有临床症状,包括重症肌无力8例,胸痛15例,咳嗽、咳痰23例,呼吸困难或活动后憋喘20例,体检意外发现12例。
2.组织学分型
以2004年WHO胸腺上皮肿瘤组织病理学分型标准分为胸腺瘤5种亚型(A、AB、B1、B2和B3)及胸腺癌为基础,根据Jeong等[1]研究将其简化为低危组胸腺瘤(A、AB、B1),高危组胸腺瘤(B2、B3)及胸腺癌。
3.检查方法
所有病例均采用GE Light speed 16层多排螺旋CT机作容积扫描,范围自双肺尖至双肋膈角水平,扫描电压130kV,电流150m As,增强扫描采用非离子对比剂优维显(30g/100ml),以高压注射器经肘静脉团注,剂量1.5ml/kg,流速3ml/s,增强后行两期扫描,第一期扫描延迟时间30s,第二期70s,原始图像再以1.3mm层厚减薄后上传至GE ADW 4.5工作站进行MPR后处理观察。
4.观察内容
由2名有经验的放射科医师在不知病理结果的情况下对全部患者的MSCT表现进行回顾性分析,两人意见一致的情况下做出结论,其分析要点包括:肿瘤形态(规则、不规则)、边缘(光整、不光整),纵隔脂肪线:肿瘤与纵隔大血管之间的低密度透亮线(消失或模糊、存在),有无钙化及增强后肿瘤内的密度(均匀、不均匀),以及是否存在胸膜病变,纵隔淋巴结及远处转移。本组病例中采用测量肿瘤体积[2]代替肿瘤长短径,测量方法:利用MSCT 的MPR技术分别于冠状位、矢状位及横断位测量肿瘤的最大直径后算出半径代入公式:4/3×π×半径r(冠状位)×r(矢状位)×r(横断位)得出体积,肿瘤最大直径均测量次后取平均值。所有病例均获得手术病理证实。
5.统计学处理
应用SPSS 16.0统计软件进行统计学分析。三组间肿瘤体积、患者年龄的比较采用单因素方差分析;患者性别、肿瘤形态和边缘、纵隔脂肪线、钙化、强化后密度差异以及胸膜病变、纵隔淋巴结及远处转移的比较均采用卡方检验,P<0.05为差异有统计学意义。
结 果
40例患者中,低危组15例(A型4例,AB型8例,B1型3例),高危组11例(B2型4例,B3型7例);胸腺癌(14例)。MSCT表现及MPR图像与WHO简化病理分型各型之间的差异性见表1。
患者的性别和年龄在三组间差异均无统计学意义(P值分别为0.162和0.528)。各组肿瘤的体积分别为:低危型胸腺瘤(87.88±163.30)cm3,高危组胸腺瘤(132.75±163.90)cm3及胸腺癌(247.38±342.87)cm3,三组间肿瘤体积差异无统计学意义(F=1.612,P=0.214)。高危组胸腺瘤及胸腺癌在肿瘤周围纵隔脂肪线的显示、肿瘤形态、边缘、强化后瘤内密度及是否合并胸膜病变均与低危组胸腺瘤有明显统计学差异,其MSCT表现为肿瘤形态不规则,边缘不光整且肿瘤与邻近纵隔大血管间的纵隔脂肪线模糊/消失,强化后肿瘤内部密度不均匀,并且可以合并胸腔积液或者胸膜增厚(图1~3)而高危型胸腺瘤与胸腺癌两组间在以上M SCT征象的比较中无统计学差异(P值分别为0.819、0.674、0.113、1.000、0.416),而胸腺癌的纵隔淋巴结及远处转移较高危组胸腺瘤多见(P=0.005)(图4)。三组间肿瘤内部是否存在钙化则无统计学差异(P=0.132),然而高危组胸腺瘤及胸腺癌的钙化位置多位于肿瘤内部的非边缘部位(4/7),低危组胸腺瘤钙化多位于肿瘤边缘(5/8),典型可表现为蛋壳样(图5,6)。
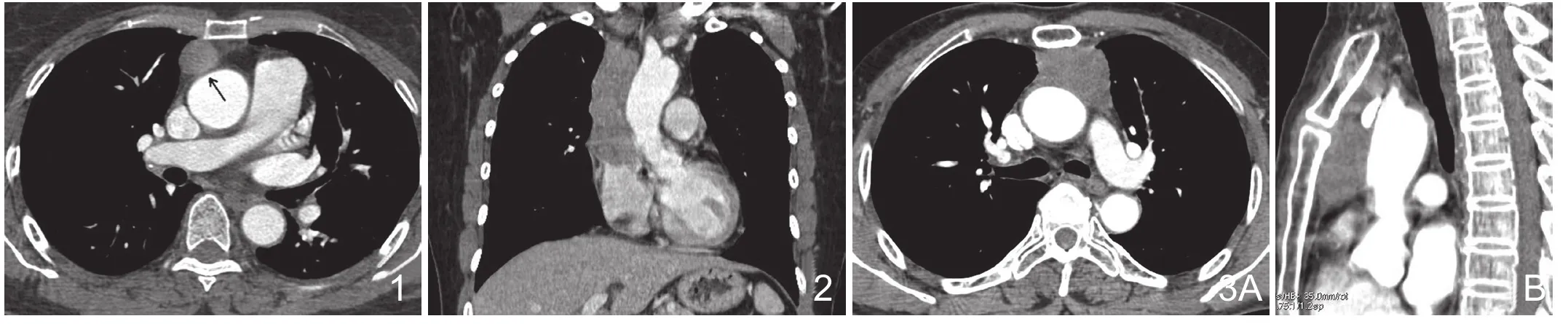
图1 男,42岁,无明显临床症状,A型胸腺瘤(低危型)。CT增强横断面显示前纵隔结节灶,边缘光整,形态规则且强化后密度均匀,纵隔脂肪线清晰(黑箭)。图2 男,56岁,胸痛1月余,B3型胸腺瘤(高危型)。冠状位增强MPR显示前纵隔偏右侧软组织密度影,形态不规则,边缘不光整,纵隔脂肪线消失。图3 女,62岁 胸闷、胸痛2月余,胸腺癌。横断位及矢状位MPR可见前纵隔不规则软组织密度影,沿前纵隔间隙呈铸形生长,与周围组织分界不清且纵隔脂肪线消失。

图4 男,68岁 呼吸困难1月余,胸腺癌。前纵隔偏右侧团块状软组织密度影,强化密度不均匀,局部压迫上腔静脉且纵隔脂肪线模糊(白箭),纵隔内可见多发增大淋巴结(黑箭)。图5 男,77岁,咳嗽2月余,B1型胸腺瘤(低危型胸腺瘤)。前纵隔团块状软组织密度影,形态规则,病灶边缘可见蛋壳样钙化(白箭)。图6 女,50岁,胸痛胸闷1月余,胸腺癌。前纵隔不规则软组织密度影,与周围组织分界不清,肿瘤内部可见斑片状钙化(黑箭)及纵隔内增大淋巴结(白箭)。图7 女,49岁,上眼睑下垂2月余,AB型胸腺瘤(低危型胸腺瘤)。纵隔右侧可见团块状软组织密度影,边缘光整,凸向右侧胸腔,手术中可见一细蒂与纵隔胸腺区相连(白箭)。
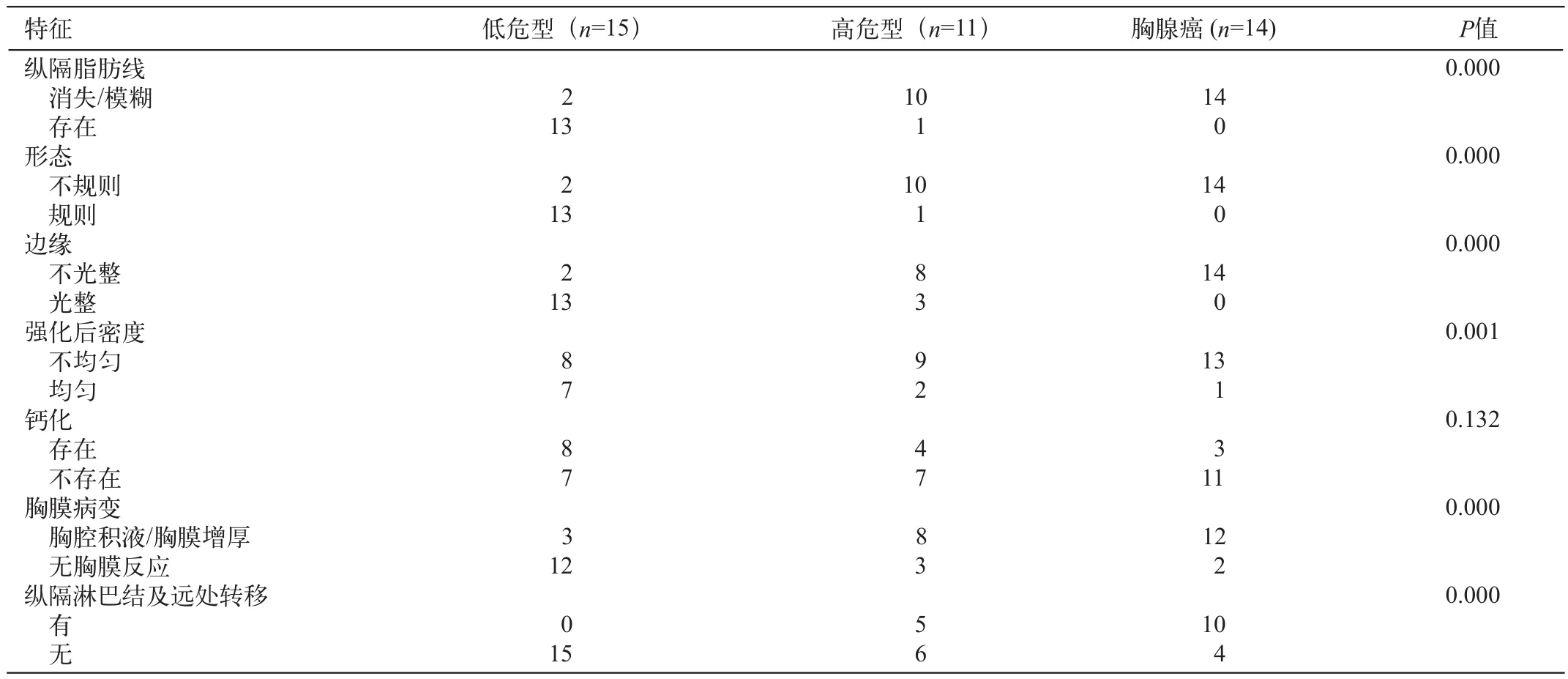
表1 MSCT表现与WHO简化病理分型之间关联性
讨 论
胸腺上皮性肿瘤在前纵隔肿瘤中所占比例最大,约占成人纵隔占位的20%[3]。现阶段使用的胸腺上皮性肿瘤WHO组织学分类制订于1999年,修订于2004年,其各亚型的CT表现已有报道,但是研究认为CT对各亚型的鉴别作用较局限[1,4-6],同时有文献[7-8]报道称肿瘤复发很少发生于完全手术切除的A、AB及B1型胸腺瘤,且术后生存率上也明显高于B2、B3型胸腺瘤患者;而B2、B3型胸腺瘤则在完全切除后还需进行辅助放疗;胸腺癌的侵袭性则高于各型胸腺瘤。Jeong等[1]则根据肿瘤侵袭性和复发将TET分为低危型胸腺瘤(A、AB、B1)、高危型胸腺瘤(B2、B3)及胸腺癌。肿瘤的完全切除是TET的主要治疗方法,研究表明[9]多模式的治疗包括术前新辅助化疗、外科手术切除及术后辅助放化疗可以提高局部侵袭性肿瘤患者的生存率,而新辅助治疗能够增加手术治疗的可能性以及提高完全切除肿瘤的概率,其中高危组胸腺瘤和胸腺癌可被选择进行术前新辅助治疗;有文献[10]报道称在不完全切除的B2、B3型胸腺瘤患者中如果接受了辅助放化疗,肿瘤复发率约为34%,而不接受辅助放化疗的患者则约为78%。MSCT扫描及多平面重组(MPR)技术克服了单纯轴位图像导致的诊断信息不足,可以清楚显示肿瘤的生长特征,本研究表明其对低、高危型胸腺瘤及胸腺癌之间的鉴别诊断有重要意义。
本组病例中,低危型胸腺瘤多表现为圆形或类圆形实质性肿块,形态规则,边缘光整,一般坏死囊变少见,增强后瘤内强化密度均匀且与周围组织分界清楚,肿瘤与纵隔大血管之间纵隔脂肪线清晰。而高危型胸腺瘤与胸腺癌在MSCT表现上均具有恶性肿瘤的影像特征,表现为肿瘤形态不规则且可呈分叶状改变,边缘不光整,纵隔脂肪线模糊和(或)消失,增强后瘤内强化密度不均,可出现囊变、坏死。
有学者[11]采用肿瘤最长径在三组间比较,而Tom iyama等[4]发现,肿瘤的大小(长短径)在胸腺瘤的分类中无明显作用;在低危型与高危型胸腺瘤中比较两组间肿瘤最长径(小于6cm,大于6cm)对随访五年生存率无明显差别。本组病例中采用肿瘤体积算法[2]发现三组之间无统计学差异,可能原因为部分低危型胸腺瘤可向胸腔内生长,压迫症状轻,发现时体积已较大(图7)。
既往文献对肿瘤内钙化是否对诊断有帮助意见尚不统一,有文献[12]报道称侵袭性胸腺瘤中钙化发生率较高,并且常发生于B型胸腺瘤。而另有学者[13]发现TET的钙化发生率在低、高危型胸腺瘤中差异不明显,并且瘤内是否有钙化对患者的预后影响不大。本组病例中,三组间钙化发生率没有统计学差别,但低危型胸腺瘤钙化位置多为肿瘤边缘部分,典型者可呈蛋壳样。而高危型胸腺瘤及胸腺癌钙化多发生于肿瘤非边缘部位,可呈多种形态。
国内学者杨艳等[14-15]报道肿瘤强化幅度≤20Hu多为A、AB型,而幅度>20Hu多为B、C型胸腺瘤,两者之间有显著差异;而TET恶性程度越高,其内部低密度区的范围更大[12]。本组病例测量肿瘤实质部分强化的CT值由于部分病例瘤内密度不均且区域形态不规则,实际工作中统一测量范围较为困难,因此笔者认为测量高危型胸腺瘤及胸腺癌的强化CT值可操作性较差。然而,增强后表现为不均匀强化多见于高危型胸腺瘤和胸腺癌的患者,与低危型胸腺瘤有统计学差异(P=0.001)。
高危型胸腺瘤及胸腺癌与低危型胸腺瘤在MSCT表现上可鉴别,而高危型胸腺瘤与胸腺癌之间多个MSCT表现无统计学差异,两者鉴别存在困难。但是,有文献[12]报道纵隔淋巴结增大多见于胸腺癌患者,而且比高危型胸腺瘤更为常见,因此,纵隔淋巴结增大的出现相对于其他类型胸腺瘤而言,更加能提示胸腺癌的发生。在本组病例中,胸腺癌患者的淋巴结增大及远处转移较高危型胸腺瘤明显,与文献报道一致。
综上所述,MSCT检查中TET肿瘤形态不规则,边缘不光整,肿瘤非边缘部分钙化,纵隔脂肪线模糊和(或)消失及增强后密度不均匀、合并胸腔积液或胸膜增厚常能提示为高危型胸腺瘤或胸腺癌,如果伴有纵隔肿大淋巴结和(或)远处转移则需要考虑胸腺癌的发生。而MSCT多平面重组(MPR)技术能够进行多方位观察,不仅能了解更多的肿瘤内部细节及与周围组织关系,而且有助于了解肿瘤侵犯程度,从而可以为临床制定治疗策略提供更多信息。

