聚乙烯醇/壳聚糖载药电纺纤维膜的制备及性能表征
章亚妮,邬珊维,徐佳瑶,陈 伟,吕媛媛
(浙江大学城市学院医学院,浙江 杭州 310015)
静电纺丝是一种借助于静电场作用对聚合物溶液或熔体进行纺丝的过程,它所形成的纤维直径为亚微米级。静电纺丝制成的超细纤维膜,具有多孔结构,有较高的比表面积,在过滤、纳米复合材料、伤口敷料以及组织工程支架等方面具有许多潜在的用途。静电纺丝法制备的修复用无纺纳米纤维膜的孔径通常为50 nm~1μm,可以用来阻挡细菌和灰尘所致的创伤感染,因此在伤口敷料领域具有广泛的用途[1-3]。丹参素(Salvianic acid A,SA)是从中国传统中药唇形科植物丹参中提取到的一个具有酚性芳香酸类化合物,具有广泛的药理作用。近年来愈来愈多的研究表明,丹参素能促进创伤组织修复:丹参素对转化生长因子-β(TGF-β)、血小板活化因子(PAF)、肿瘤坏死因子-α(TNF-α)、γ-干扰素(IFN-γ)、碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)等多种细胞因子的分泌具有调节作用,且能显著抑制内毒素诱导的上述因子的大量分泌,具有抗炎和增强免疫这两方面的调节作用;此外,能促进实验性创伤动物感染创面修复,并可显著抑制TNF-α、IFN-γ 等炎症介质的产生[4-6]。通过改变给药途径,将丹参素作为主药载入高分子载体材料中,结合高新材料加工方法制备成现代新型医用敷料,不仅赋予丹参素外用于皮肤的新用途,也为中药剂型开发开辟了新途径。
壳聚糖(Chitosan,CS)具有止痛、止血、减小疤痕、良好的生理相容性和生物可降解性等优异性能非常适宜于作为伤口敷料的原料[7-10]。但由于它所形成的膜较脆,力学性能不好,因而常采用与其他生物可降解高分子材料相结合,经高新技术方法加工制成复合型敷料。因此,本研究采用生物相容性良好的天然高分子材料壳聚糖(Chitosan,CS)和成纤性好、生物相容性优、可生物降解的合成高分子聚合物聚乙烯醇(Polyvinyl alcohol,PVA)混合为载体材料,担载丹参素钠(Salvianic acid A sodium,SAS;丹参素在自然界中不稳定,故把其做成钠盐,功效和丹参素一样),通过静电纺丝制备成载药医用纤维,对纤维的形态、药物与纤维载体的结合状态、纤维含药量以及载药纤维的释药特性进行了研究,为以后的临床应用提供部分实验依据。
1 材料与方法
1.1 试剂与仪器 聚乙烯醇(PVA,聚合度1750±50,国药集团化学试剂有限公司),壳聚糖(CS,医用级,脱乙酰化度为82.5%,国药集团化学试剂有限公司),乙酸(分析纯,国药集团化学试剂有限公司),丹参素钠(SAS,纯度99%,西安鸿生生物技术有限公司),紫外可见吸收光谱仪(UV 2450,Shimadzu,日本),傅立叶红外光谱仪(Nexus 470,Nicolet,美国),场发射扫描电镜(SIRON-100,FEI,美国),微量注射泵(WZ-50C2,浙江大学医药仪器有限公司),高压电源(DW-P303-1ACF0,天津东文高压电源厂),Millipore 去离子水机(Milli-Q)。
1.2 方法
1.2.1 载药电纺纤维膜的制备 将5 g 聚乙烯醇(PVA)颗粒在搅拌情况下缓缓加入到45 ml 超纯水中,充分溶胀后升温至90℃左右加速溶解,并保温3 h,直到溶液不再含有微小颗粒,制得透明的PVA 溶液。再称取0.1g 壳聚糖(CS)溶解在10 ml 超纯水中,然后滴加3 滴乙酸,直到溶液澄清后滴加到40 ml 的上述PVA溶液中,制得PVA/CS 的前驱体溶液。分别加入1.0%、2.0%、3.0%、4.0%、6.0% (为聚合物溶液总质量百分数)的丹参素钠(SAS),在室温下充分搅拌,混合均匀后于静电纺丝仪器上纺丝。纺丝条件如下:电源电压22 kV,针头与接收基板之间的距离14 cm,供料速度1.0 ml/h,整个静电纺丝过程在室温下进行,收集10 h后即可在铝膜上收集到PVA/CS/SAS 静电纺丝纤维,于50℃真空干燥箱中干燥约3 h 至恒重,再置于PVC 塑料袋中封口保存待用。
1.2.2 形貌观察 制得的纳米纤维膜干燥后,喷金,扫描电镜检测,观察纳米纤维的形貌。
1.2.3 含药量的测定 称取干燥的60 mg 含有丹参素钠的电纺纤维膜,加入到50 ml 的磷酸缓冲溶液(PBS,pH 7.4)中,在37℃恒温水浴中振荡72 h (70次/min),离心10 min,吸取上层清液,用紫外可见吸收光谱仪在“丹参素钠”的最大吸收波长λ=280 nm 处测定其吸光度。通过对比标准曲线获得药物的浓度。标准曲线可以通过检测一系列标准浓度的丹参素钠溶液的吸光度来进行绘制,方程为:A=0.124C +0.0008,R2=0.9999。式中A 是吸光度值,C 是丹参素钠溶液的浓度,单位为mg/L。载药纤维的含药量按下式计算:含药量=ml/m,其中ml为载药纤维中丹参素钠量,m 为电纺纤维膜质量。
1.2.4 体外释药曲线的测定 将干燥的载药纤维膜(60 mg)置于盛有10 ml 磷酸缓冲溶液(PBS)(pH 7.4)的锥形瓶中,于37℃下恒温振荡,每隔一定时间取出1 ml 溶液,再向锥形瓶中加入等量的PBS 缓冲溶液,保持体积恒定。用紫外可见吸收光谱仪在“丹参素钠”的最大吸收波长λ=280 nm 处测定其吸光度,由药物标准曲线方程计算药物浓度及释药量,再计算累积释药百分率并作累积释药曲线。累计释药率=mt/m×100%,其中mt为释放t 时刻丹参素钠的累积释放质量,m 是载药纤维中丹参素钠的实际含量[11]。
2 结果与讨论
2.1 不同载药量电纺纤维膜的形貌表征 加有6% SAS 的纺丝溶液无法纺丝,喷出的全为小液滴。将加有1%、2%、3%、4% SAS 的电纺纤维于扫描电镜下观察,发现4 种药物含量的纺丝液均可以成纤,但SAS 为4%的纤维有串珠状结构,且SAS 量越少其纺丝表面越光滑,串珠状纺丝越少或没有(图1)。这是由于随着SAS 量的增大,纺丝溶液可纺性变差,可能原因是PVA 和CS 均为大分子化合物,当加入小分子化合物SAS 时,使喷射流表面的电荷密度增大,从而喷射流载有更多的电荷,在电场中受到更大的牵伸力,导致喷射流不稳定[12]。通过测量不同载药量的电纺纤维的直径,发现纤维直径与载药量成反比,但差别不大,平均直径在280~390 nm 之间。同时可以观察到,药物载入电纺纤维之后,没有固相分离现象,也没有药物结晶颗粒出现,反映了药物与成纤聚合物载体之间良好的相容性。其具体原因可能是在电纺过程由于高压电场力的作用,溶剂迅速挥发,PVA/CS 快速成纤,抑制了药物在纤维成纤过程中的晶核的形成以及微晶聚结成颗粒的现象,使得药物在电纺纤维高度均匀分散。
2.2 载药电纺纤维膜的红外表征 图2 显示了PVA/CS 电纺纤维膜、丹参素钠(SAS)以及PVA/CS/SAS 电纺纤维膜的红外光谱。PVA/CS 电纺纤维膜的红外光谱中,在3428 cm-1处有强而宽的归属于羟基和氨基的伸缩振动峰,2923 cm-1处为C-H 的伸缩振动峰,1079 cm-1处为β-D 吡喃葡萄糖苷的伸缩振动峰[13]。图2(b)是丹参素钠的红外谱图:1660 cm-1处为羰基伸缩振动峰,1567 cm-1和1470 cm-1处为苯环上碳碳骨架伸缩振动峰,1267 cm-1处是羰基面内弯曲振动吸收峰,芳环上的C-H 面外弯曲振动峰出现在917~672 cm-1处。而PVA/CS/SAS 电纺纤维膜的红外光谱中则在1652 cm-1、1563 cm-1、1467 cm-1以及1265 cm-1等处出现吸收峰。这些吸收峰分别与丹参素钠的特征峰相对应,但出现了一定的蓝移,这可能是由于丹参素钠中的羟基可与壳聚糖中的羟基、氨基及聚乙烯醇中羟基之间形成了较强的分子间的氢键。这些结果也表明,丹参素钠分子与PVA 和CS 在载药纤维中有很好的相容性。这对于载药纤维的结构和性能稳定十分有利。作为一种药用成分,药物的化学稳定性是其能否有效发挥药效的关键所在。由图2 可见,丹参素钠的归属峰在载药纤维的图谱中均可见,说明在经历电纺高压过程后药物仍保持了其化学结构。这也就说明丹参素钠在成功载入PVA/CS 纤维中后,仍然保持原有的药物活性。

图1 不同理论含药量的聚乙烯醇/壳聚糖/丹参素钠电纺纤维膜的电镜照片Fig.1 FESEM micrographics of PVA/CS/SAS electrospun nanofibers of different theoretic drug loadings
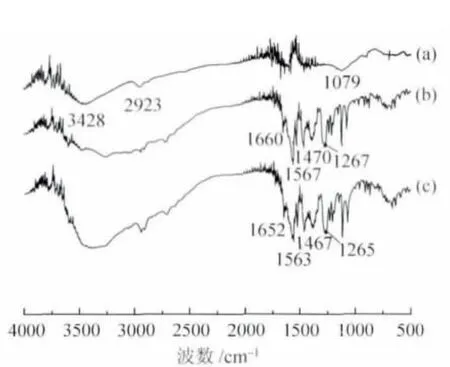
图2 不同样品的红外光谱图Fig.2 FT-IR spectra of different samples
2.2 含药量及体外释药曲线的测定结果 理论含药量不同的载药电纺纤维膜的实际含药量见表1。

表1 理论含药量不同的聚乙烯醇/壳聚糖/丹参素钠电纺纤维膜的含药量Table 1 Entrapment efficiency of SAS in PVA/CS/SAS electrospun nanofibers with different theoretic drug-loading amount
表1 显示PVA/CS/SAS 电纺纳米纤维膜的实际含药量均小于理论值。造成实际含药量小于理论值的原因可能是:在静电纺丝的过程中,有部分丹参素钠药物与载体材料发生结合,不能游离出来,或在喷丝过程,药物发生一定的泄漏;此外,药物的加入也使纺丝液的稳定性稍稍变差,使得纺丝液的纺丝性能下降,纺丝液在电纺过程有少量损失,最终载入纤维中药物的量略微减少[14]。
图3 是不同含药量的电纺纤维膜的释药曲线。由图可知,4 种载药纤维膜在最初8 h 内都存在突释现象,之后药物释放逐渐减缓。突释现象的产生是由于载药纤维膜在释药过程中的释放方式不同造成的。载药纤维中药物的释放首先发生在纤维的表层,形成了快释区。当纤维表面的药物释放完毕后,纤维内部的药物要通过扩散,才能到达纤维表面进行释放,由于扩散速率相对于释放速率相对平缓,因而形成药物的缓释区,释放速度也相对平缓[15]。理论含药量越高,前期释药速率更快,原因是含药量越高的纳米纤维,纤维的直径相对较小且表面的药物分布比较多。但随着纤维膜中含药量增加,药物释放度相应有所提高。在36 h 内,4 种载药纤维膜均可实现持续释放丹参素钠。以上结果说明了以聚乙烯醇/壳聚糖为基质的药物载体对丹参素钠药物具有一定的缓释作用。
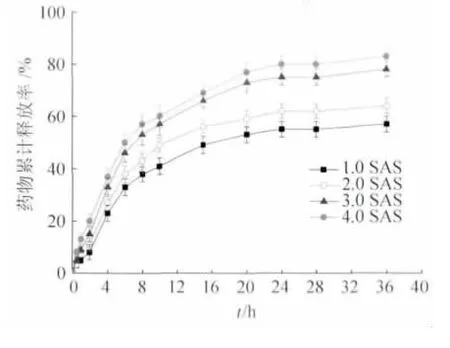
图3 不同理论含药量的聚乙烯醇/壳聚糖/丹参素钠电纺纤维膜的体外释药曲线Fig.3 In vitro release profiles of SAS from PVA/CS/SAS electrospun nanofibers of different theoretic drug-loading amount
3 结论
采用静电纺丝技术制备了负载不同含量丹参素钠的聚乙烯醇/壳聚糖载药电纺纤维膜,扫描电镜观察制备的电纺纤维平均直径在280~390 nm 之间。红外光谱表明,丹参素钠已经成功载入电纺纤维中,并且仍然保持原有的药物活性;通过对载药纤维的释药性能考察发现,载药纤维能较好地实现丹参素钠的缓控释放,有望应用于皮肤局部给药体系或伤口敷料领域。
[1]RUSSO G,LAMBERTI G.Electrospinning of drugloaded polymer systems:Preparation and drug release[J].J Appl Polym Sci,2011,122(6):3551-3556.
[2]GAUTAM S,DINDA A K,MISHRA N C.Fabrication and characterization of PCL/gelatin composite nanofibrous scaffold for tissue engineering applications by electrospinning method [J].Mat Sci Eng C,2013,33(3):1228-1235.
[3]IGNATOVA M,RASHKOV I,MANOLOVA N.Drug-loaded electrospun materials in wounddressing applications and in local cancer treatment[J].Expert Opin Drug Deliv,2013,10(4):469-483.
[4]WANG Wenjun,WU Xianzhong,YAO Zhi(王文俊,吴咸中,姚 智).The influence of emodin and Danshensu on monocyte's secretion of inflammatory cytokines[J].Chinese Journal of Immunology(中国免疫学杂志),1995,11(6):370-372.(in Chinese)
[5]SU Qinghe,YANG Minjie,ZHOU Hongmei,et al(苏 青 和,杨 敏 杰,周 红 梅,等).Effect of Danshensu on the burn wounds fibroblasts cells and collagen synthesis [J].Medical Journal of Communications(交通医学),2003,17(6),666-667.(in Chinese)
[6]WANG Yimin,WEI Fukang,LIU Min,et al (王益民,韦 福 康,刘 敏,等).Effect of salvia miltiorrhiza on autocrining growth factor by fibroblasts cultured in vitro[J].Chinese Journal of Reparative and Reconstructive Surgery(中国修复重建外科杂志),2002,16(6),408-410.(in Chinese)
[7]JAYAKUMAR R,PRABAHARAN M,KUMAR P T S,et al.Biomaterials based on chitin and chitosan in wound dressing applications[J].Biotechnol Adv,2011,29 (3):322-337.
[8]WANG T,ZHU X K,XUE X T,et al.Hydrogel sheets of chitosan,honey and gelatin as burn wound dressings[J].Carbohyd Polym,2012,88(1):75-83.
[9]TCHEMTCHOUA V T,ATANASOVA G,AQIL A,et al.Development of a chitosan nanofibrillar scaffold for skin repair and regeneration [J].Biomacromolecules,2011,12(9):3194-3204.
[10]ARCHANA D,SINGH B K,DUTTA J,et al.In vivo evaluation of chitosan-PVP-titanium dioxide nanocomposite as wound dressing material [J].Carbohydr Polym,2013,95(1):530-539.
[11]RUJITANAROJ P O,POMPHA N,SUPAPHOL P.Wound-dressing materials with antibacterial activity from electrospun gelatin fiber mats containing silver nanoparticles [J].Polymer,2008,49(21):4723-4732.
[12]RENEKER D H,YARIN A L,FONG H,et al.Bending instability of electrically charged liquid jets of polymer solutions in electrospinning[J].J Appl Phys,2000,87(9):4531-4547.
[13]ZHEN Hongpeng,YANG Dongzhi,GUO Suang,et al(甄洪鹏,杨冬芝,郭 爽,等).Preparation and sustained release in vitro of ofloxacin loaded in chitosan/poly(vinyl alcohol)blend nanofibrous mats [J].Journal of Beijing University of Chemical Technology(北京化工大学学报),2007,34(3):271-274.(in Chinese)
[14]NIE H,WANG C H.Fabrication and characterization of PLGA/Hap composite scaffolds for delivery of BMP-2 plasmid DNA [J].J Control Release,2007,120(1-2):111-121.
[15]PANYAM J,DALI M M,SAHOO S K,et al.Polymer degradation and in vitro release of a model protein from poly(D,L-lactide-co-glycolide)nanoand microparticles[J].J Control Release,2003,92(1-2):173-187.

