冬凌草甲素长循环冻干脂质体的制备及大鼠体内药动学研究
林 虎,渠晨曦,俞毅杰,汤逸宁,孙晓译
(浙江大学城市学院医学院,浙江 杭州 310015)
冬凌草甲素(Oridonin),一种以贝壳杉烯为骨架的四环二萜类化合物,是冬凌草中主要的抗肿瘤活性成分。体内外研究表明冬凌草甲素对多种肿瘤如肝癌、食道癌、胃癌、大肠癌、白血病、肺腺癌、宫颈癌、黑色素瘤等有明显的抑制作用[1-4],是一个极有开发前景的天然药物。但冬凌草甲素水溶解度低、油溶解性差、口服生物利用度低,大大限制了临床应用[5]。静脉用溶液剂“癌得宁”主要采用非水机溶剂(如丙二醇)和表面活性剂(如吐温80)来提高溶解度[6],长期静脉注射会带来血管发炎、疼痛等一系列安全问题,已逐步退出市场。
脂质体是一种具有类似生物膜结构的双分子泡囊,主要由磷脂和胆固醇构成。它具有提高难溶性药物溶解度、毒副作用小、易于靶向修饰等优点,已作为一种先进的药物传递系统,被越来越多的人认同,在各类纳米制剂中最易实现产业化。长循环脂质体是指用亲水高分子材料进行表面修饰的脂质体,特别是经聚乙二醇(PEG)修饰后可有效减少内皮网系统(RES)的吞噬,延长药物体内循环时间,使脂质体透过肿瘤生长部位血管的几率增大,从而增加药物在肿瘤组织内的积聚[7]。
本研究拟利用乙醇注入法制备冬凌草甲素长循环脂质体,通过冷冻干燥技术得到冻干粉针,解决冬凌草甲素脂质体稳定性差的问题[8],并研究冻干脂质体大鼠体内药动学特征,为冬凌草甲素长循环脂质体的研究和开发提供理论与实验依据。
1 材料与方法
1.1 试剂与材料 冬凌草甲素(纯度99%,西安昊轩生物科技有限公司);胆固醇(上海晶纯试剂有限公司);大豆磷脂购自Lipoid 公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(DSPEPEG 2000,日本精细化工株式会社);Sephadex G-50、葡萄糖、甘露醇等均购自华东医药。
1.2 实验动物 SD 雄性大鼠,体重(200±10)g,购自上海斯莱克实验动物有限责任公司,实验动物许可证号SCXK(沪)2012-0002。
1.3 冬凌草甲素长循环冻干脂质体的制备采用乙醇注入法制备脂质体[9]。将处方量的冬凌草甲素、卵磷脂、胆固醇、DSPE-PEG 2000溶于乙醇,一边搅拌一边滴加至含有冻干保护剂的生理盐水中。探头超声(功率80 W,工作1 s,暂停1 s,重复30次,宁波新芝),均化脂质体粒径,过0.22μm 微孔滤膜。将上述长循环脂质体分装至西林瓶中,于-40℃预冻8 h,于-40 ℃真空干燥5 h,-40 ℃~0 ℃干燥14 h,然后升温至25 ℃共持续5 h 去除残余水分(CHRIST Alpha 2-4 LSC 冷冻干燥仪,德国)。冬凌草甲素普通脂质体除不含DSPE-PEG 2000外,其余组成同上。
1.4 脂质体表征
1.4.1 粒径测定 取冻干脂质体,以生理盐水复溶,稀释至合适浓度,激光衍射粒度分析仪(Nano ZS90,马尔文,英国)测定粒径及分布。
1.4.2 包封率测定 采用葡聚糖凝胶柱(1.5 cm×15 cm)分离脂质体和游离药物,上样量1 ml,洗脱液为生理盐水。定时收集流出物,将脂质体部分用乙醇溶解后,HPLC 测定药物浓度。色谱条件:Agilent 1260 液相色谱仪,色谱柱为Diamosil C18(4.6 mm×250 mm,5μm);流动相:甲醇-水(70/30,v/v),流速:1 ml/min,柱温:30 ℃,进样量:20μl。包封率EE(%)=脂质体内包裹的药物量/投药量。脂质体和游离药物实现完全分离,药物溶液和空白脂质体混合物的回收率为95.47%。满足分析要求。
1.4.3 体外释放 取冻干脂质体适量,以PBS复溶。如“1.4.2”项下纯化脂质体,将载有总量为1 mg 冬凌草甲素的脂质体放入透析袋(MWCO:14 kDa)内。透析外相为50 ml 0.5%Tween 80 的PBS。37℃,100次/min 振摇条件下,间隔一定时间取样0.5 ml,同时补加新鲜释放液。样品过0.45μm 微孔滤膜,“1.4.2”项下HPLC 法测定释放液药物浓度。
1.5 药动学实验
1.5.1 血浆样本采集及处理 冬凌草甲素普通冻干脂质体及冬凌草甲素长循环冻干脂质体以适量生理盐水复溶,备用。大鼠18 只,随机分为3组,每组6 只,尾静脉分别注射冬凌草甲素普通复溶脂质体、冬凌草甲素长循环复溶脂质体、冬凌草甲素溶液,剂量为10 mg·kg-1。于给药后0.25、0.5、1、2、4、8、12、24、48 h 尾静脉取血,离心后取上层血浆按照“1.5.2”项下处理,计算血药浓度。
1.5.2 体内分析方法 精确称取冬凌草甲素25 mg 置25 ml 量瓶中,甲醇溶解定容,配成1.0 mg/ml 冬凌草甲素标准溶液。分别用空白血浆将上述标准液稀释成0.25、0.5、2.5、5.0、10.0、20.0、30.0、40.0μg/ml 系列标准液。参照文献[10],略有修改,进行血浆处理。取200μl 上述含药血浆,向其中加入3 ml 乙酸乙酯-异丙醇溶液(19∶1),混合提取5 min,离心10 min(5 000 r/min,4℃),取上清2.5 ml,37℃氮气挥干,100μl 甲醇复溶,取上清进行HPLC 分析,记录色谱图,以外标法进行定量。HPLC 色谱条件参考“1.4.2”,流动相比例为甲醇-水(50/50,V/V)。在0.25~40μg/ml 浓度范围内得回归方程A=12.645C+6.8278(r=0.9993)。浓度分别为0.2μg/ml、10μg/ml、40μg/ml 的血样日内、日间精密度均小于7%;0.2μg/ml、10μg/ml、40μg/ml 样品绝对回收率>70%,符合体内分析要求。
1.6 统计学处理 数据以“均数±标准差”表示,采用单因素方差分析,两两比较使用SNK检验,P<0.05 为差异有统计学意义。
2 结果
2.1 药脂比对包封率的影响 固定辅料用量:卵磷脂45 mg、胆固醇22 mg、DSPE-PEG 2000 80 mg,改变冬凌草甲素投药量,使药脂比(磷脂+胆固醇+DSPE-PEG 2000/冬凌草甲素质量)为1∶24、1∶12、1∶6、1∶3,结果见图1。随着脂质用量的增加,包封率显著增加(P<0.05)。当达到1∶12 时,包封率不再增加。
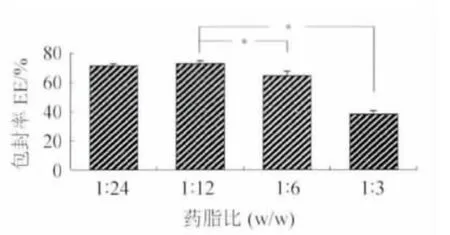
图1 药脂比对包封率的影响Fig.1 The effect of drug/lipid ratio on entrapment efficiency
2.2 磷脂/胆固醇比例对包封率的影响 固定DSPE-PEG 2000 用量80 mg、冬凌草甲素25 mg、磷脂与胆固醇总量67 mg,制备不同比例磷脂/胆固醇构成的长循环脂质体10 ml,再将其冻干。包封率结果如图2 所示。随着胆固醇用量的增加,长循环脂质体的包封率逐渐增加。当达到2∶1时,包封率达到最大值,与其余组有显著性差异(P<0.05)。继续加大胆固醇用量,当比例为1∶1时包封率不再增加,反而有所下降,且粒径有所增大(210 nm)。
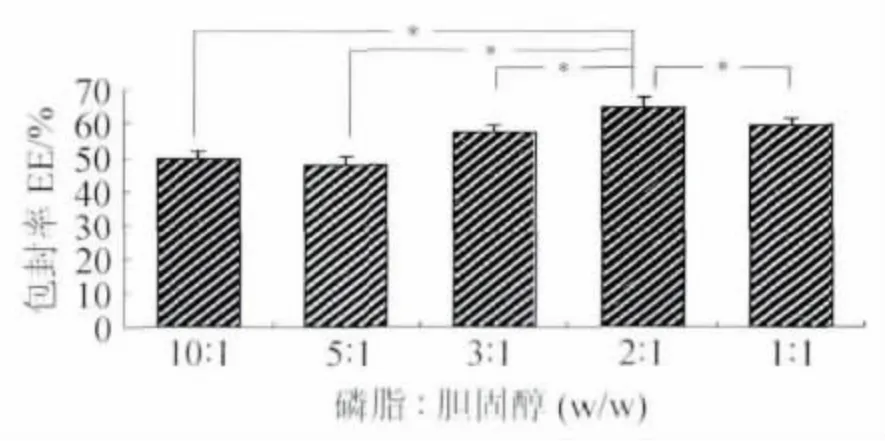
图2 磷脂与胆固醇比例对包封率的影响Fig.2 The effect of ratio of lecithin to cholesterol on entrapment efficiency
2.3 DSPE-PEG 2000 用量对包封率的影响固定处方中冬凌草甲素25 mg、卵磷脂45 mg、胆固醇22 mg 用量,分别添加20、40、80、100、120 mg DSPE-PEG 2000,制备冻干脂质体10 ml。由图3 可见DSPE-PEG 2000 对包封率影响不大,无显著差异(P<0.05),均在60%左右。

图3 DSPE-PEG 2000 对包封率的影响Fig.3 The effect of DSPE-PEG 2000 on entrapment efficiency
2.4 冻干保护剂筛选 预实验发现,以葡萄糖、甘露醇做冻干保护剂效果优于乳糖、右旋糖酐、蔗糖。复溶时间较短;复溶后粒径变化较小、呈单峰分布;包封率高。但葡萄糖做保护剂时,产品有萎缩现象。甘露醇外形饱满,但复溶时间偏长。冻干保护剂用量高于磷脂重量5 倍时,冻干品外观饱满。低于3 倍时,容易发生皱缩。综上,我们合用葡萄糖和甘露醇,用量为磷脂质量的5 倍,对葡萄糖和甘露醇比例进行筛选(表1)。保护剂比例对包封率无显著影响(P<0.05),随着葡萄糖比例的增加,复溶脂质体粒径变小,分布变窄。同时考虑价格因素,最后选用葡萄糖:甘露醇=3:1 作为冻干保护剂。得到的冻干品外观良好,水化后,轻轻振摇,2 min 内可分散为均匀胶体溶液。

表1 冻干保护剂对冬凌草甲素长循环脂质体粒径及包封率的影响Table 1 The effect of freeze-drying protectant on particle size and entrapment efficiency of long-circulation oridonin liposomes
2.5 体外释放 体外释放以冬凌草甲素溶液为对照,结果显示两种冬凌草甲素脂质体均有明显的缓释效果,缓释时间达72 h。表面修饰对脂质体释放速度影响不大,长循环冻干脂质体后期释放稍快于普通脂质体(图4)。

图4 冬凌草甲素脂质体释放曲线Fig.4 In vitro release of oridonin liposomes
2.6 药动学实验 根据HPLC 测定结果,绘制大鼠血药浓度-时间曲线(图5),数据以Kinetica 软件分析处理,结果见表2。长循环脂质体较溶液和普通脂质体有更长的t1/2α和t1/2β,差异有统计学意义(P<0.05)。MRT 与溶液和普通脂质体组有显著性差异(P<0.05),分别为二者的6 倍和2 倍;AUC 也有大幅提高(P<0.05),分别为溶液组和普通脂质体的3 倍及2 倍。
表2 冬凌草甲素大鼠药动学参数Table 2 Pharmacokinetic parameters of oridonin(,n=6)
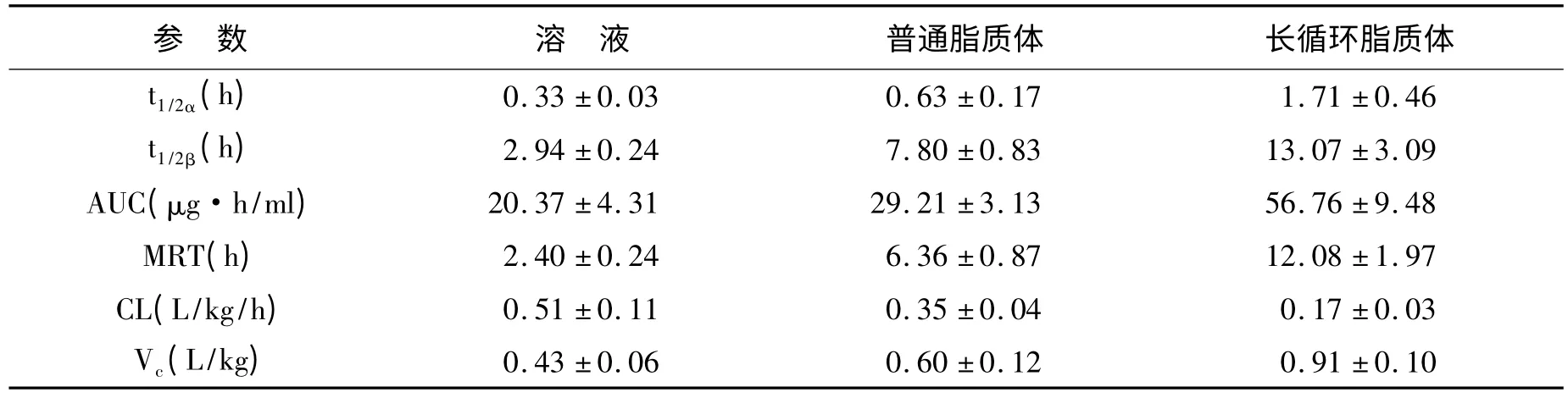
表2 冬凌草甲素大鼠药动学参数Table 2 Pharmacokinetic parameters of oridonin(,n=6)

图5 大鼠尾静脉注射冬凌草甲素溶液、普通脂质体和长循环脂质体后血药浓度-时间曲线Fig.5 Mean plasma concentration-time curve in rats after intravenous dose of oridonin solution,oridonin liposomes and longcirculation oridonin liposo-mes
3 讨论
冬凌草甲素长循环脂质体的制备目前主要采用薄膜分散法[11],但存在载药率不高(约1 mg/ml)、工艺放大较为困难等问题。本研究采用的乙醇注入法简单易行,重复性好,得到的脂质体载药量可提高至1.5 mg/ml。利用冷冻干燥技术,我们制备了冻干脂质体,与文献[8]相比,有效解决了长循环脂质体存放过程中的物理及化学稳定性方面的问题。
为优化处方,我们进行了单因素实验。脂质体通过磷脂双分子层实现对冬凌草甲素的包载,随着处方中磷脂比例的增加,包封率和载药能力增大[12]。但当药脂比从1:6 增加到1:12时,脂质体包封率只略有增加。为获得较好的载药量,尽可能减少脂质用量,我们选择药脂比1:6 制备冬凌草甲素长循环冻干脂质体。胆固醇对脂质体的包封率也有较大影响,作为膜流动性调节剂,可增加脂质双分子层通透性,降低药物渗漏,用量过大,则可造成脂质膜刚性偏大,不利于药物的包载[13]。当卵磷脂和胆固醇的比例为2:1 时,制备的脂质体包封率最大,粒径较小。DSPE-PEG 2000 是目前公认且最为常用的长循环修饰分子,其高分子亲水长链可保护脂质体避免单核-巨噬系统的吞噬,延长体内循环时间。脂质体表面PEG 亲水链密度对长循环作用的发挥极为重要作用,可保证脂质体有效通过EPR 效应到达瘤体部位;但过高的DSPE-PEG 浓度又会妨碍肿瘤细胞对脂质体的摄取。另一方面,PEG 长链还可减少脂质体间接触、碰撞和聚集的机会,增加脂质体的物理稳定性。在对包封率无显著影响的前提下(图3),我们根据常用DSPE-PEG 2000 修饰浓度[14],确定80 mg 的用量,用以制备长循环脂质体。冻干保护剂用量和种类对脂质体复溶粒径、包封率、冻干品外观都有显著影响。经过筛选,我们最终确定优化处方为大豆磷脂∶胆固醇∶DSPE-PEG 2000 为1∶0.5∶1.8(w/w),药脂比为1∶6(w/w)。冻干保护剂为葡萄糖∶甘露醇=3∶1,用量为脂质总量的5 倍。
根据以上处方制备的长循环冻干脂质体具缓释效果,DSPE-PEG 修饰对其体外释放行为无显著影响。与普通脂质体相比,其后期稍快的释放速度可能与PEG 长链有关。亲水层减少了脂质体表面张力,使水分更容易接触脂质体表面,从而加快了药物释放[15]。
采用HPLC 法测定血样中冬凌草甲素浓度时,我们发现按照参考文献[10]使用乙酸乙酯进行提取时,回收率较低。经过对提取溶剂的筛选,最终选用乙酸乙酯-异丙醇溶液(19∶1),绝对回收率达70%,可满足分析要求。
目前有关冬凌草甲素长循环脂质体药动学的研究是给药后在不同的时间点将小鼠处死,取血浆分析,存在动物用量大、个体差异大的问题。本研究通过尾静脉采集单只大鼠完整时间点的血浆样品,避免了上述问题[11]。体内药代动力学研究结果表明,将冬凌草甲素制成普通脂质体和长循环脂质体后,改变了冬凌草甲素在大鼠体内的分布,各动力学参数发生明显变化。与冬凌草甲素长循环固体脂质体纳米粒药动学结果相似[15],3 种制剂均符合双室模型特征[16],MRT、AUC 等参数显著增加,表明冬凌草甲素长循环冻干脂质体可有效延长药物在血液中的存留时间,维持较高的血药浓度,提示长循环冻干脂质体可以增加冬凌草甲素的抗肿瘤活性。
[1]LIU Z,OUYANG L,PENG H,et al.Oridonin:targeting programmed cell death pathways as an anti-tumour agent[J].Cell Prolif,2012,45(6):499-507.
[2]LI C Y,WANG E Q,CHENG Y,et al.Oridoninnin:An active diterpenoid targeting cell cycle arrest,apoptotic and autophagic pathways for cancer therapeutics[J].Int J Biochem Cell Biol,2011,43(5):701-704.
[3]KANG N,ZHANG J H,QIU F,et al.Induction of G(2)/M phase arrest and apoptosis by oridonin in human laryngeal carcinoma cells[J].J Nat Prod,2011,73 (6):1058-1063.
[4]CHEN S S,MICHAEL A,BUTLER-MANUEL S A.Advances in the treatment of ovarian cancer:a potential role of antiinflammatory phytochemicals[J].Discov Med,2012,13(68):7-17.
[5]XU W,SUN J,ZHANG T T,et al(徐 文,孙进,张 婷 婷,等).Determination of equilibrium solubility of oridonin and its apparent oil/water partition coefficient by HPLC [J].Journal of Shenyang Pharmaceutical University(沈阳药科大学学报),2010,27(2):81-92.(in Chinese)
[6]WANG Y W,LU X C,CAO J Y(王有为,卢笑丛,操继跃).冬凌草甲素注射剂及其制备工艺[P].CN 200410061309.8,2005.(in Chinese)
[7]MARUYAMA K.Intracellular targeting delivery of liposomal drugs to solid tumors based on EPR effects[J].Adv Drug Deliv Rev,2011,63(3):161-169.
[8]WANG C J(王传金).Studies on long-circulation oridonin liposomes [D].Nanjing,Nanjing University of Science and Technology (南京理工大学),2009.(in Chinese)
[9]LIANG W Q,SUN X Y,DONG S Y(梁文权,孙晓译,董思宇).冬凌草甲素粉针及其制备方法[P].CN 200710156144.6,2010.(in Chinese)
[10]GAO L,ZHANG D,CHEN M,et al.Studies on pharmacokinetics and tissue distribution of oridonin nanosuspensions [J].Int J Pharm,2008,355(1-2):321-327.
[11]WANG C,WEI Y,YU L,et al.The effect of stealth liposomes on pharmacokinetics,tissue distribution and anti-tumor activity of oridonin [J].PDA J Pharm Sci Technol,2009,63(5):409-416.
[12]CURIC' A,REUL R,MÖSCHWITZER J,et al.Formulation optimization of itraconazole loaded PEGylated liposomes for parenteral administration by using design of experiments[J].Int J Pharm,2013,448(1):189-197.
[13]CHARNVANICH D,VARDHANABHUTI N,KULVANICH P.Effect of cholesterol on the properties of spray-dried lysozyme-loaded liposomal powders [J].AAPS PharmSciTech,2010,11(2):832-842.
[14]PELEG-SHULMAN T,GIBSON D,COHEN R,et al.Characterization of sterically stabilized cisplatin liposomes by nuclear magnetic resonance [J].Biochim Biophys Acta,2001,1510(1-2):278-291.
[15]JIA L,SHEN J,ZHANG D,et al.In vitro and in vivo evaluation of oridonin-loaded long circulating nanostructured lipid carriers [J].Int J Biol Macromol,2012,50(3):523-529.
[16]JIAN G,WANG YW,LU XC,et al.Determination of oridonin in rat plasma by reverse-phase highperformance liquid chromatography[J].J Pharm Biomed Anal,2007,43(2):793-797.

